显微镜变显“纳”镜了!
2015-09-10林宫玄
林宫玄




显微镜的 纳米时代
在17世纪光学显微镜发明后,微米(1微米=10-6米)大小的细胞映在人类眼前,开启了微生物学。1873年,恩斯特·阿贝(Ernst Abbe)证明了光学显微镜的分辨率只能达到光波长的1/2左右,称为阿贝极限。而人类所能看到的光波长在400纳米(1纳米=10-9米)到700纳米左右,因此200纳米或0.2微米一直是一般光学显微镜分辨率无法突破的瓶颈。
在光学显微镜发明后的几百年间,微米左右的物体一直是人类所能观察到的最小尺度。直到20世纪初电子显微镜的问世,人类才开始看到纳米大小的物体。但是“显纳镜”这个词并没有被广泛使用。现今,显微镜已不代表是只能看见微米尺度的仪器。显微镜的功用是将微小物体的影像放大,使肉眼能够看见。不过生活用语中的显微镜,仍大多指光学显微镜。
既然电子显微镜的分辨率能看到纳米物体,为什么一般光学显微镜仍是生命科学领域重要的研究工具呢?主要原因在于电子显微镜只能观察经过冷冻切片处理的生物样品。换言之,样品是死的。原子力显微镜也是拥有纳米分辨率的仪器,目前已发展到可观察水中的活细胞。然而原子力显微镜只能观察到样品表面的形貌,无法看到细胞内部的构造。虽然一般光学显微镜的分辨率远比电子显微镜与原子力显微镜分辨率差,但是具有观察活细胞内部构造随时间变化的优势。因此,光学显微镜至今仍是研究生命科学很普遍的利器。2014年,瑞典皇家科学院将诺贝尔化学奖颁给了美国霍华德·休斯医学研究所的艾力克·贝吉格(Eric Betzig)、德国马克斯·普朗克生物物理化学研究所的斯特凡·赫勒(Stefan Walter Hell),以及美国斯坦福大学的威廉·莫厄纳(William Esco Moerner)三人,表扬他们将光学显微镜带到纳米世界的贡献。
TIPS
什么是纳米?
纳米又称毫微米,是一种长度单位,1纳米为1/100万毫米,也就是1/10亿米。 纳米科技是本世纪重要的尖端科技之一,全世界先进国家均投入大量经费在这跨物理、化学、生物、材料与工程等领域的项目上。
突破 阿贝极限
超解析荧光显微镜的发明使显微技术出现了新的契机。所谓“超解析”的意思是突破阿贝极限,让分辨率达到几十纳米,使科学家可以观察活细胞内纳米物体的变化,譬如研究分子如何在脑内神经细胞之间形成突触。
阿贝极限虽证明了一般光学显微镜的分辨率,但科学家们仍然想尽各种办法希望能够突破阿贝极限,直接看到超高分辨率的光学影像。使用近场光学扫瞄显微镜便是其中一个直接的方法。其原理与原子力显微镜类似,利用光纤当作针尖,以非常靠近待测物表面至几个纳米的距离,扫描待测物的光信号。虽然近场光学显微镜可利用微小的针尖达到20纳米的分辨率,但是针尖越小,收光效率越差,在生物影像应用上没有得到好的成效。
另一方面,如果对于照明光源的物理特性了如指掌,也可经由数学分析,得到超解析光学影像。譬如,构造化照明显微术借由控制照明光的周期图案与待测物的干涉形成云纹图形,并将影像经过计算后,其分辨率可突破阿贝极限。经由数学方法,构造化照明显微术可以将一般光学影像的分辨率提高到两倍以上。台湾“中央研究院”应用科学研究中心李超煌博士所发明的超解析光学显微镜,也是利用调控光源与待测物的交互作用,借由影像后处理得到小于200纳米的分辨率。
TIPS
阿贝极限
19世纪末,德国物理学家恩斯特·阿贝指出:光学显微镜分辨率的极限,大约是可见光波长的一半。可见光中波长最短的是蓝紫光,其波长在0.4微米左右。因此,如果两点之间的距离小于0.2微米,我们将无法分辨出这是两个点。这就是通常所说的“阿贝极限”。阿贝极限使我们无法更加深入地了解微观世界,例如病毒的直径通常就在0.02~0.3微米,无法用已有的光学显微镜观察清楚。
神奇的 绿荧光蛋白质
荧光分子在受到高能量(短波长)的光激发以后,会放出较低能量(长波长)的光,称为荧光。荧光显微镜已经是生命科学中很常见的研究工具。绿荧光蛋白质的发现,使得细胞不必经由额外荧光染色便可直接观察,成为活细胞动态变化观察的强力工具。因此,诺贝尔奖在2008年表彰绿荧光蛋白质的合成技术,它让荧光显微镜能用来观察活细胞的形态变化。
1989年,莫厄纳首度量测到单一分子对光的吸收,开启了单一分子的研究领域,吸引许多科学家投入。1997年,莫厄纳在单一绿荧光蛋白质分子的突变体上有重要的发现,引发了许多利用光活化来控制绿荧光蛋白质发光的研究,譬如2002年,美国国家卫生院的利平科特·施瓦茨(Jennifer Lippincott-Schwartz)在美国《科学》(Science)期刊发表了一种绿荧光蛋白质突变体:原本不会发光的绿荧光蛋白质突变体,在413纳米激光照射后会变成活化态,被488纳米激光发可放出荧光(509纳米);而在持续以488纳米光的激发下,分子最后会因为光褪色效应,无法再被活化而放出荧光。
不断提升的 影像分辨率
1995年,贝吉格提出了利用荧光分子提高分辨率的想法:如果将不同颜色的荧光分子均匀染色在样品中,让每个颜色的荧光分子间距都大于阿贝极限,则可利用点扩散函数将分子精准定位。只要将每个颜色的定位影像组起来,即使不同颜色的荧光分子距离只有几纳米,还是能解析出来。不过,要把这个想法实现很困难。譬如要如何将不同颜色的荧光分子均匀染色?
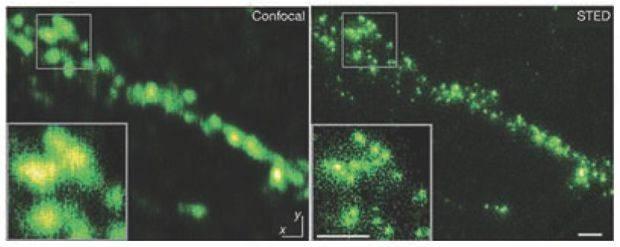
多年后,贝吉格看到了2002年施瓦茨在《科学》期刊发表绿荧光蛋白质的独特光学性质结果,让他有机会实现在1995年提出的想法。他发现实验并不需要区分荧光颜色,还是可以利用不同时间活化绿荧光蛋白质的方式,来组合超高解析影像。贝吉格把这个技术称为光活化定位显微术,就是将会发光的蛋白质接在溶小体(细胞胞器)的膜上,利用此显微术得到超解析度的溶小体荧光影像,并于2006年与施瓦茨合作,成功实现了这个想法。同年,美国哈佛大学的庄晓薇也参考了贝吉格1995年的构想,实验证实利用其他生物常用的荧光分子随机发光特性,也可达到超分辨率,并命名为随机光学重建显微术。
过去的20年,赫勒也一直想着如何突破阿贝极限,而他是从荧光分子的“受激放射”性质着手,想到了一个利用荧光的开关来提升影像分辨率的方法,于1994年发表了受激放射耗乏显微术。2000年以后,赫勒开始实验证明这个想法是可行的。他结合激发激光与受激放射耗乏激光,聚焦在荧光分子染色的生物样品上,借由纳米精确度的扫描,可得到超解析荧光影像。
TIPS
自发性放射与受激放射
荧光分子有基态、激发态等形态。当激发光源将电子从基态跃迁到激发态后,电子能量会在0.1纳秒内从高振动态递减,并在最低振动态停留几纳秒。最后当电子跃迁到基态中任何一个振动态而放出的光,即称为自发性放射,一般荧光显微镜所观察的光即是自发性放射的荧光。然而,若电子在激发态时,遇到另一道光刚好对应在电子可跃迁的能量时,电子会受到刺激而马上跃迁到基态并放出光,即受激放射。
向三维纳米分辨率迈进
超解析荧光显微镜提供了发明光学显微镜一个不同的思维。在没有利用荧光分子的特殊性质前,超解析光学显微镜是利用对光性质的了解去设计的,与所要观察的样品无关。超解析荧光显微镜的原理所带来的启发,是可以针对观察物的性质,譬如荧光的开关控制行为来进一步提升光学影像分辨率。台湾有一部分研究就是受到这个概念所启发,譬如台湾“中央研究院”原子与分子科学研究所张焕正博士利用荧光纳米钻石发展受激放射耗乏显微术,台大物理学系朱士维教授利用金纳米粒子的饱和作用,达成超解析光学影像;笔者就读台大光电工程学研究所时与指导教授孙启光发表了利用脉冲激光在氮化铟镓纳米薄膜产生音波的非线性效应,突破阿贝极限取得纳米分辨率超音波影像。
结合人类原本就对光传播性质的了解,利用调控光源与待测物的交互作用,以及荧光分子的特殊性质,让超解析荧光显微镜的发展更快。譬如构造化照明显微镜,可借由荧光分子的饱和效应进一步提升分辨率,称为饱和构造化照明显微术。超解析荧光显微镜也搭配光源的分析,进一步发展出三维纳米分辨率的光活化定位显微术、三维随机光学重建显微术、三维受激放射耗乏显微术等。
虽然超解析荧光显微镜已经证明可以直接观察活细胞内纳米等级的蛋白质与胞器,然而科学家是不会永远满足于目前的分辨率。超解析荧光显微镜的分辨率有赖于好的荧光分子特性,譬如开关的控制或随机性,及被激光打坏的功率上限;研制出好的荧光分子,以更方便地染在活细胞里,这是一条很清楚的路。
显微镜除了在分辨率上的追求,科学家也希望提升影像速度,方便观察细胞内快速的动态行为,目前这些技术最快也需要1秒左右取得一张高解析二维影像。为了解决影像速度的问题,近几年来,光片照明显微术开始蓬勃发展,今年从贝吉格实验室回国的陈壁彰博士也开始在台湾“中央研究院”应用科学中心研究光片照明显微术。
随着显微技术的不断提高和进步,我们期待更好的光学显微镜让科学家未来在生命科学领域有更多的突破和发现,帮助人类对抗疾病,改善人类的生活。
