结直肠癌术后患者血清趋化因子CXCL9变化及其与肿瘤复发、转移的关系*
2015-09-07殷庆章程志俭徐宏智汤承辉龚梨峰
洪 亮 殷庆章 程志俭 徐宏智 汤承辉 龚梨峰
复旦大学附属上海市第五人民医院普外科(200240)
结直肠癌(colorectal cancer,CRC)是消化道最常见的恶性肿瘤,发病率高居全球肿瘤发病的第三位,且一直呈上升趋势[1]。尽管其治疗效果已取得明显改善,但仍有50%的患者预后不良,死于肿瘤复发和远处转移[2]。近年来,CRC术后复发、转移风险的预测已成为临床研究热点之一。趋化因子是细胞因子超家族成员中一类具有化学趋化作用的小分子蛋白多肽,现已有超过50种趋化因子得到确认。研究[3]发现一些趋化因子和趋化因子受体在CRC组织微环境中表达显著上调,包括具有单核巨噬细胞和T细胞趋化作用的CCL4、CCL5及其受体 CCR1、CCR5,血管生成趋化因子 CXCL1、CXCL8及其受体CXCR2,以及抗血管生成趋化因子CXCL9和CXCL10,其中抗血管生成趋化因子 CXCL9与CRC预后的关系尚不明确。本研究通过随访监测CRC患者的术后血清CXCL9水平,探讨其变化与肿瘤术后复发、转移的关系。
材料与方法
一、一般资料
收集2011年7月-2012年12月在复旦大学附属上海市第五人民医院接受手术治疗的CRC患者60例,其中男39例,女21例,年龄45~80岁,平均(58.5±7.3)岁,所有患者均经术前活组织检查确诊,临床资料完整,术前未接受过任何抗肿瘤治疗。60例CRC中结肠癌44例,直肠癌16例;肿瘤直径<5 cm 32例,≥5 cm 28例;Dukes分期A期19例,B期12例,C期14例,D期15例;行右半结肠切除术19例,左半结肠切除术14例,乙状结肠切除术7例,横结肠切除术4例,直肠癌根治术16例。将患者按Dukes分期分为A期、B期、C期、D期四组,同时收集50名健康志愿者作为对照组。
二、标本采集和处理
受检者于清晨6时空腹抽取静脉血5 mL,肝素抗凝,4℃冰箱静置1 h,3 000×g离心15 min,取上清液,-20℃冻存待测,整个过程注意无菌操作。采用双抗体夹心ELISA法检测血清CXCL9水平,操作严格按试剂盒(R&D Systems,Inc.)说明书进行。CRC患者于术前和术后6个月、12个月各检测一次血清CXCL9水平。
三、随访
对入组CRC患者进行随访,随访起始时间为手术时间,终点定义为发现复发、转移证据或因病死亡的日期。复发、转移需经病理、B超、CT或X线检查证实。截至研究资料总结,随访期为2~3年。
四、统计学分析
结 果
一、各组血清CXCL9水平
术前各Dukes分期CRC组血清CXCL9水平均显著高于对照组(P<0.05),且 CXCL9水平在Dukes A、B、C、D期组中呈逐渐升高趋势,各组间差异均有统计学意义(P<0.05)。术后6个月和12个月,各Dukes分期CRC组血清CXCL9水平均较术前显著降低(P<0.05);术后12个月时,Dukes C、D期组血清CXCL9水平虽较术后6个月时有所回升,但组间差异无统计学意义(P>0.05)(表1)。
二、血清CXCL9水平与CRC术后复发、转移的关系
60例CRC患者术后随访2~3年,中位随访期27.6个月,共25例(41.7%)患者出现肿瘤复发、转移。术后一年内复发、转移的患者取靠近确诊复发、转移时间的术后检测时点测得的血清CXCL9水平,术后一年后复发、转移和未复发、转移的患者取术后12个月时测得的CXCL9水平,将患者根据CXCL9水平由低至高排序,按每组20例依次分为三组:CXCL9 10.31 ~ 15.24 ng/L 组、15.25 ~ 24.18 ng/L 组和24.19~35.92 ng/L组,分别分析各组复发转移率,结果显示三组术后复发转移率依次为15.0%(3/20)、35.0%(7/20)和 75.0%(15/20),复发转移率随CXCL9水平的升高呈上升趋势(P<0.05)。
三、CRC术后复发、转移危险因素分析
以是否复发/转移为因变量,以性别、年龄、肿瘤部位、Dukes分期、血清CXCL9水平为自变量行Logistic回归分析,结果显示 Dukes分期(C期、D期)和血清CXCL9水平(≥15.25 ng/L)是CRC术后复发、转移的独立危险因素(P<0.05)(表2)。
讨 论
CRC术后复发、转移是导致患者预后不良和死亡的主要原因,50% ~60%的CRC患者可发生远处转移,5年生存率不足10%[4]。掌握CRC发生、发展和转移的规律,准确评估疾病严重程度,将有助于手术方式的选择和术中淋巴结清扫范围的确定,对明确术后分期以及制订辅助治疗方案亦有指导意义。肿瘤转移的发生机制迄今尚未完全阐明,近年研究发现趋化因子在肿瘤浸润、转移过程中发挥重要作用,对结肠癌[3]、前列腺癌[5]、乳腺癌[6]、肾癌[7]、肺癌[8]等肿瘤的研究均表明肿瘤细胞迁移和肿瘤远处转移与趋化因子及其受体表达密切相关。
表1 各Dukes分期CRC组与对照组血清CXCL9水平比较(,ng/L)
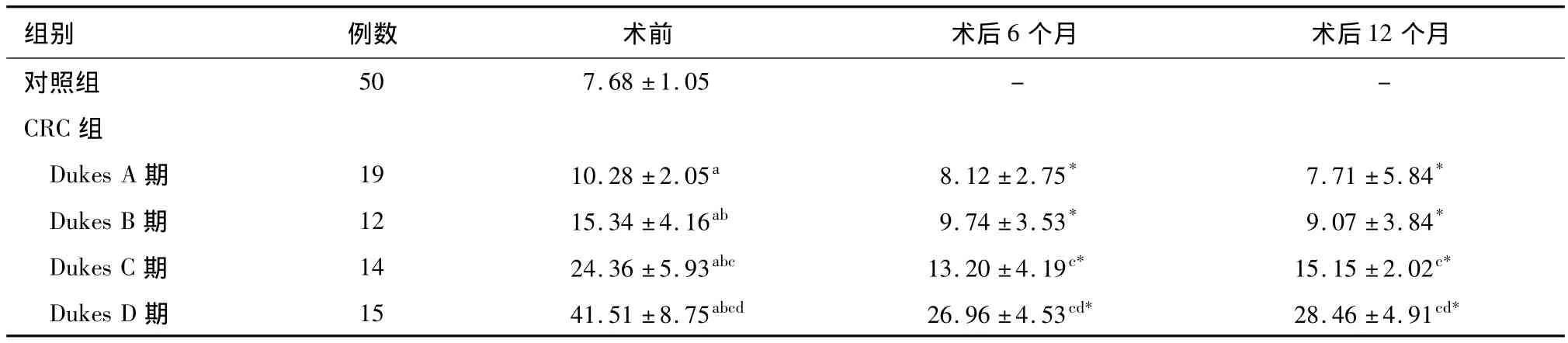
表1 各Dukes分期CRC组与对照组血清CXCL9水平比较(,ng/L)
a与对照组比较,P<0.05;b与 Dukes A期比较,P<0.05;c与 Dukes B期比较,P<0.05;d与 Dukes C期比较,P<0.05;*与同组术前比较,P <0.05
组别 例数 术前 术后6个月 术后12个月对照组50 7.68 ±1.05 - -CRC组Dukes A 期 19 10.28 ±2.05a 8.12 ±2.75* 7.71 ±5.84*Dukes B 期 12 15.34 ±4.16ab 9.74 ±3.53* 9.07 ±3.84*Dukes C 期 14 24.36 ±5.93abc 13.20 ±4.19c* 15.15 ±2.02c*Dukes D 期 15 41.51 ±8.75abcd 26.96 ±4.53cd* 28.46 ±4.91cd*

表2 CRC术后复发、转移危险因素分析(Logistic回归模型)
归巢理论认为,肿瘤细胞表达特定的趋化因子受体,而其转移好发部位高表达相应的趋化因子配体,后者对肿瘤细胞的化学趋向性使肿瘤细胞“归巢”进入特定部位。目前,已有较多针对炎性趋化因子(如 CCL2、CCL3、CCL4、CCL5)、血管生成趋化因子(如CXCL1、CXCL5、CXCL8)等在 CRC 中表达的研究,但关于抗血管生成趋化因子CXCL9在CRC患者中的表达情况与肿瘤预后间关系的报道较少。本研究发现CRC患者术前血清CXCL9水平显著高于对照组,并随Dukes分期的进展呈升高趋势,表明CXCL9对CRC的发生、发展有一定促进作用。本研究还发现,术后6个月和12个月,各 Dukes分期CRC组血清CXCL9水平均较术前显著降低,但仍高于正常对照组,张忠国等[9]对进展期CRC患者术后血清CXCL8的随访研究亦得出类似结果,其可能原因为部分CRC患者术后仍存在残余肿瘤负荷,残余的肿瘤细胞持续促进CXCL9分泌,导致术后血清CXCL9仍处于相对高水平状态[10]。随着术后时间的推移,Dukes C、D期患者血清CXCL9水平有所回升,但未达统计学意义,与进展期CRC患者术后复发、转移风险更高相一致。
本研究随访结果显示,60例CRC患者的术后复发转移率为41.7%,进一步按确诊复发/转移时的血清CXCL9水平高低行分组分析,发现复发转移率随CXCL9水平的升高呈上升趋势,据此推测血清CXCL9可作为CRC预后的有效预测指标。Logistic回归分析结果证实,在控制性别、年龄、Dukes分期等因素的影响后,血清CXCL9水平(≥15.25 ng/L)是CRC术后复发、转移的独立危险因素。CXCL9高表达促进CRC术后复发、转移的确切分子机制有待进一步研究。
综上所述,CRC患者术后血清CXCL9仍处于相对高水平状态,并与肿瘤术后复发、转移密切相关。血清CXCL9水平监测可能有助于指导CRC的临床治疗和预后评价,并为进一步探索CXCL9在CRC定向转移中的作用机制提供新的思路。
1 Jemal A,Siegel R,Xu J,et al.Cancer statistics,2010[J].CA Cancer J Clin,2010,60(5):277-300.
2 Vizin T,Christensen IJ,Nielsen HJ,et al.Cathepsin X in serum from patients with colorectal cancer:relation to prognosis[J].Radiol Oncol,2012,46(3):207-212.
3 Erreni M,Bianchi P,Laghi L,et al.Expression of chemokines and chemokine receptors in human colon cancer[J].Methods Enzymol,2009,460:105-121.
4 Van Cutsem E,Oliveira J;ESMO Guidelines Working Group.Primary colon cancer:ESMO clinical recommendations for diagnosis,adjuvant treatment and follow-up[J].Ann Oncol,2009,20 Suppl 4:49-50.
5 Zhang J,Patel L,Pienta KJ.CC chemokine ligand 2(CCL2)promotesprostatecancertumorigenesisand metastasis[J].Cytokine Growth Factor Rev,2010,21(1):41-48.
6 Müller A,Homey B,Soto H,et al.Involvement of chemokine receptors in breast cancer metastasis[J].Nature,2001,410(6824):50-56.
7 Zhao FL,Guo W.Expression of stromal derived factor-1(SDF-1)and chemokine receptor(CXCR4)in bone metastasis of renal carcinoma[J].Mol Biol Rep,2011,38(2):1039-1045.
8 Otsuka S,Bebb G.The CXCR4/SDF-1 chemokine receptor axis:a new target therapeutic for non-small cell lung cancer[J].J Thorac Oncol,2008,3(12):1379-1383.
9 张忠国,李文欣,吴叶枫.血清CXCL8在进展期结直肠癌患者中的表达水平及其临床病理意义[J].世界华人消化杂志,2011,19(7):700-704.
10 Ohtani H,Jin Z,Takegawa S,et al.Abundant expression of CXCL9 MIG by stromal cells that include dendritic cells and accumulation of CXCR3+T cells in lymphocyte-rich gastric carcinoma[J].J Pathol,2009,217(1):21-31.
