Apelin-13促进脐带华通胶间充质干细胞分化成血管网
2015-08-24高彦琳陈厚良张宁坤高连如朱智明
高彦琳,陈厚良,张宁坤,高连如,朱智明△
Apelin-13促进脐带华通胶间充质干细胞分化成血管网
高彦琳1,陈厚良2,张宁坤2,高连如2,朱智明1△
目的 探索apelin-13对干细胞定向血管网分化的调控作用。方法 采用组织块贴壁法从人脐带华通胶组织中分离间充质干细胞,流式细胞仪检测其免疫表型。取第3代人华通胶间充质干细胞,分别接种于4个培养瓶中,记为A1、A2、A3、A4组,用诱导液诱导7 d,每天向4组中分别加入浓度0、1×10-6、10×10-6、100×10-6mol/L的apelin-13 20 μL,倒置显微镜下观察细胞形态及生长情况,并对其进行血管性血友病因子(vWF)抗体免疫荧光染色及CD31流式细胞学鉴定。使用水凝胶的三维培养基对诱导后的内皮细胞进行培养,并按照原A1、A2、A3、A4组的顺序重新依次编号为S1、S2、S3、S4组。每天分别向S1、S2、S3、S4组中加入浓度0、1×10-6、10×10-6、100×10-6mol/L 的apelin-13 20 μL。7 d后倒置显微镜下观察细胞的形态、生长情况及在三维培养基中形成血管样结构情况。结果 人华通胶间充质干细胞可以诱导分化为vWF免疫荧光染色阳性的内皮样细胞。随着apelin-13蛋白浓度的增加,CD31阳性表达率也随之升高。显微镜下观察到内皮样细胞在水凝胶的三维培养基中能够形成血管样结构。结论 证实apelin-13参与并调控人脐带华通胶间充质干细胞分化形成血管网。
间充质干细胞;apelin-13;血管生成;三维培养,脐带
近50年来临床心血管医学积累了很多经验,但仍不能从根本上解决血管再生问题[1]。目前用于再生医学的种子细胞主要包括胚胎干细胞和成体干细胞。胚胎干细胞是一种全能干细胞,但是在获取胚胎干细胞的过程中需要破坏囊胚,存在伦理学争议,并且将其移植入个体后会引起免疫排斥并导致畸胎瘤,限制了其临床应用[2]。随后研究发现间充质干细胞不存在以上问题,并且自我更新能力强,具有多向分化潜能[3]。目前已从骨髓、脂肪、羊膜、胎盘、脐血以及脐带等组织中分离出间充质干细胞,其中脐带来源广泛,取材方便,易于收集、保存、冷冻,不受伦理、道德及法律方面的限制[4]。因此,脐带华通胶间充质干细胞(WJ-MSCs)可作为理想的种子细胞。
Apelin是1998年立元等从牛胃中分离提取的活性多肽,主要由12、13、17和36多种分子活性形式组成[5],其中apelin-13主要作用于心血管系统,参与调节血压、体液平衡、血管形成等方面。在体外,apelin-13虽然不能促进人脐静脉内皮细胞有丝分裂,但是对其有趋化作用,异位apelin-13表达可以引发新生血管的产生。然而,apelin-13是否可调控干细胞向血管分化至今尚少见报道。本实验在体外,通过外源添加apelin-13蛋白研究其是否可调控诱导干细胞向血管内皮细胞定向分化。
1 材料与方法
1.1 主要试剂及仪器 DMEM/F12培养液、胎牛血清(FBS)、0.25%胰蛋白酶购自美国Gibco公司;apelin-13购自美国Santa Cruz公司;血管性血友病因子(vWF)抗体购自美国Sigma公司;EBM-2购自美国Lonza公司;流式单抗CD31-PE、CD45-FITC、CD309-PE、CD34-FITC、CD90-PE、CD105-PE、HLA-ABC-PE、HLA-DR-FITC购自美国Biolegend公司;倒置相差显微镜购自日本NIKON公司;流式细胞仪购自美国BD公司;紫外分光光度仪、CO2培养箱(Thermo)。
1.2 方法
1.2.1 人脐带间充质干细胞(hUC-MSCs)的分离及培养 在经医院伦理委员会批准,且征得产妇和家属书面知情同意的情况下,在海军总医院妇产科产房取当日剖宫产健康足月生产的新生儿脐带(乙型肝炎病毒、丙肝病毒感染、人类免疫缺陷病毒、巨细胞病毒梅毒、艾滋病等传染性疾病检测阴性)。将无菌条件下获取的脐带放入无菌生理盐水中,1 h内送至细胞培养实验室。用生理盐水反复冲洗,洗去脐带残留血液。将脐带剪成3~4 cm的小段,每段均沿脐静脉腔剪开,平铺后剔除静脉,再剔除2根动脉,取出血管之间、血管与外膜之间的胶状物——华通胶,用小剪刀将取出的华通胶反复剪切成≤1 mm3小块,接种于T75培养瓶内,每个培养瓶内加入10 mL含有10%FBS的DMEM/F12培养液,使脐带华通胶均匀分布瓶底,置于37℃、5%CO2的培养箱内培养。在显微镜下观察细胞生长增殖情况并拍照。待细胞生长至80%~90%融合状态时,用0.25%胰蛋白酶消化传代细胞,记为第1代细胞(P1)。
1.2.2 hUC-MSCs表面标志物检测 取第3代对数生长期的hUC-MSCs,0.25%胰蛋白酶消化,PBS洗2次,将细胞浓度调整为1×106/mL单细胞悬液,每个EP管加100 μL细胞悬液,每种抗体设置1个复管。分别加入鼠抗人单克隆抗体PE-CD90、PE-CD105、PE-CD31、PE-CD309、PE-HLA-ABC、FITC-CD45、FITC-CD34、FITC-HLA-DR各20 μL,充分混匀,避光室温孵育30 min,PBS洗2遍(250×g离心5 min),重新制成细胞悬液0.5 mL,经300目细胞筛过滤,流式细胞仪上机检测并分析。
1.2.3 hUC-MSCs定向内皮细胞诱导 取第3代对数生长期的hUC-MSCs,用含10%胎牛血清的DMEM/F12培养基调整细胞密度为1×105/mL,分别接种于4个T25的培养瓶中,记为A1、A2、A3、A4组,置于37℃、5%CO2培养箱中培养24 h。显微镜下观察细胞贴壁后,去除原培养基,换成条件培养基[EGM-2+50 μg/L血管内皮生长因子(VEGF)+10 μg/L成纤维细胞生长因子(bFGF)+体积分数2%FBS],37℃、5%CO2、饱和湿度条件下静置培养,每2 d换液1次。每天向A1、A2、A3、A4组分别加入浓度为0、1×10-6、10×10-6和100×10-6mol/L apelin-13 20 μL。分别于诱导后1、3、5、7 d在倒置显微镜下观察细胞形态及生长情况。另设阴性对照组和阳性对照组。阴性对照组为第3代hUC-MSCs,阳性对照组细胞为脐静脉血管内皮细胞。
1.2.4 免疫荧光染色 将阴性对照组和诱导(A1、A2、A3、A4)组细胞PBS洗3次后,4%多聚甲醛固定30 min,PBS洗涤 3次×10 min,0.3%曲拉通X-100(TritonX-100)破膜10 min,PBS漂洗3次×10 min,5%BSA处理1 h,加入1∶200绵羊抗人vWF单克隆抗体,4℃孵育过夜,然后用PBS洗3次× 10 min,加入1∶400的抗绵羊荧光抗体,4℃避光孵育2 h,共聚焦显微镜下观察、摄片。
1.2.5 流式细胞鉴定 将阴性对照组和诱导(A1、A2、A3、A4)组(诱导7 d)细胞,用0.25%胰蛋白酶消化,加入鼠抗人单克隆抗体PE-CD31 20 μL,充分混匀,避光室温孵育30 min,PBS洗2遍,重新制成细胞悬液0.5 mL,经300目细胞筛过滤,流式细胞仪上机检测并分析。
1.2.6 诱导后内皮样细胞的三维培养 取定向诱导后的内皮细胞,0.25%胰蛋白酶消化,弃上清,5 mL蔗糖溶液重悬,调整细胞浓度为2×106/mL。将细胞悬液与水凝胶1∶1混合均匀。取250 μL细胞-水凝胶混合液加入三维细胞培养皿中,设S1、S2、S3、S4组。将细胞培养液(DMEM-F12高糖+体积分数10%FBS)沿三维细胞培养皿边缘轻轻注入,覆盖凝胶上缘即可。置于37℃、5%CO2、饱和湿度培养箱中孵育,每10 min换液1次,共3个循环,以后每2 d换液1次。每天分别向S1、S2、S3、S4组加入浓度分别为0、1×10-6、10×10-6和100×10-6mol/L apelin-13 20 μL。分别于诱导后1、3、5、7 d在倒置显微镜下观察细胞形态及生长情况。
1.3 统计学方法 采用SPSS 13.0软件进行统计学处理,计量资料以±s表示,多组间比较采用单因素方差分析,诱导组与阴性对照组间比较行Dunnett-t检验。以Spearman秩相关分析apelin-13的剂量与CD31表达阳性率的关系,P<0.05为差异有统计学意义。
2 结果
2.1 显微镜观察hUC-MSCs形态和生长情况 采用组织块贴壁法培养7~8 d后,可见部分细胞从组织块周围爬出,呈现多种形态,10 d后细胞开始迅速增殖,14~15 d左右可铺满培养瓶的90%,形成大小不等的细胞集落,见图1A。传代后的细胞呈长梭形或分支状生长,在接种后第4天即大量汇合且呈漩涡状生长,细胞在增殖传代过程中形态无明显改变,见图1B。
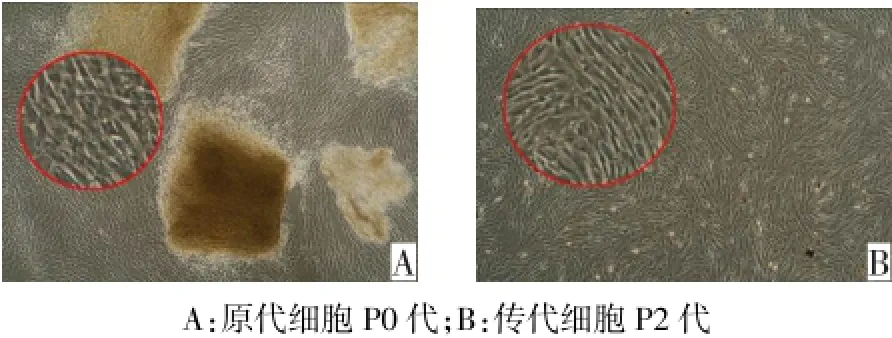
Fig.1 Human umbilical cord-MSCs observed under inverted microscope(×40)图1 倒置显微镜下观察hUC-MSCs(×40)
2.2 hUC-MSCs表面标志物表达 流式细胞检测结果显示,P3代hUC-MSCs高表达CD90、CD105、HLA-ABC,而不表达CD45、CD34、CD31、CD309、HLA-DR,见图2。
2.3 hUC-MSCs定向内皮细胞诱导7 d后细胞形态学变化 倒置显微镜下观察,A1、A2、A3、A4组细胞诱导7 d后细胞密集处呈内皮细胞特有的“铺路石”样排列。阴性对照组细胞呈长梭形或分支状,阳性对照组细胞呈典型的“铺路石”样外观,见图3。
2.4 免疫荧光染色 诱导(A1、A2、A3、A4)组经vWF免疫荧光检测呈阳性,见图4。证明这类细胞具有内皮细胞性质。阴性对照组染色呈阴性。
2.5 诱导分化后细胞的表面标志物鉴定 流式细胞仪结果显示,诱导组A1、A2、A3、A4和阴性对照组CD31阳性表达率(%)分别为77.8±1.4、79.4±1.2、80.7±1.2、90.4±1.1和1.8±0.2。A1、A2、A3、A4组CD31的表达强度均明显高于阴性对照组(F= 23 040.243,n=15,P<0.01)。表明hUC-MSCs在适宜的条件下,诱导分化出的“铺路石”样扁平细胞即为血管内皮细胞,且apelin-13浓度与CD31阳性表达率呈正相关(rs=0.972,P<0.01),见图5。
2.6 水凝胶中细胞的形态及生长存活 倒置相差显微镜下可见阴性对照组细胞在水凝胶中均匀分布,呈圆形悬浮生长。阳性对照组和诱导组细胞可见细胞聚集,伸出伪足,形成血管分支样结构,见图6。诱导组分支样结构相互交织,形成血管网状结构,见图7。
3 讨论
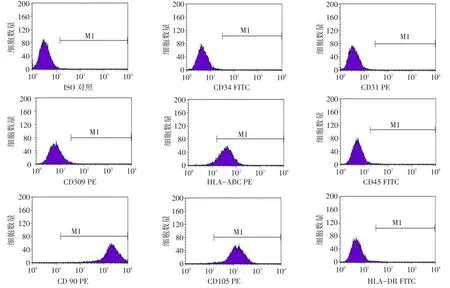
Fig.2 Human umbilical cord-MSCs surface markers detected by flow cytometry图2 hUC-MSCs表面标志物的流式细胞仪检测结果
心血管疾病的发病率逐年上升,已成为导致人类死亡的首要原因[6]。目前,药物、介入、外科搭桥手术均无法使坏死的心肌及血管再生。因此,实现血管再生已成为21世纪细胞生物学和心血管临床医学的重大目标。Apelin-13可能是调控血管再生的关键信号因子。近年来,研究人员在鸡胚、斑马鱼、非洲蟾蜍、小鼠等模式动物中发现,apelin-13蛋白在血管再生过程中发挥重要作用[7-8]。有研究指出apelin-13是胚胎血管生成和肿瘤血管生成中必不可少的因素[9]。非洲爪蟾基因敲除实验也进一步证实了apelin相关信号是体节间血管新生的重要信号通路。
间充质干细胞是血管发育必不可少的生长因子,可有效地产生VEGF,促进血管生成,稳定内皮网络,产生支持细胞[10]。脐带来源的间充质干细胞来源丰富、增殖分化能力强、安全无毒,适合体外大规模培养,已成为干细胞研究领域倍受瞩目的新型种子细胞。因此本实验选择脐带来源的间充质干细胞为种子细胞,利用VEGF联合bFGF诱导方案作为血管诱导分化的平台,将水凝胶作为载体,通过外源性添加apelin-13蛋白,构建三维血管网。基于本课题组前期工作中已发现成体干细胞向血管分化过程中有apelin-13表达[11],在此基础上通过对apelin-13蛋白的干预,成功揭示了体外血管再生的可能。
本实验采用水凝胶作为三维细胞培养材料,构建三维血管再生系统模型。水凝胶可以在液态时包裹细胞,固态时形成交联网络,使大量细胞分散黏附于其中,通过物理或化学交联(共价键)来维持它的三维结构,形成真正的类细胞外基质模型[12]。本研究采用耦合过程开发了一个三维多尺度模型,包括支架形成过程、外源性生长因子的释放和血管生成,随着时间的推移和养分运输,支架的孔隙率扮演更重要的角色,促进血管形成和血管生成。
目前对于apelin-13促进血管再生的机制尚不明确。相关研究指出,apelin-13和VEGF的mRNA和蛋白表达水平在新生血管中均明显增加[13]。本研究结果显示,hUC-MSCs在经过VEGF诱导后,表达血管内皮细胞特异性标志物vWF,且apelin-13浓度与内皮分化标记和上调的标志性因子CD31阳性表达率呈正相关,提示apelin-13和VEGF具有协同作用,共同促进血管再生。另外,有研究提出了微环境的诱导学说:在微环境中存在一些细胞外基质,它们不仅会影响干细胞的分化过程,同时还会影响分化信号的相关反应,它们的多种分泌物包括基因产物都会参与并调控干细胞的分化[14]。本实验在以水凝胶为基础的三维微环境中,诱导后的内皮细胞成功分化为血管网,且随着apelin-13浓度的升高,血管网结构更加明显,提示在三维微环境中,apelin-13蛋白可能加速了诱导分化的过程,但是其具体调节机制还需进一步研究。
(图3~7见插页)
[1]Yuan W,Liu W,Li J,et al.Effects of BMSCs interactions with adventitial fibroblasts in transdifferentiationand ultrastructure processes[J].Int J Clin Exp Pathol,2014,7(7):3957-3965.
[2]Lin YC,Ko TL,Shih YH,et al.Human umbilical mesenchymal stem cells promote recovery after ischemic stroke[J].Stroke,2011,42 (7):2045-2053.
[3]Mok PL,Leong CF,Cheong SK.Cellular mechanisms of emerging applications of mesenchymal stem cells[J].Malays J Pathol,2013,35(1): 17-32.
[4]Wang L,Xu XX,Zhang NK,et al.Transfection of lentivirus recombined with marker gene into human umbilical cord Wharton’s jellyderived mesenchymal stem cells[J].Tianjin Med J,2013,41(10):985-988.[王力,徐小红,张宁坤,等.携带标记基因的慢病毒载体转染人脐带华通胶间充质干细胞的实验研究[J].天津医药,2013,41(10):985-988].doi:10.3969/j.issn.0253-9896.2013.10.012.
[5]Antushevich H,Krawczynska A,Kapica M,et al.Effect of apelin on mitosis,apoptosis and DNA repair enzyme OGG 1/2 expression in intestinal cell lines IEC-6 and Caco-2[J].Folia Histochem Cytobiol,2014,52(1):51-59.
[6]Lloyd-Jones D,Adams RJ,Brown TM,et al.Executive summary: heart disease and stroke statistics--2010 update:a report from the American Heart Association[J].Circulation,2010,121(7):948-954.
[7]Xu XX,Wang L,Zhang NK,et al.Influence of apelin-13 on 5-azacytidine inducing differentiation of umbilical cord mesenchymal stem cells to cardiomyocytes[J].Med J Chin PLA,2013,38(10):796-800.[徐小红,王力,张宁坤,等.Apelin-13对5-Aza诱导脐带间充质干细胞向心肌细胞分化的影响[J].解放军医学杂志,2013,38(10):796-800].doi:10.11855/j.issn.0577-7402.2013.10.003.
[8]Cho J,Zhai P,Maejima Y,et al.Myocardial injection with GSK-3β-overexpressing bone marrow-derived mesenchymal stem cells attenuates cardiac dysfunction after myocardial infarction[J].Circ Res,2011,108(4):478-489.
[9]Ieda M,Fu JD,Delgado-Olguin P,et al.Direct reprogramming of fibroblasts into functional cardiomyocytes by defined factors[J].Cell,2010,142(3):375-386.
[10]Simonavicius N,Ashenden M,van Weverwijk A,et al.Pericytes promote selective vessel regression to regulate vascular patterning[J].Blood,2012,120(7):1516-1527.
[11]Gao LR,Zhang NK,Bai J,et al.The apelin-APJ pathway exists in cardiomyogenic cells derived from mesenchymal stem cells in vitro and in vivo[J].Cell Transplant,2010,19(8):949-958.
[12]Roura S,Farré J,Hove-Madsen L,et al.Exposure to cardiomyogenic stimuli fails to transdifferentiate human umbilical cord blood-derived mesenchymal stem cells[J].Basic Res Cardiol,2010,105(3): 419-430.
[13]Lu Q,Feng J,Jiang YR.The role of apelin in the retina of diabetic rats[J].PLoS One,2013,8(7):e69703.
[14]Doan CC,Le TL,Hoang NS,et al.Differentiation of umbilical cord lining membrane-derived mesenchymal stem cells into endotheliallike cells[J].Iran Biomed J,2014,18(2):67-75.
(2015-02-13收稿 2015-04-13修回)
(本文编辑 陈丽洁)
Apelin-13 promote mesenchymal stem cells isolated from Wharton’s jelly to differentiate into vascular networks
GAO Yanlin1,CHEN Houliang2,ZHANG Ningkun2,GAO Lianru2,ZHU Zhiming1△
1 Clinical College of Navy Medicine,Anhui Medical University,Anhui 230000,China;2 Department of Cardiology,Navy General Hospital
△Corresponding Author E-mail:zhuzhiming6542@sina.com
Objective To explore the role of apelin-13 in regulating stem cell differentiation into vascular net.Methods Mesenchymal stem cells were isolated from human umbilical Wharton’s jelly using tissue adherence method.Their immunophenotypes were detected by flow cytometry.Passage 3 of WJ-MSCs(Wharton’s jelly-mesenchymal stem cells)were inoculated in 4 flasks,denoted as A1,A2,A3,A4 group.Twenty μL of apelin-13 at concentrations of 0,1×10-6,10× 10-6and 100×10-6mol/L were added to A1,A2,A3 and A4 respectively each day.After being induced for 7 days,cell morphology and viability were observed under inverted microscope.Von Willebrand factor(vWF)was examined by immunofluorescence and CD31 was identified by flow cytometry.Upon incubating with three dimensional culture medium of hydrogel,those cultured A1,A2,A3 and A4 were renumbered as S1,S2,S3,S4.Again,twenty μL of apelin-13 at concentrations of 0,1×10-6,10×10-6and 100×10-6mol/L were used to treat S1,S2,S3 and S4 respectively.After 7 days,cell morphology,viability and vas-like networks were observed with inverted microscope.Results Our study showed that WJ-MSCs can be induced by apelin 13 to differentiate into endothelial cells lineage indicated by positive of vWF staining.Moreover,CD31 expression increases significantly upon apelin-13 addition in a dosage dependent manner.The endothelial cells line formed vas like networks when cultured with three-dimensional medium containing hydrogel.Conclusion This study demonstrated that apelin-13 could promote human umbilical cord-MSCs to differentiate into endothelium lineage then to form vascular networks.
mesenchymal stem cells;apelin-13;angiogenesis;3-dimensional culture,umbilical cord
R329.2
A DOI:10.11958/j.issn.0253-9896.2015.06.005
国家自然科学基金资助项目(81170094)
1安徽医科大学海军临床学院(邮编230000);2海军总医院心脏中心
高彦琳(1989),女,硕士在读,主要从事干细胞治疗缺血性心肌病方面的研究
△E-mail:zhuzhiming6542@sina.com
