rhBMP-2对大鼠成骨细胞PKA的作用研究
2015-08-22孙海燕李齐宏于开涛刘宝林杨连甲
葛 成, 孙海燕, 李齐宏, 于开涛, 舒 瑶, 刘宝林, 杨连甲
实验研究
rhBMP-2对大鼠成骨细胞PKA的作用研究
葛 成, 孙海燕, 李齐宏, 于开涛, 舒 瑶, 刘宝林, 杨连甲
目的 探讨rhBMP-2对大鼠成骨细胞PKA的影响。方法 首先,分别以rhBMP-2(200 μg/L)、PKI-rhBMP-2(1 mg/L的PKI预刺激30 min后加rhBMP-2)干预大鼠成骨细胞0、10、30、60 min,检测PKA的活性;然后,检测在200 μg/L的rhBMP-2分别作用10、20、30 min后,大鼠成骨细胞的cAMP浓度;再通过RT-PCR方法,检测rhBMP-2分别作用0(con)、30、60 min后,细胞内PKAα及PKAβ mRNA。结果 rhBMP-2干预成骨细胞30、60 min后,PKA活性升高(P<0.05),PKI预刺激30min后,细胞PKA活性显著降低(P<0.01),rhBMP-2使已经降低的PKA活性逐渐升高,尤其是在加入rhBMP-2 60min后(P<0.01)。rhBMP-2干预成骨细胞10、20、30min后,细胞内的cAMP浓度无明显变化(P>0.05)。rhBMP-2对成骨细胞PKAα及PKAβmRNA的影响很小,在60min之内,无显著变化(P>0.05)。 结论rhBMP-2可以直接或者通过cAMP以外的某个途径,促进体外培养的大鼠成骨细胞内PKA的活性,对PKA的合成代谢在短期内(60min内)无明显影响。
骨形态发生蛋白; 蛋白激酶A; 成骨细胞; 信号通路
骨组织形成是一个受很多局部因子精细调控的渐进发展过程,在这些局部因子中,骨形态发生蛋白(bone morphogenetic protein, BMP)是对成骨细胞调节最有效的因子之一。BMP属于外分泌型信号分子,是TGF-beta超家族成员,有很强的促成骨能力[1]。有学者观察到BMP引起的细胞功能表现与广泛存在于动物细胞内的环磷酸腺苷依赖的蛋白激酶(cAMP-dependent protein kinase, PKA)信号途径有一定的关联,PKA的活化是骨形成和BMP诱导的成骨细胞分化不可缺少的一环[2-4]。Nakao等[5]发现,cAMP-PKA信号通路的活化,对BMP诱导成骨活性有明显的增强作用。葛成等[6-7]实验发现,重组人骨形态发生蛋白2(recombinant human bone morphogenetic protein-2, rhBMP-2)能促进成骨细胞表达更多活化状态的PKA。这些结果提示,BMP信号途径与PKA信号途径之间,存在一定的关联作用。本实验拟观察rhBMP-2对大鼠成骨细胞内PKA的活性是否有直接的影响, rhBMP-2是通过使成骨细胞内产生大量的PKA特异性激活物cAMP来完成对PKA的活化,还是促进成骨细胞内PKA酶本身的转录和翻译。自2013年3月,笔者利用放射免疫测定和反转录聚合酶链式反应方法,对此加以探讨。
1 材料与方法
1.1 主要材料
选择7 d SD仔鼠(第四军医大学实验动物中心提供),DMEM/F12培养基(美国GIBCO公司),胎牛血清(浙江金华犊牛利用研究所),rhBMP-2(第四军医大学生化教研室),亮抑酶肽、抑肽酶、胰蛋白酶、β-甘油磷酸钠、L-抗坏血酸、地塞米松(美国SIGMA公司),PKA Assay System(美国PROMEGA公司),考马斯亮蓝G-250(华美生物工程公司)。
1.2 细胞培养
无菌条件下,取7 d SD仔鼠四肢长骨,剔净软组织,剪成1 mm骨块,反复冲洗,用含10%FBS的诱导培养液组织块法培养成骨细胞。约80%汇合后,用差速贴壁法纯化并传代。
1.3 rhBMP-2和PKI干预实验
当传代的细胞在10 cm培养皿中约60%汇合时,用含2%FBS(无Dex)的培养液驯化24 h后,分组以rhBMP-2(200 μg/L)、PKI-rhBMP-2(1 mg/L的PKI预刺激30 min后加rhBMP-2),分别作用0、10、30、60 min,各时间点3复孔。
1.4 PKA活性检测
按照PKA Assay System试剂盒说明的步骤进行。
1.5 rhBMP-2对成骨细胞cAMP的影响
当传代的细胞在10 cm培养皿中约60%汇合时,用含2%FBS(无Dex)的培养液驯化24 h后,进入cAMP放射免疫检测试验。
经过驯化的成骨细胞,以实验浓度为200 μg/L的rhBMP-2,分别作用10、20、30 min,各时间点5皿,另设对照组5皿。吸弃培养液,每瓶加入冰冷的高氯酸1 ml,用橡皮刮刀刮下细胞,用玻璃匀浆器在冰浴中匀浆,匀浆液离心(3000 r/min,15 min),取上清液,用KOH(0.24 mol/L)调pH 6.3左右,离心(3000 r/min,15 min),取上清液,-20 ℃保存。测定时操作步骤按I125-cAMP放射免疫试剂盒说明书进行,测定放射性强度。灵敏度好于0.01 nmol/L,标准曲线范围为0.078,0.156,0.312,0.625,1.250,2.500,5.000,10.000,20.000 nmol/L。根据标准曲线,采用RIA数据处理软件获得样品中cAMP的含量。
1.6 rhBMP-2对成骨细胞PKA mRNA的影响
当传代的细胞在10 cm培养皿中约60%汇合时,用含2%FBS(无Dex)的培养液驯化24 h后,进入PKA mRNA RT-PCR试验。
1.6.1 引物设计与合成 本实验根据GeneBank上SD大鼠的PKAα及PKAβ mRNA全序列设计引物如下:PKAα上游引物:5′CTACAACAAAGCTGTGGACTG3′(21 bp),下游引物:5′CCTCCTCATAGTCGTCAAAGT3′(21 bp);PKAβ上游引物:5′GAGTAATGCTGGGCTTGAGGA3′(21 bp),下游引物:5′GACCTGGATGTAACCCTGGTG3′(21 bp);β-actin用作PCR的内参照物,根据GeneBank上SD大鼠的β-actin cDNA序列设计引物如下,上游引物:5′AACCCTAAGGCCAACCGTGAAAAG3′(24 bp),下游引物:5′TCATGAGGTAGTCTGTCAGGT′(21 bp)。由上海生工生物工程公司合成。
1.6.2 总RNA提取 经过驯化的成骨细胞,以实验浓度为200 μg/L rhBMP-2分别作用0(con)、30、60 min,各时间点3皿。吸弃培养液,按Trizol一步法提取总RNA,测OD260/OD280值,鉴定RNA纯度。将总RNA置于EP管中-70 ℃冰箱保存。
1.6.3 总RNA反转录反应 按照MBI反转录试剂盒说明进行总RNA的反转录反应。
1.6.4 聚合酶链式反应 按照PCR反应试剂盒说明书,以cDNA为模板,按如下参数进行循环30次的PCR反应:94 ℃预变性5 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸45 s,最后一个循环72 ℃延伸7 min。PCR反应产物经1.5%琼脂糖凝胶电泳检查,电泳结果行光密度扫描定量。
1.7 数据分析
按照计量资料的分析方法,分别对各试验组与对照组进行t检验。用SPSS16.0统计软件进行数据分析。
2 结果
2.1 rhBMP-2对PKA活性的影响
rhBMP-2干预细胞30、60 min,及PKI预刺激30 min后,细胞PKA总活性发生明显变化,rhBMP-2使PKA活性升高,PKI使之降低。在PKI预刺激组,rhBMP-2又可以使已经降低的PKA活性逐渐升高,尤其是在加入rhBMP-2 60 min后。见图1。
2.2 rhBMP-2对cAMP的影响
rhBMP-2对成骨细胞分别作用10、20、30 min后,测得的cAMP浓度与对照组比较,差异无统计学意义(P>0.05)。见图2。
2.3rhBMP-2对PKAmRNA的影响
各样本OD260/OD280值均在1.6~2.0,说明RNA纯度较高。图3,4所示为PKAα、PKAβ和β-actin的mRNA的RT-PCR扩增产物电泳结果,各实验组均在240bp处出现特异性扩增条带,即β-actin条带;图3示各实验组在356bp处出现特异性扩增条带,即PKAα条带;图4示各实验组在442bp处出现特异性扩增条带,即PKAβ条带。光密度扫描定量分析实验结果表明:rhBMP-2对成骨细胞PKAmRNA的影响很小,在60min之内,无统计学意义(P>0.05)。
3 讨论
BMP有很强的促成骨能力,是外分泌型信号分子。而信号转导的重要特征之一在于它是一个网络系统,具有高度的非线性内涵和整合作用的特点。蛋白质的可逆磷酸化反应是细胞信号转导的主要机制之一,这种可逆磷酸化过程主要由大量的蛋白激酶和蛋白磷酸酶催化完成,其中,PKA是广泛存在于动物细胞的一种重要蛋白激酶[8],有两个亚型:α和β。 PKA介导的磷酸化反应常被视为细胞内信号传递途径上的重要一环[9],而对影响PKA活性因素的研究,则是探讨其在细胞内多种功能的重要方法。
Li和He等[2-3]观察到PKA的活化,能够提高BMP-2诱导在成骨细胞分化中有重要作用的Dlx3蛋白和转录因子Osterix的表达,增强其稳定性。Gangopahyay等[10]实验发现,BMP-2促进肺动脉内皮细胞一氧化碳合酶活性的作用依赖于PKA的活化,在使用PKA抑制剂PKI或H89的情况下,BMP-2的作用受到抑制。Han等[11]实验发现,PKA通过磷酸化Dlx5,使其促进成骨的活性更强,而且,BMP-2对Dlx5蛋白水平的提高作用部分依赖于PKA的激活。作者认为,PKA参与了成骨细胞分化及骨形成的几个环节,在BMP诱导的成骨细胞分化成骨过程中,PKA的活化即使不是充分条件,也是必要条件。
我们发现,经cAMP干预后,体外培养的大鼠成骨细胞ALP活性明显升高,而PKI干预的结果正相反,ALP活性下降。说明PKA活性受到影响后,成骨细胞的ALP的活性发生了变化,提示PKA参与了成骨细胞特异性表型的表达。rhBMP-2作用一段时间,可以使已经被PKI降低的ALP活性有一定程度的升高,说明PKA可能与rhBMP-2的作用机制有一定关系[6]。通过免疫细胞化学方法又观察到,在体外培养的大鼠成骨细胞内,存在活化型的PKAα和PKAβ的表达[7],这提示rhBMP-2能够激活PKAα和PKAβ。因此,有必要用更加直接的实验手段来观察PKA活性变化和BMP之间的关系。本实验观察到的现象,更直接地显示出BMP对PKA活性的促进作用。PKI刺激成骨细胞后,PKA活性明显降低(30 min,P<0.01),rhBMP-2不仅使PKA活性升高,而且当作用时间较长时,可以使已经被PKI降低的PKA活性逐渐升高,这说明BMP确实能够影响PKA的活性。Ohta等[12]的实验也观察到了cAMP-PKA信号通路与BMP之间的关联现象。
但BMP究竟以何种方式激活PKA,是直接作用于PKA,还是首先产生大量的PKA特异性的上游因子cAMP呢?因此,我们尝试探讨rhBMP-2激活PKA的机制是否是通过cAMP途径。Tsukamoto等[13]在观察BMP2和BMP4对生长激素释放肽作用于AtT20细胞系的实验中发现,BMP对cAMP的合成无明显影响。然而,有学者观察到,BMP-4和BMP-6能够提高脑垂体瘤细胞系GH3细胞内cAMP水平[14]。
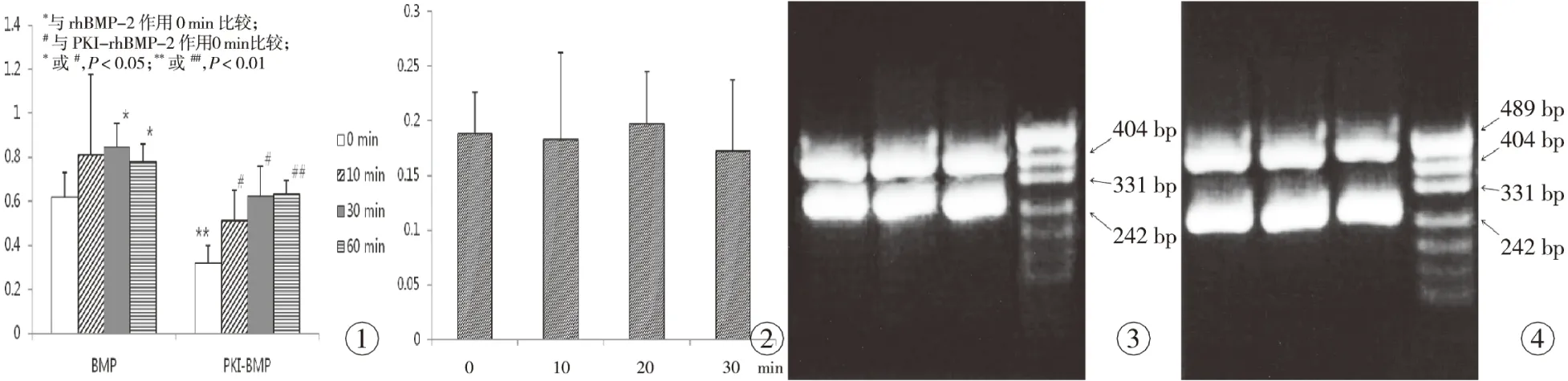
图1rhBMP-2对细胞内PKA活性的影响 图2rhBMP-2对细胞内cAMP的影响 图3PKAα和β-actin电泳 图4PKAβ和β-actin电泳
Fig 1 Effect of rhBMP-2 on PKA activity in SD rat osteoblasts. Fig 2 Effect of rhBMP-2 on cAMP in SD rat osteoblasts. Fig 3 Electrophoresis pattern of PKAα and β-actin. Fig 4 Electrophoresis pattern of PKAβ and β-actin.
本实验发现,rhBMP-2干预细胞30 min之后,成骨细胞PKA活性即发生明显变化(升高)。那么,PKA的活性升高,是在细胞受到干预的30 min内,由于其特异性上游激活剂cAMP数量增加而导致的吗?通过放射免疫测定的方法,我们测定了rhBMP-2对成骨细胞分别作用10、20、30 min后,细胞内cAMP的浓度,结果发现实验组与对照组的cAMP水平无明显差异(P>0.05)。说明rhBMP-2对细胞内的cAMP没有直接影响,即cAMP没有直接参与rhBMP-2激活PKA的过程。这个结果与Tsukamoto等[13]的实验类似,提示在不同的细胞中,BMP对cAMP的影响可能不尽相同。另外,我们又应用RT-PCR方法,观察rhBMP-2是否影响PKA的mRNA水平,初步探讨rhBMP-2是否促进成骨细胞内PKA酶本身的转录。实验结果表明,rhBMP-2对成骨细胞PKAmRNA的影响很小,在60min的作用时间里,PKAmRNA没有显著变化(P>0.05),说明rhBMP-2对PKA的转录层面没有产生迅速而又直接的影响。
由此提示,rhBMP-2可以直接或者通过cAMP以外的某个途径,促进体外培养的大鼠成骨细胞内PKA的活性,对PKA的合成代谢在短期内(60min内)无明显影响。但作用时间延长后,rhBMP-2是否促进cAMP或PKA的合成,尚待进一步研究证实。
[1]ZhangT,WenF,WuY,etal.Cross-talkbetweenTGF-beta/SMADandintegrinsignalingpathwaysinregulatinghypertrophyofmesenchymalstemcellchondrogenesisunderdeferraldynamiccompression[J].Biomaterials, 2015,38:72-85.
[2]LiH,JeongHM,ChoiYH,etal.Proteinkinaseaphosphorylatesdlx3andregulatesthefunctionofdlx3duringosteoblastdifferentiation[J].JCellBiochem, 2014,115(11):2004-2011.
[3]HeS,ChoiYH,ChoiJK,etal.Proteinkinasearegulatestheosteogenicactivityofosterix[J].JCellBiochem, 2014,115(10):1808-1815.
[4]Viale-BouroncleS,KlingelhöfferC,EttlT,etal.AproteinkinaseA(PKA)/β-cateninpathwaysustainstheBMP2/DLX3-inducedosteogenicdifferentiationindentalfolliclecells(DFCs) [J].CellSignal, 2014Dec19.
[5]NakaoY,KoikeT,OhtaY,etal.Parathyroidhormoneenhancesbonemorphogeneticproteinactivitybyincreasingintracellular3′, 5′-cyclicadenosinemonophosphateaccumulationinosteoblasticMC3T3-E1cells[J].Bone, 2009,44(5):872-877.
[6] 葛 成, 杨连甲, 刘宝林. 成骨细胞中蛋白激酶A的作用[J]. 临床口腔医学杂志, 2002,18(4):246-248.
[7] 葛 成, 杨连甲, 刘宝林. 大鼠成骨细胞中蛋白激酶A的表达和信号作用[J]. 临床口腔医学杂志, 2002,18(6):403-405.
[8]SkroblinP,GrossmannS,SchäferG,etal.MechanismsofproteinkinaseAanchoring[J].IntRevCellMolBiol, 2010,283:235-330.
[9]Rababa′hA,SinghS,SuryavanshiSV,etal.CompartmentalizationRoleofA-KinaseAnchoringProteins(AKAPs)inMediatingProteinKinaseA(PKA)SignalingandCardiomyocyteHypertrophy[J].IntJMolSci, 2014,16(1):218-229.
[10]GangopahyayA,OranM,BauerEM,etal.BonemorphogeneticproteinreceptorIIisanovelmediatorofendothelialnitric-oxidesynthaseactivation[J].JBiolChem, 2011,286(38):33134-33140.
[11]HanY,JinYH,YumJ,etal.ProteinkinaseAphosphorylatesandregulatestheosteogenicactivityofDlx5[J].BiochemBiophysResCommun, 2011,407(3):461-465.
[12]OhtaY,NakagawaK,ImaiY,etal.CyclicAMPenhancesSmad-mediatedBMPsignalingthroughPKA-CREBpathway[J].JBoneMinerMetab, 2008,26(5):478-484.
[13]TsukamotoN,OtsukaF,MiyoshiT,etal.Functionalinteractionofbonemorphogeneticproteinandgrowthhormonereleasingpeptideinadrenocorticotropinregulationbycorticotropecells[J].MolCellEndocrinol, 2011,344(1-2):41-50.
[14]TsukamotoN,OtsukaF,MiyoshiT,etal.ActivitiesofbonemorphogeneticproteinsinprolactinregulationbysomatostatinanalogsinratpituitaryGH3cells[J].MolCellEndocrinol, 2011,332(1-2):163-169.
Effect of rhBMP-2 on Protein Kinase A of osteoblasts in SD rat
GECheng,SUNHai-yan,LIQi-hong,etal.
(DepartmentofStomatology, 307HospitalofPLA,Beijing100071,China)
Objective To explore the effect of rhBMP-2 on PKA activity of osteoblasts in SD rat. Methods Firstly, PKA activities were measured after the cells were treated with rhBMP-2 (200 μg/L) and PKI-rhBMP-2 (1 mg/L PKI pretreating for 30 minutes ) for 0, 10, 30 and 60 minutes respectively. Then, the cAMP concentration was detected after the cells were treated with rhBMP-2 for 10, 20, 30 minutes and PKAα and PKAβ mRNA was also measured byRT-PCR after the cells were treated with rhBMP-2 for 0, 30, 60 minutes. Results The PKA activity was increased by rhBMP-2 treating for 30 and 60 minutes (P<0.05).PKAactivitywasdecreasedafterPKIpretreatedfor30minutes(P<0.01),whereasrhBMP-2elevatedthedepressedPKAactivityinatime-dependentmanner(P<0.05).NodifferenceoftheamountofcAMPwasfoundbetweentheexperimentalgroup(treatedwithrhBMP-2for10, 20, 30minutesrespectively)andthecontrolgroup(P>0.05).PKAmRNAwasdetectedthroughRT-PCwithin60minutes,therewasnosignificanteffectofrhBMP-2onratcellsPKAmRNAlevel(P>0.05). Conclusion PKA activity in SD rat osteoblasts can be increased by rhBMP-2 directly or by some pathway except for cAMP signal pathway. And rhBMP-2 does not affect PKA synthesis (mRNA level) in the exposure time less than 60 minutes.
Bone morphogenetic protein; Protein kinase A; Osteoblast; Signal pathway
国家自然科学基金资助项目(30070818);北京市自然科学基金资助项目(7152110)
100071 北京,中国人民解放军第三○七医院 口腔科(葛 成,孙海燕,李齐宏,于开涛,舒 瑶);第四军医大学口腔医 院(刘宝林,杨连甲)
葛 成(1972-),男,山东人,副主任医师,博士.
10.3969/j.issn.1673-7040.2015.04.011
R
A
1673-7040(2015)04-0220-04
2014-12-08)
