使用曲普瑞林降调节长方案的IVF妊娠结局分析
2015-08-10李娜张娜师娟子薛侠孟彬周寒鹰
李娜,张娜,师娟子*,薛侠,孟彬,周寒鹰
(1.陕西省妇幼保健院生殖中心,西安 710003;2.西安交通大学医学院第一医院感染科,西安 710061)
使用促性腺激素释放激素激动剂(GnRH-a)对垂体进行降调节可以预防卵泡成熟前出现内源性黄体生成素(LH)峰,避免卵泡早排,降低周期取消率[1]。短效曲普瑞林是一种非缓释剂型的GnRH-a,早期降调节方案一般采用短效曲普瑞林0.1mg/d至人绒毛膜促性腺激素(HCG)日[2],近年来有学者发现减少GnRH-a药物的使用剂量亦可发挥垂体降调作用[6-8],但GnRH-a减量是否对体外受精-胚胎移植(IVF-ET)妊娠结局产生影响,目前尚无定论。自2012年我中心采用短效曲普瑞林0.05mg/d持续至HCG日,或0.1mg/d×7d后减量至0.05mg/d持续至HCG 日两种不同的垂体降调节方案对行IVF/卵胞浆内单精子注射(ICSI)治疗患者进行降调节。本文比较两种剂量的降调节方案对IVF-ET妊娠结局的影响。
资料与方法
一、研究对象
回顾性分析2012年11月至2013年12月在本生殖中心采用短效曲普瑞林降调节长方案行IVF/ICSI治疗的2 312例患者,共2 521周期。纳入标准:年龄21~38 岁,首次接受IVF 治疗,基础卵泡刺激素(FSH)<10 U/L,基础窦卵泡数(AFC)>6个,获卵数>5枚。排除标准:女方生殖系统畸形、生殖系统感染及男女双方存在染色体异常者。
二、研究方法
1.降调节:所有研究对象均使用短效曲普瑞林降调节长方案。月经规律患者卵泡期B 超监测排卵,排卵后1周空腹抽血检测血清孕酮(P)水平,若P>15.9nmol/L即开始降调节治疗,若P水平不满意则下一周期改用口服避孕药预处理。月经不规律或无排卵的患者自月经周期第5天开始口服避孕药去氧孕烯炔雌醇(妈富隆,欧加农,荷兰)1 片/d,连续服用21d,在服药第17天开始降调节治疗。根据曲普瑞林使用剂量不同分为2组,A 组(1 533个周期):皮下注射醋酸曲普瑞林(达必佳,0.1 mg/支,Ferring,瑞士)0.05mg/d,连续14d。B 组(988个周期):皮下注射醋酸曲普瑞林0.1mg/d,连续7d后减量为0.05mg/d再持续7d。若当日药物剂量为0.05mg,则4 ℃冰箱保存剩余药物,24h 内使用。降调节标准:FSH<5U/L,LH<5U/L,雌二醇(E2)<183pmol/L,子宫内膜厚度<5mm,窦卵泡直径≤5mm。
2.控制性超排卵(COH):达到降调节标准后,开始注射促性腺激素(Gn)150~300U/d进行卵巢刺激。根据患者年龄、AFC、体重指数(BMI)、基础FSH 水平等具体情况,所使用的Gn药物有果纳芬(r-FSH,默克,德国)及普利康(rFSH-β,默克,德国)。若未达到降调节标准,则继续使用曲普瑞林至达标,再使用Gn 启动卵巢刺激,后继续使用GnRH-a至HCG 日。卵巢刺激期间,根据B超监测的卵泡大小及血清FSH、LH、P、E2水平调整Gn用量。当直径>17mm 的卵泡占直径>14mm 卵泡总数的60%以上时,于当晚注射重组人绒毛膜促性腺激素(r-HCG)250μg(艾泽,250μg/支,默克,德国),36h后阴道B超下取卵。
3.IVF-ET:取卵后行常规体外授精,授精16~18h后观察受精情况,以出现双原核(2PN)为受精标志。对于男方严重少弱畸精子症、梗阻性无精子症、顶体功能异常、前次常规授精失败者采用ICSI授精。胚胎培养采用vitrolife-G-5系列序贯培养基(Vitrolif,瑞典)培养。按Peter卵裂期胚胎评分系统[3]评 估 第3 天 胚 胎 质 量,共 分 为4 级:1 级:8~10细胞,大小均匀,没有碎片;2 级:6~7 细胞或>10细胞,大小均匀,没有碎片;3级:4~5细胞,大小均匀,没有碎片;4级:<4细胞。若出现碎片或大小不均则进行降低评分:碎片程度为5%~10%降0.5分,10%~20%降1 分,20%~30%降3 分;大小不均是指卵裂球体积相差20%以上者,出现1个大小不均降1分,2个大小不均降2分,3个大小不均降3分。1~3 级为可用胚胎,1 级和2 级胚胎为优质胚胎。移植可用胚胎1~3 枚。于取卵日当天开始给予黄体酮(浙江仙琚)60 mg/d肌肉注射,移 植 后14 d 检 测 血 清HCG 水 平,HCG>50U/L继续行黄 体 支 持,至ET 后5 周,B 超 检 测见到妊娠囊者为临床妊娠。继续黄体支持至孕10周。所有患者均随访至孕12 周。孕周<12 周即流产者为早期流产。
出现下列情况者取消ET:HCG 日血清P>5.72nmol/L,存在卵巢过度刺激综合征(OHSS)发生风险(获卵数>20枚,和(或)血清E2>36 700pmol/L)、移植日发现宫腔积液、子宫内膜厚度<7mm、移植日患者合并上呼吸道感染或腹泻等其他疾病者。取消移植周期后将所有可用胚胎置于液氮中冷冻保存,备用。
四、统计学方法
采用SPSS 16.0统计软件进行数据分析,计量资料用(±s)表示,组间比较采用t检验,计数资料以率表示,并行χ2检验。P<0.05 为有统计学差异。
结 果
一、一般情况
两组患者的年龄、BMI、不育年限、基础FSH、基础AFC(双侧)等比较,均无统计学差异(P>0.05)(表1)。
二、两组患者COH 情况比较
两组患者GnRH-a降调节天数、Gn使用天数、Gn用量、Gn启动日FSH、LH、E2及HCG 日LH、E2、P 水平、平均获卵数等比较,均无统计学差异(P>0.05)。A 组HCG 日子宫内膜厚度[(11.21±2.15)mm]小于B 组[(11.51±2.00)mm],差异有统计学意义(P<0.05),A 组获卵>20枚患者比例(25.31%)大于B组(12.25%),差异有统计学意义(P=0.001)(表2)。
三、两组患者ET 情况及临床妊娠结局
A 组取消移植周期中因为预防OHSS 取消移植周期的比率(18.53%)高于B 组(15.28%)(P<0.05);两组患者2PN 受精率、平均移植胚胎数及平均移植优胚数比较,均无统计学差异(P>0.05);两组胚胎种植率、临床妊娠率、早期流产率比较,亦无显著性差异(P>0.05)(表3)。
表1 患者一般情况比较(±s)
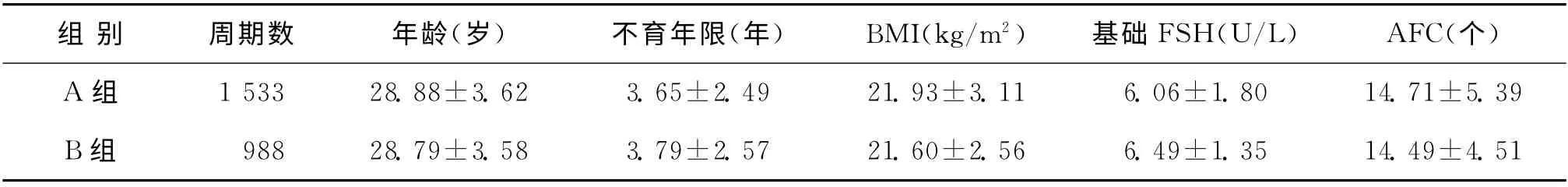
表1 患者一般情况比较(±s)
组 别 周期数 年龄(岁) 不育年限(年) BMI(kg/m2) 基础FSH(U/L) AFC(个)A 组 1 533 28.88±3.62 3.65±2.49 21.93±3.11 6.06±1.80 14.71±5.39 B组 988 28.79±3.58 3.79±2.57 21.60±2.56 6.49±1.35 14.49±4.51
表2 COH 情况比较[(±s),n(%)]

表2 COH 情况比较[(±s),n(%)]
注:与B组比较,*P<0.05,**P<0.01
Gn组别 周期数启动日 HCG 日FSH(U/L) LH(U/L) E2(pmol/L) LH(U/L) E2(pmol/L) P(nmol/L)内膜厚度(mm)A 组 1 533 3.49±0.99 1.62±0.84 70.59±63.29 1.47±0.77 25 194.94±14 952.54 4.27±1.81 11.21±2.15*B组 988 3.67±0.96 1.75±0.87 78.30±63.75 1.70±0.75 22 358.30±16 180.91 3.99±1.83 11.51±2.00组 别 周期数 降调节天数(d) Gn总天数(d) Gn用量(U) 平均获卵数(个) 获卵>20枚患者比例A 组 1 533 16.15±2.72 10.22±1.51 2 174.80±612.22 15.53±7.04 388(25.31)**B组 988 16.09±2.53 10.31±1.50 2 180.49±585.88 15.10±6.54 121(12.25)
表3 两组患者胚胎移植情况及临床妊娠结局比较[(±s),n(%)]

表3 两组患者胚胎移植情况及临床妊娠结局比较[(±s),n(%)]
注:与B组比较,*P<0.05
组 别 周期数 移植周期(个) 平均移植胚胎数(枚) 平均移植优胚数(枚)种植率A 组 1 533 1 033 1.70±0.46 0.92±0.86 805/1 762(45.69)B组 988 679 1.74±0.44 0.81±0.87 560/1 187(47.18)组 别 周期数 取消移植周期率预防OHSS取消移植周期率 2PN 受精率 临床妊娠率 早期流产率A 组 1 533 530(34.57) 284(18.53)* 16 980/23 811(71.31) 626/1 033(60.60) 35/626(5.59)B组 988 340(34.41) 151(15.28) 11 018/14 921(73.84) 440/679(64.80) 25/440(5.68)
讨 论
曲普瑞林是GnRH 的类似物,仅第6、10 位氨基酸以色氨酸、谷氨酸取代甘氨酸,其在体内可竞争性结合GnRH 受体,并延缓降解,效能是天然GnRH的60~200倍[4-5]。早期应用短效曲普瑞林经皮下给药0.1 mg/d 至HCG 日,维持垂体降调节,抑制内源性LH 峰[2]。近年来降调节治疗中GnRH-a的药物剂量呈现减量趋势[6]。有学者报道应用曲普瑞林0.1mg/d×10d后改为0.05 mg/d与0.1mg/d×14d后改为0.05mg/d,这两种降调节方案均能获得满意的降调节效果[7]。另有研究比较了每日GnRH-a用量分别为0.1 mg、0.05 mg、0.015mg组及使用安慰剂组的降调节效果,研究结果显示使用GnRH-a的3组患者均无LH 峰及早发排卵发生,但GnRH-a 0.015mg组患者COH 过程中血清LH 的曲线下面积显著高于其他2组,提示GnRH-a使用剂量为0.015mg时患者自身分泌的LH 水平高于其他两组[8]。本研究对2 521个IVF/ICSI周期的临床资料进行分析,结果显示黄体中期GnRH-a降调节长方案中使用短效GnRH-a(曲普瑞林)0.05mg/d(A 组)与曲普瑞林0.1mg/d×7d后减量至0.05mg/d(B组)比较,两组患者均无LH升高、早发排卵的现象发生,均达到降调节标准。与近几年的研究结论一致,提示对于卵巢反应性正常的患者,采用黄体期降调节长方案时应用曲普瑞林0.05mg/d亦可达到预期的降调节效果。
本研究中两种不同剂量GnRH-a降调节方案的妊娠结局并无显著性差异,与之前文献[6,9]报道一致。但降调节长方案中GnRH-a的药物剂量与垂体降调节的程度有关,较小剂量的GnRH-a抑制垂体的程度相对较轻[10]。有研究报道,使用长效GnRH-a进行降调节治疗时,低剂量组(1.8mg)与全剂量组(3.75mg)比较,低剂量组Gn用量少、获卵数多[11]。本研究中两组患者的Gn用量、Gn天数及平均获卵数比较,均无显著性差异,但曲普瑞林低剂量组获卵数>20枚的患者比例增加,致使新鲜周期为避免OHSS的发生而取消移植的患者亦增加。Aflatoonian等[12]认为常规方案中获卵数>20枚即可定义为卵巢高反应。因此,临床上对于卵巢高反应人群或存在卵巢高反应风险的人群,可选择较大剂量的GnRH-a方案,如0.1mg/d×14d降调节,或采用GnRH 拮抗剂方案以减少OHSS 发生[13]。另外,Edwards等[14]研究认为,降调节治疗会增加子宫内膜对甾体激素的反应性,有利于子宫内膜增厚,且证实子宫内膜厚度与妊娠率成正相关,较高剂量的GnRH-a可能对子宫内膜增厚有益,以增加胚胎种植机会并获得成功妊娠。但有研究报道长方案降调节中使用曲普瑞林1.25mg与3.75mg比较,较低剂量组HCG 日子宫内膜厚度显著低于对照组,临床妊娠率亦显著降低[15]。本研究结果亦显示曲普瑞林0.05 mg/d组子宫内膜厚度显著低于另一剂量组(P<0.05),临床妊娠率虽有降低的趋势,但无显著性差异(P>0.05),缺少临床意义,可能与本研究中将子宫内膜厚度<7mm 者取消胚胎移植有关,故对妊娠结局影响并不显著。
综上,曲普瑞林0.05mg/d的降调节方案并不影响IVF 的妊娠结局,且可有效抑制内源性LH峰,同时可以减少药物剂量,降低治疗费用,对于非卵巢低反应患者有效、可行;而对于存在卵巢高反应风险的患者应用0.05 mg/d曲普瑞林降调节方案则可能增加OHSS发生的风险。因此,临床上应用药物治疗时应严格根据患者情况,采取个性化的治疗方案。但因本研究属于回顾性研究,存在一定局限性,下一步需要大样本的前瞻性随机对照试验及荟萃分析深入讨论。
[1] Van Voorhis BJ.Clinical practice.In vitro fertilization[J].N Engl J Med,2007,356:379-386.
[2] Alvarez C,Cremades N,Blasco N,et al.Influence of gonadotrophin-releasing hormone agonist total dose in the ovarian stimulation in the long down-regulation protocol for in-vitro fertilization[J].Hum Reprod,1997,12:2366-2369.
[3] Brinsden PR.Textbook of in vitro fertilization and assisted reproduction[M].3rd.New York:The Parthenon Publishing Group Inc,1999:1996.
[4] Janát-Amsbury MM,Gupta KM,Kablitz CD,et al.Drug delivery for in vitro fertilization:rationale,current strategies and challenges[J].Adv Drug Deliv Rev,2009,61:871-882.
[5] Hayden C.GnRH analogues:applications in assisted reproductive techniques[J].Eur J Endocrinol,2008,159[Suppl 1]:S17-25.
[6] 黄士荷,李蓉,朱玉霞.个性化微降调方案在控制性超排卵中的应用[J].生殖医学杂志,2013,22:756-762.
[7] 武明莉,金海霞,孙莹璞,等.两种促性腺激素释放激素激动剂降调节方案对体外受精结局的影响[J].生殖医学杂志,2011,20:391-394.
[8] Janssens RM,Lambalk CB,Vermeiden JP,et al.Dose-finding study of triptorelin acetate for prevention of a premature LH surge in IVF:a prospective,randomized,double-blind,placebo-controlled study [J]. Hum Reprod,2000,15:2333-2340.
[9] Li Y,Yang D,Zhang Q.Clinical outcome of one-third-dose depot triptorelin is the same as half-dose depot triptorelin in the long protocol of controlled ovarian stimulation[J].J Hum Reprod Sci,2012,5:14-19.
[10] 黄睿,李婷婷.不同剂量促性腺激素释放激素激动剂长方案中黄体生成素水平变化及临床意义[J].生殖医学杂志,2013,22:736-738.
[11] Dal Prato L,Borini A,Coticchio G,et al.Half-dose depot triptorelin in pituitary suppression for multiple ovarian stimulation in assisted reproduction technology:a randomized study[J].Hum Reprod,2004,19:2200-2205.
[12] Aflatoonian A,Oskouian H,Ahmadi S,et al.Prediction of high ovarian response to controlled ovarian hyperstimulation:anti-Müllerian hormone versus small antral follicle count(2-6mm)[J].J Assist Reprod Genet,2009,26:319-325.
[13] Xiao J,Chen S,Zhang C,et al.Effectiveness of GnRH antagonist in the treatment of patients with polycystic ovary syndrome undergoing IVF:a systematic review and meta analysis[J].Gynecol Endocrinol,2013,29:187-191.
[14] Edwards RG,Morcos S,Macnamee M,et al.High fecundity of amenorrhoeic women in embryo-transfer programmes[J].Lancet,1991,338:292-294.
[15] Ren J,Sha A,Han D,et al.Does prolonged pituitary downregulation with gonadotropin-releasing hormone agonist improve the live-birth rate in in vitro fertilization treatment?[J].Fertil Steril,2014,102:75-81.
