不同处理条件下绞股蓝多糖含量的测定与比较
2015-08-10李瑞娟史万玉
习 南,康 佳,李瑞娟,史万玉
(河北农业大学动物医学院,保定071000)
绞股蓝(Gynostemma pentaphyllum),别名七叶胆、小苦药、甘草蔓、福音草,属葫芦科多年草质藤本植物[1],主要分布于长江以南各省区。现代药理研究和临床应用证明,绞股蓝在调节机体免疫力、抗突变、抗肿瘤、抗氧化、调节营养中枢神经和心血管系统保护等多个方面具有较好的生物活性。而且有报导绞股蓝多糖具有抗癌活性、显著地免疫促进作用、抗疲劳、抗氧化、抗衰老、降血糖作用等药理活性[2]。随着绞股蓝多糖药理活性的不断发现和证实,绞股蓝多糖越来越受到人们的关注的同时,其提取工艺也成为研究的热点。本实验通过不同方法提取绞股蓝多糖,并对其含量进行测定和比较,从而研得更为高效、经济的绞股蓝处理方法以获得绞股蓝多糖得率的最大化,为绞股蓝多糖的开发利用提取依据。
1 材料与方法
1.1 试验材料
1.1.1 中药 绞股蓝饮片,绞股蓝叶超微粉,绞股蓝梗超微粉,4%绞股蓝一次发酵液,4%绞股蓝二次发酵液,由本院中兽医试验室提供。
1.1.2 主要试剂 葡萄糖对照品,购于中国药品生物制品检定所;蒽酮、无水乙醇、石油醚、浓硫酸,购自保定市赛尔克试剂公司;蒸馏水,自制。
1.1.3 主要仪器 UV1750紫外分光光度计(日本岛津);冷冻干燥机(北京松源华兴科技发展有限公司);101-3AB型电热鼓风干燥箱(天津市泰斯特仪器有限公司);MP200A分析天平(双圈牌)。
1.2 试验方法
1.2.1 饮片中绞股蓝多糖的提取方法
(1) 水煎煮法 称取绞股蓝饮片50g,加600m l蒸馏水,煎煮2次,每次1h,过滤,合并滤液。将滤液浓缩到100ml,加入乙醇,使滤液中的乙醇含量达到70%,置4℃冰箱中放置24h,过滤。将过滤后的沉淀物加500ml蒸馏水溶解,加热浓缩到50ml,再加入乙醇,使其乙醇含量达到80%,置4℃冰箱静置24h,过滤。将沉淀物用无水乙醇洗涤2-3次,真空干燥,得绞股蓝多糖粗品,并称重备用[3]。
(2)水提法称取绞股蓝饮片50g,加600ml蒸馏水,90℃回流提取2次,每次2h,过滤,合并滤液。将滤液浓缩到100ml,加入乙醇,使滤液中的乙醇含量达到70%,置4℃冰箱中放置24h,过滤。将过滤后的沉淀物加500ml蒸馏水溶解,加热浓缩到50ml,再加入乙醇,使其乙醇含量达到80%,置4℃静置24h,过滤。将沉淀物用无水乙醇洗涤2-3次,真空干燥,得绞股蓝多糖粗品,并称重备用[4]。
(3)醇碱提法 称取绞股蓝饮片50g,加600m l醇碱提取液(5%乙醇用NaOH调pH至12),90℃回流提取2次,每次2h,过滤,合并滤液。将滤液浓缩到100ml,加入乙醇,使滤液中的乙醇含量达到70%,置4℃冰箱中放置24h,过滤。将过滤后的沉淀物加500ml蒸馏水溶解,加热浓缩到50ml,再加入乙醇,使其乙醇含量达到80%,置4℃冰箱静置24h,过滤。将沉淀物用无水乙醇洗涤2-3次,真空干燥,得绞股蓝多糖粗品,并称重备用[5]。
(4)醇处理水提方法 称取绞股蓝饮片50g,加500ml80%乙醇回流提取2次,每次1h,过滤,弃醇提液,再加600ml的蒸馏水90℃回流提取2次,每次2h,过滤,合并滤液。将滤液浓缩到100ml,并在其中加入乙醇,使滤液中的乙醇含量达到70%,置4℃冰箱中放置24h,过滤。将过滤后的沉淀物加500ml蒸馏水溶解,加热浓缩到50ml,再加入乙醇,使其乙醇含量达到80%,置4℃冰箱静置24h,过滤。将沉淀物用无水乙醇洗涤2-3次,真空干燥,得绞股蓝多糖粗品,并称重备用[6]。
(5)石油醚醇处理水提法 称取绞股蓝饮片50g,先加500ml的石油醚,回流提取2次,每次1h。弃去提取液,再加500ml80%乙醇回流提取2次,每次1h。弃去提取液加600ml蒸馏水,90℃回流提取2次,每次2h,过滤,合并滤液。将滤液浓缩到100ml,并在其中加入乙醇,使滤液中的乙醇含量达到70%,置4℃冰箱中放置24h,过滤。将过滤后的沉淀物加500ml蒸馏水溶解,加热浓缩到50m l,再加入乙醇,使其乙醇含量达到80%,置4℃静置24h,过滤。将沉淀物用无水乙醇洗涤2-3次,真空干燥,得绞股蓝多糖粗品,并称重备用[7]。1.2.2 绞股蓝多糖的含量测定 (1)葡萄糖标准液的配制精密称取干燥至恒定质量的葡萄糖标准品200mg,定溶1000ml容量瓶中,即得葡萄糖标液。
(2)蒽酮硫酸溶液的配制 精密称取蒽酮200mg,溶解于100ml浓硫酸中,即得0.2%的蒽酮硫酸溶液。
(3)最大吸收波长的选择 采用蒽酮-浓硫酸比色法。精密量取葡萄糖标准液30ml,置于100ml容量瓶中定容。取稀释后的葡萄糖标准液1ml于试管中,再加入4ml的蒽酮硫酸溶液(冰水浴中进行),各管加完后一起浸入沸水中,自水重新沸起准确煮沸10min,立即冷却到室温。另以未加葡萄糖的溶液为参比,于紫外分光光度计上从400-700 nm范围内扫描。比较此范围内的吸光度大小,确定葡萄糖标准液的最大吸收波长。
(4)标准曲线的绘制分别精密移取葡萄糖标液10、20、30、40、50m l置于100ml容量瓶中定容。按上述蒽酮-浓硫酸比色法操作,显色后于紫外分光光度计上620nm处测定其吸光度A,以A为纵坐标,C(对照品的浓度)为横坐标,绘制标准曲线,并计算回归方程[8]。
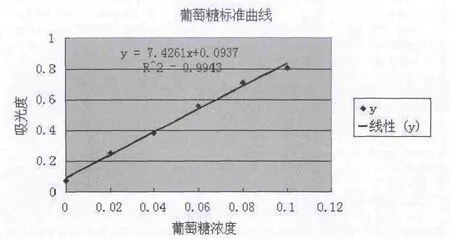
图1 葡萄糖标准曲线
(5)样品多糖含量测定分别精密称取不同方法得到的干燥的多糖粗品20mg,于100m l容量瓶中定容得样品溶液。按上述蒽酮-浓硫酸比色法操作,显色后于紫外分光光度计上620nm处测定其吸光度。进而计算出绞股蓝全草中绞股蓝多糖的含量,从而确定出最佳提取方案。
1.2.3 绞股蓝超微粉与发酵液中多糖的提取与含量测定 称取绞股蓝叶与梗的超微粉各50g分别按上述所得的最佳提取方法进行试验操作,得绞股蓝多糖粗品后按2.2.2(3)中蒽酮-浓硫酸比色法操作,显色后于紫外分光光度计上620nm处测定其吸光度。然后分别计算出绞股蓝梗、叶细粉中提取的绞股蓝多糖粗品中绞股蓝多糖的含量进行比较。
绞股蓝发酵液采用直接醇沉处理提取绞股蓝多糖。量取4%绞股蓝一次发酵液与4%绞股蓝二次发酵液各1000ml,滤除残渣后将滤液浓缩至100ml,并在其中加入乙醇,使滤液中的乙醇含量达到70%,置4℃冰箱中放置24h,过滤。将过滤后的沉淀物加500ml蒸馏水溶解,加热浓缩到50ml,再加入乙醇,使其乙醇含量达到80%,置4℃静置24h,过滤。将沉淀物用无水乙醇洗涤2-3次,真空干燥,得多糖粗品,称重。然后按2.2.2(3)中蒽酮-浓硫酸比色法操作,显色后于紫外分光光度计上620nm处测定其吸光度,进而计算出发酵液中绞股蓝多糖含量。
2 结果
2.1 最大吸收波长的选择结果 经紫外分光光度计在400-700nm范围内测定吸光度,得知葡萄糖标准溶液的最大吸收波长为620nm。
2.2 标准曲线的绘制 经紫外分光光度计在620nm处测定不同浓度对照品吸光度A,以A为纵坐标,C(对照品的浓度)为横坐标,绘制标准曲线如图1,得回归方程:A=7.4261C+0.0937,R2=0.9943。
2.3 不同方法提取的绞股蓝饮片中多糖粗品的含量 经紫外分光光度计测定吸光度后,计算得知不同方法提取的绞股蓝饮片中绞股蓝多糖粗品的含量,如表1所示,醇碱提法测定的绞股蓝多糖粗品的含量最高为49.1400mg/g。
2.4 不同部位的绞股蓝粗多糖的含量 由表1和表2可以看出,绞股蓝发酵液含量最高,超微粉次之,饮片中含量最低。并且绞股蓝叶超微粉中多糖粗品含量明显高于梗超微粉,二次发酵液绞股蓝多糖粗品含量显著高于一次发酵液。
2.5 不同方法提取的绞股蓝饮片多糖粗品中绞股蓝多糖的含量 通过计算得知绞股蓝饮片粗多糖中绞股蓝多糖的含量,如表3所示,醇碱提法测定的多糖纯度最高。比较绞股蓝饮片、超微粉、发酵液中绞股蓝多糖纯度,如表4所示,以绞股蓝发酵液含量最高,超微粉次之,饮片中含量最低。并且绞股蓝叶超微粉中多糖粗品含量明显高于梗超微粉,二次发酵液绞股蓝多糖粗品含量显著高于一次发酵液。

表1 绞股蓝饮片中绞股蓝粗多糖含量(mg/g)

表2 超微粉/发酵液中绞股蓝粗多糖含量(mg/g)

表3 不同提取方法绞股蓝粗多糖中绞股蓝多糖含量(g/g)

表4 绞股蓝多糖粗品中绞股蓝多糖的含量(g/g)
3 讨论与小结
在本实验中,比较五种提取方法所得的绞股蓝多糖的含量发现,醇碱提法是最佳的提取方法。这可能是是由于碱溶液对植物细胞起到破壁作用,醇溶液渗透作用较强,在碱与醇的共同作用下,增加了多糖渗透率,降低多糖残留量,达到提高提取率的目的[9];多糖粗品的多糖含量最高有可能是醇碱液中的乙醇可以溶解掉多糖中的单糖的缘故。水煎煮得到的绞股蓝多糖稍少可能是因为绞股蓝多糖随水蒸汽蒸发到了环境中。醇处理,石油醚醇处理方法得到的绞股蓝多糖含量低于其他方法,也许是乙醇可以充分溶解绞股蓝中的葡萄糖。
绞股蓝超微粉中绞股蓝多糖的含量明显多于绞股蓝饮片。超微粉碎技术能在一定程度上破坏绞股蓝细胞壁,从而减少有效成分由内向外传递的的阻力,增加了植物细胞的比表面积,使绞股蓝粉体有效成分溶出更迅速,彻底[10]。
绞股蓝叶与梗中的绞股蓝多糖含量的比较证明,常常被人们弃之不用的绞股蓝梗茎中仍然还有较高量的绞股蓝有效成分,具有一定的药用价值,我们应该合理利用绞股蓝梗茎,可以大大降低用药成本,也可以降低用药紧张的矛盾。
绞股蓝液体发酵时,除菌丝体的大量繁殖外,同时还向液体培养基分泌了大量的胞外多糖,故而绞股蓝发酵液提取的绞股蓝多糖尤为多,并且二次发酵比之一次发酵提取的多糖更多[11]。
[1]蔡金腾,丁筑红,雷方俊,等.高VC复合绞股蓝袋泡茶的研制[J].食品科学,1996,6(2):37-40.
[2]李艳茹.绞股蓝多糖对疲劳运动小鼠免疫能力的影响[J].食品科学,2008,29(8):584-586.
[3]倪艳,苏强.黄芪多糖水煎提取工艺的优化试验研究[J].中国中药杂志,1998,23(5):284-286.
[4]田洛.醇碱提取法提取黄芪多糖的优化试验研究[J].中国中药杂志,2000,23(5):22-24.
[5]吴永平,曹园,曹正中.黄芪活性成分最佳提取工艺探讨[J].时珍国医国药,2001,12(10):876-877.
[6]张洪波,任春晓.黄芪叶提取及黄芪多糖测定方法研究[J].黑龙江医药,2005,18(1):6-8.
[7]王昶,邢志华,王青.黄芪地上部分中多糖含量的研究[J].黑龙江医药,2006,19(5):343-344.
[8]王青豪,潘虹,杨宇飞,等.从绞股蓝中联合提取皂苷、黄酮和多糖工艺优化[J].食品科学,2012,33(22):63-66.
[9]张先海,史丽岩,史景明.不同方法提取黄芪中黄芪多糖的比较[J].海峡药学,2010,22(10):79-80.
[10]邓美琳,吴天祥.超微粉碎对绞股蓝总皂苷提取工艺的影响[T].食品工业,2009,2:34-36.
[11]田瑶,王玉华.茯苓发酵液中多糖的提取分离[T].科技,2012:10.
