清热解毒化浊片对肠源性内毒素血症大鼠肝肺促炎因子IL-8及抗炎因子IL-10 的影响*
2015-08-10毛娅男赵国荣连俊凯陈研焰李雄安何宜荣艾碧琛
毛娅男,赵国荣,连俊凯,陈研焰,李雄安,何宜荣,艾碧琛
(湖南中医药大学中医学院,湖南 长沙410208)
正常情况下,机体肠道内存在由大量G-细菌释放的内毒素(LPS),由于肠道粘膜的屏障作用,肝巨噬细胞(KC)的清除作用,LPS 很难进入体循环,当肠粘膜完整性破坏,KC 吞噬能力障碍时,大量LPS 入血,形成内毒素血症,引发全身炎症反应,因LPS 来自于肠道,故称为肠源性内毒素血症(IETM)。IETM 形成后可激活KC 大量释放炎性因子,造成肝、肺炎性损伤[1],IETM 是急性肝衰竭、急性肺损伤、肝肺综合征、全身炎症反应综合征发生的重要原因。临床对于IETM 的治疗重点在于改善并发症,控制病情,尚无针对IETM 疗效确切的药物。清热解毒化浊片为湖南中医药大学第一附属医院院内制剂,具有减轻炎症反应,保肝护肝作用[2]。前期研究表明清热解毒化浊片可降低血浆内毒素水平,终止肝损伤的恶性循环,达到减轻肝脏炎性反应的目的[3]。本研究拟建立IETM 肝肺损伤大鼠模型,进一步探讨清热解毒化浊片对肝肺的保护作用。
1 材料
1.1 动物
清洁级雄性SD 大鼠70 只,体质量为(200±10)g,由湖南中医药大学实验动物中心提供。许可证号:SYXK(湘)2013-0005,合格证号:43004700007002。
1.2 药物与饲料
清热解毒化浊片由湖南中医药大学第一附属医院提供(批号:20140605),52°红星二锅头由北京红星股份有限公司提供(批号:20140128),大鼠普通饲料及高脂高糖饲料由湖南斯莱克景达实验动物公司提供。高脂高糖饲料综合文献[4]配制方法上进行改进,其组成为:77.3%基础饲料+0.2%丙基硫氧嘧啶+2%胆固醇+10%猪油+0.5%胆盐+8%蛋黄粉+2%白糖。
1.3 试剂与仪器
鲎试剂盒由湖南中医药大学第一附属医院肝病检测室提供,生化检测试剂盒由湖南中医药大学生化检测中心提供,IL-8、IL-10 兔抗鼠抗体均由武汉博士德生物工程有限公司提供,通用型PV-9000试剂盒由北京中杉金桥生物技术有限公司提供。罗氏全自动生化分析仪(罗氏公司生产),RT-6000 酶标仪(深圳雷杜生命科学股份有限公司),Motic B5显微成像系统(麦克奥迪实业集团公司),电热恒温箱(上海精宏实验设备有限公司),电热恒温干燥烤箱(北京中兴伟业仪器有限公司),石蜡切片机、摊片机(天津市久圣医疗电子仪器有限公司)。
2 方法
2.1 动物模型制备
综合文献[5-6]方法并加以改进,予高脂高糖饲料喂养大鼠,同时每天按10mL/kg 剂量予52°二锅头灌胃1 次,并每周称大鼠体质量,根据体质量调整白酒剂量。以血液生化指标及肝、肺组织病理切片判断造模成功与否。
2.2 分组及给药
取SD 大鼠70 只,随机分为空白组(10 只)和造模组(60 只)。造模组大鼠按2.1 方法进行造模。模型成功后,将造模组大鼠随机分为模型组(10只)、清热解毒化浊片组(10 只),清热解毒化浊片组按0.081g/mL 灌胃,模型组及正常组予等容积蒸馏水灌胃,每组动物灌胃量均为1mL/100g·d-1,连续给药4 周。
2.3 取材及指标检测
末次给药结束后,禁食不禁水12h,次日清晨,腹主动脉采血,3 000r/min,离心10min,取血清,采用罗氏分析仪分别检测血清ALT、AST、GGT、ALP的含量,动态浊度法检测血浆LPS 含量。同时,迅速摘取肝、肺脏,在肝、肺脏最大叶,距边缘5mm 处取小块肝、肺组织,部分用10%甲醛固定,石蜡包埋,切片,HE 染色,光镜下观察肝、肺组织病理学改变,部分用4%多聚甲醛固定,石蜡包埋,切片,利用免疫组化PV 二步法检测肝、肺组织中IL-8、IL-10 含量,采用光学显微镜和全自动图像获取系统Olympus DP71 在高倍镜视野(×400)下随机选取5 个区域,测量并记录每个视野阳性染色的平均灰度值,作为该片的代表值,再计算该组的平均灰度,进行统计学比较。
2.4 统计学分析
采用SPSS17.0 统计软件处理。计量资料数据按均数±标准差(x±s)表示,采用单因素方差分析检验,P<0.05 为差异具有统计学意义。
3 结果
3.1 各组大鼠肝、肺组织病理学改变
正常组大鼠肝小叶轮廓清晰,肝细胞以中央静脉为中心向四周呈放射状排列。模型组可见肝小叶结构破坏,呈点、片状坏死,肝细胞水肿明显,胞质中可见大小不等、数量不一的圆形脂肪空泡,小叶中央静脉周围和汇管区有炎性细胞浸润。清热解毒化浊片组肝细胞轻微肿胀,结构较疏松,部分肝细胞内线粒体疏松,结构欠清晰。结果见图1。
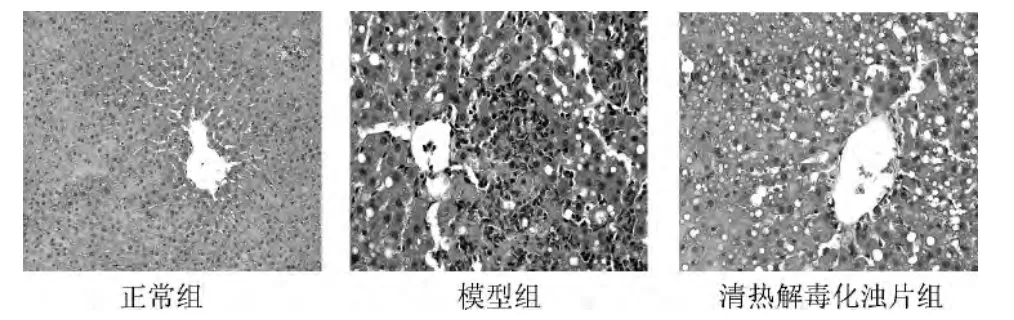
图1 各组大鼠肝组织病理学形态观察(HE 染色×400)
正常组大鼠肺泡隔间距小,肺泡形态完整未见明显炎细胞浸润。模型组肺泡隔间距明显增宽,肺泡形态挤压,明显炎细胞浸润,有间质水肿可能。清热解毒化浊片组肺泡隔间距较正常组的增宽,肺泡形态完整可见少量炎细胞浸润。结果见图2。

图2 各组大鼠肺组织病理学形态观察(HE 染色×400)
3.2 清热解毒化浊片对大鼠血清ALT、AST、GGT、ALP,血浆LPS 的影响
与正常组比较,模型组具有显著性差异(P<0.01,P<0.05),提示造模成功。经治疗后,与模型组比较,清热解毒化浊片组血清ALT、AST、GGT、ALP均明显降低(P<0.01,P<0.05)。结果见下页表1。
3.3 清热解毒化浊片对大鼠肝、肺组织IL-8、IL-10的影响
与正常组比较,模型组大鼠肝、肺组织IL-8 表达存在显著性差异(P<0.01)。经治疗后,与模型组比较,清热解毒化浊片组肝、肺组织IL-8 表达明显降低(P<0.01),IL-10 表达升高(P<0.05)。结果见下页表2、图3-4、图5-6。

表1 各组大鼠ALT、AST、GGT、ALP、LPS 的比较(x±s,n=10)

表2 各组大鼠肝、肺组织IL-8、IL-10 表达的比较(x±s,n=10)

图3 各组大鼠肝组织IL-8 阳性表达观察(免疫组化×400)

图4 各组大鼠肺组织IL-8 阳性表达观察(免疫组化×400)
4 讨论
中医尚无相应病名的论述与记载,据研究G-细菌所引起的疾病类似湿热病证的特点,而湿热病患者血浆内毒水平升高[7],可见IETM 的中医病因病机与湿热浊毒有关。过食肥甘、嗜酒贪杯,致脾失健运,湿浊内生,湿久酿热,热久蕴毒,湿热浊毒胶着,热蒸湿动,弥漫脏腑经络,出现各脏腑的湿热症状。因此,中医治疗IETM 重点在于清热解毒,祛湿化浊。清热解毒化浊片由茵陈、滑石、木通、豆蔻仁、藿香、泽泻、黄芩、薄荷、连翘等组成,其中茵陈、木通、泽泻、滑石利湿化浊,导湿热从小便而出;藿香、豆蔻芳香化湿,导湿从表而解;黄芩、连翘、薄荷清热解毒,透热外达。全方分消上下,透达内外,共奏清热解毒、利湿化浊之效。临床发现,清热解毒化浊片对于湿热内蕴证患者有良好的治疗作用[8]。本实验通过高脂高糖、酒精等复合因素建立IETM 肝、肺损伤大鼠模型,经清热解毒化浊片治疗后,肝、肺损伤减轻,提示IETM 的形成与中医湿热浊毒密切相关。

图5 各组大鼠肝组织IL-10 阳性表达观察(免疫组化×400)
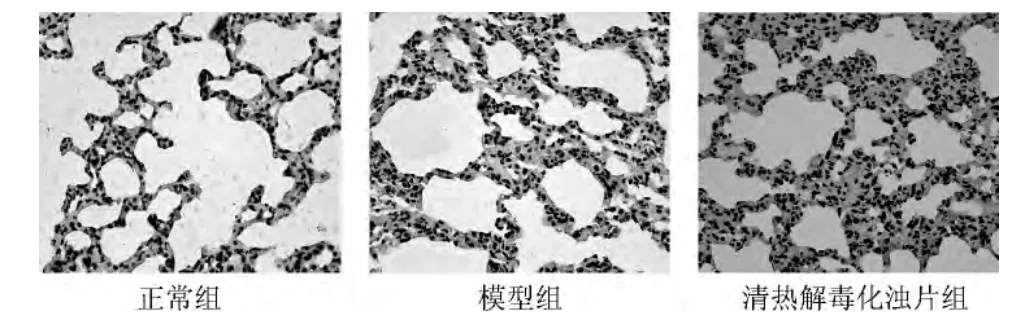
图6 各组大鼠肺组织IL-10 阳性表达观察(免疫组化×400)
多项研究认为IETM 是肝、肺损伤,肝肺综合征形成的病理基础。IETM 引发肝脏“二次打击”,从而激活KC 释放炎性介质如TNF-α、IL-1、IL-8 等,一方面炎性因子随血流入肺脏,导致肺脏炎性损伤;另一方面由于肝的解毒能力下降,被激活的肺内巨噬细胞代偿性清除LPS,同时分泌大量活性物质如NO、CO、TNF-α、IL-1、IL-8 及其他的炎性介质,加重肺脏损伤[9-10]。据文献报道,降低LPS 水平,可直接拮抗IETM 效应,达到减轻肝、肺炎性损伤的目的[11],而前期研究发现清热解毒化浊片有降低患者血浆内毒素水平的作用。本研究通过复合因素建立IETM致肝、肺损伤大鼠模型,血浆LPS 水平升高(P<0.05),血清ALT、AST、GGT、ALP 明显升高(P<0.01,P<0.05),肝、肺组织出现炎性浸润、结构破坏等病理学改变,提示造模成功。经清热解毒化浊片治疗后血浆LPS 明显降低(P<0.01),血清ALT、AST、GGT、ALP 均明显降低(P<0.01,P<0.05),肝、肺组织炎性细胞浸润减轻,结构较前清晰,与文献报道一致,提示清热解毒化浊片可减轻因IETM 所致的肝、肺炎性损伤,其作用机制与降低血中LPS 水平有关。
IL-8 是一种促炎症因子,能特异性地促进中性粒细胞的趋化、变形、脱颗粒、释放溶酶体酶等参与炎症反应,与多种炎性疾病的发生发展密切相关[12]。当IETM 形成后LPS 即与KC 中TLR-4 受体结合导致TLR-4 寡聚化而被激活,通过MyD88 依赖和非MyD88 依赖的两条途径触发一系列的信号级联反应,诱导NF-KB、AP-1 和IRF-3 等转录因子磷酸化和核转位,上调IL-8 的表达,大量IL-8 释放入血,参与全身炎症反应[13]。研究认为,降低IL-8 的表达可减轻肝、肺组织的炎性损伤[14-15]。本实验,IETM致肝、肺损伤大鼠模型中,肝、肺组织炎性浸润,IL-8 表达水平明显升高(P<0.01),经清热解毒化浊片治疗后肝、肺组织IL-8 明显降低(P<0.01),炎性损伤减轻,与文献报道一致,提示清热解毒化浊片具有降低IL-8 水平,从而改善组织炎性损伤的作用。IL-10 是重要的抗炎因子,既能下调T 淋巴细胞活性,抑制炎性细胞的激活、迁移和粘附,又可通过介导IKK-b/NF-κB 通路在转录水平上抑制炎性因子IL-1、IL-6、IL-8、TNF-α 等表达,改善炎症反应[16]。本实验清热解毒化浊片组大鼠肝、肺组织均出现IL-10 表达较其他组明显升高(P<0.01),提示清热解毒化浊片可升高IL-10 的水平,达到抗炎作用。
综上所述,清热解毒化浊片具有清热解毒、利湿化浊的功效,可治疗因IETM 所致的浊毒蕴结,其作用机制与降低血浆LPS 水平,促进抑炎因子IL-10 的表达,降低促炎因子IL-8 的释放,减轻肝、肺组织炎性损伤有关。
[1] 杨喜艳,卢放根. 肠源性脂多糖的研究进展[J]. 国际病理科学与临床杂志,2013,33(5):416-422.
[2] 谢静,赵国荣,熊焰,等. 清热解毒化浊片对慢性病毒性肝炎湿热内蕴证与肝郁脾虚证疗效的研究[J]. 湖南中医学院学报,2003,23(6):33-35.
[3] 赵国荣,曹军连,谢静,等. 不同剂量清热解毒化浊片对大鼠免疫性肝损伤治疗作用的对比研究[J]. 中西医结合肝病杂志,2004,14(1):23-25.
[4] 谢超敏,谭巧燕,饶子亮,等. 结合高脂饲料建立酒精性肝损伤大鼠模型的研究[J]. 实验动物科学,2009,26(3):11-13.
[5] 刘庆丰,李中东,施孝金,等. 高脂血症非酒精性脂肪肝大鼠模型的建立[J]. 时珍国医国药,2013,24(1):171-172.
[6] 王晓红,曹琦,李俊,等. 改良法大鼠酒精性脂肪肝模型的建立[J]. 安徽医科大学学报,2007,42(2):420-423.
[7] 黄婉怡,王玉涛,王新华. 温病湿热证湿阻病机与红细胞特殊结构和功能的关系探讨[J]. 广州中医药大学学报,2015,32(5):321-329.
[8] 肖碧跃,赵国荣,艾碧琛,等. 清热解毒化浊片对病毒性肝炎肝损害疗效观察[J]. 湖南中医药大学学报,2010,30(7):49-50.
[9] Zhang HY,Han de W,Su AR,et al. Intestinal endotoxemia plays a central role in development of hepatopulmonary syndrome in a cirrhotic rat model induced by multiple pathogenic factors [J]. World J Gastroenterol,2007,13(47):6385-6395.
[10] 杨勇,易斌,鲁开智. 肝肺综合征病理发生机制的研究进展[J]. 医学研究生学报,2013,26(10):1092-1094.
[11] 贾建桃,张慧英,来丽娜,等. 丹参素对肝肺综合征大鼠肺脏的保护作用[J]. 中国应用生理学杂志,2014,30(3):199-202.
[12] 李瑶,吕德官,陈临溪. IL-8 及其受体药物与疾病的研究进展[J]. 中国药理学通报,2014,30(3):310-314.
[13] 陈怿,童华生,苏磊. 库普弗细胞在肠源性内毒素血症肝损伤中的作用[J]. 广东医学,2011,32(17):2350-2351.
[14] 文秀芳,陈霞,邬海桥. 姜黄素通过抑制TLR4 信号通路下调脂多糖诱导的肺巨噬细胞分泌TNF-a、IL-6 和IL-8[J]. 云南中医学院学报,2013,36(6):45-48.
[15] 冯芹,夏文凯,王现珍,等. 连翘苷元对四氯化碳大鼠急性肝损伤的保护作用[J]. 中国药理学通报,2015,31(3):426-430.
[16] 赵宁伟,殷志敏. 关于IL-10 抗炎机制的研究[J]. 生命科学研究,2007,11(4):14-17.
