转化左旋乙基甾烯双酮的微生物筛选及转化产物研究
2015-08-09工业发酵微生物教育部重点实验室天津科技大学生物工程学院天津300457
(工业发酵微生物教育部重点实验室,天津科技大学生物工程学院,天津 300457)
(工业发酵微生物教育部重点实验室,天津科技大学生物工程学院,天津 300457)
为了满足甾体药物日益增长的市场需求,从南方采集的新鲜树皮中筛选出具有转化新型甾体化合物左旋乙基甾烯双酮活力的微生物米根霉.利用该菌对左旋乙基甾烯双酮进行生物催化,转化产物经纯化、重结晶后,通过单晶衍射鉴定为 6,β-羟基-13,β-乙基-4-烯-3,17-二酮和 10,β-羟基-13,β-乙基-4-烯-3,17-二酮.通过高效液相色谱对转化过程中的甾体化合物进行分析,发现转化24,h后,底物左旋乙基甾烯双酮、6,β-羟基化产物和10,β-羟基化产物的含量分别为28.4%、32.2%和35.7%.
左旋乙基甾烯双酮;米根霉;生物催化
甾体药物在临床上具有极其重要的医药价值,通常在免疫调节、皮肤疾病治疗及生育控制方面有较好的作用[1].甾体化合物经过化学或生物法修饰以后其药理学活性会增强,微生物转化能够得到化学法难以合成的甾体衍生物[2],因此在甾体药物的生产中发挥着极其重要的作用.
目前,已报道的具有甾体药物生物转化活性的微生物多达 1,500种,其中真菌包括根霉属[3-5]、曲霉属[6-7]和青霉属[8-11]等,但只有少数几个微生物成功应用到甾体药物的工业生产中[12-13].而且,现在已知的 5,000多种具有潜在价值的甾体化合物中已投放市场的并不多,随着甾体药物的应用范围逐渐扩大,具有甾体生物催化功能的新型微生物的分离和筛选成为近年来甾体药物领域的研究热点[14-15].
左旋乙基甾烯双酮是合成孕激素类药物的重要中间体.关于该化合物的微生物转化的研究已有一些相关报道[16-19],反应类型主要包括 11,α-羟基化反应、15,α-羟基化反应以及17,β,15,α-羟基化反应,所得产物分别为合成高效口服避孕药地索高诺酮、△15-D-18-甲基炔诺酮以及孕二烯酮的重要中间体.
为获得具有潜在药学价值的新型甾体化合物,本文以左旋乙基甾烯双酮(13,β-乙基-4-烯-3,17-二酮)为底物,对实验中所分离的霉菌菌株进行生物转化的筛选,并对优势菌株的转化产物进行了分离纯化和结构鉴定.
1 材料与方法
1.1 菌种分离样品
气候湿润的南方地区采集的新鲜树木(银杉、银杏树、桂花树、松树、柳树、樟树、桑树、柑橘树、榕树、棕榈等)的树皮.
1.2 培养基
平板及斜面培养基(PDA):马铃薯 200,g、葡萄糖20,g、琼脂15~20,g、自来水1,L,pH自然.
发酵培养基:葡萄糖 20,g、蛋白胨 20,g、酵母膏5,g、自来水1,L,pH 5.0.
1.3 霉菌菌株分离与纯化
将新鲜树皮剪成小片,置于 PDA平板培养基,28,℃培养箱倒置培养.待树皮切片周围处长出菌丝后,挑取菌落尖端部分的菌丝移至新鲜的 PDA培养基平板上,28,℃条件下培养,如此反复纯化直至得到纯化菌株,挑取培养皿内的霉菌菌落接种于斜面培养基上,于4,℃冰箱冷藏备用.
1.4 培养与转化方法
将斜面种子用无菌水配制成孢子悬浮液(108mL-1),按 4%接种量接入装有 50,mL发酵培养基的250,mL三角瓶中,28,℃、180,r/min条件下振荡培养24,h后,加入预先用乙醇溶解的底物(最终底物质量浓度为 1,g/L),继续在相同培养条件下生物转化24,h.
1.5 转化结果分析方法
左旋乙基甾烯双酮微生物转化结果的检测采用TLC法.取0.6,mL发酵液于1.5,mL EP管中,加入等体积乙酸乙酯剧烈振荡抽提 2,min,静置,取上层有机相点样于 TLC板上,展开剂为 V(石油醚)∶V(乙酸乙酯)=1∶1,紫外分析仪254,nm波长下观察底物转化情况.
1.6 18S rDNA基因测序与同源性分析
采用真菌基因组 DNA提取试剂盒提取DNA,经 PCR扩增和琼脂糖凝胶电泳得到目的条带,PCR产物用回收试剂盒回收纯化,委托北京六合华大基因科技股份有限公司进行测序.
18S rDNA序列结果采用 BLAST分析,找出与待测菌株同源性最高的已知分类菌种,鉴定其种属.
1.7 转化产物分离提取与鉴定
依照 1.4所述的方法进行米根霉菌体培养和底物转化,转化24,h后合并所有3,L发酵液,用等体积乙酸乙酯萃取,旋蒸浓缩后,浓缩液经硅胶柱层析分离得到产物,产物通过结晶和重结晶得到产物单晶.
产物鉴定采用单晶衍射法.单晶 X射线衍射使用Bruker Apex II CCD衍射仪,以Mo Kα辐射(λ= 0.07,nm)作为衍射光源,采用 SMART程序在 293,K条件下扫描收集单晶衍射数据.运用 SAINT程序还原数据和SADABS程序进行经验吸收矫正.结构采用SHELXTL程序用直接法解出,并基于F2用全矩阵最小二乘法对结构进行精修.非氢原子采用各向异性热参数精修.所有氢原子均为理论加氢并采用各向同性热参数及跨式模型进行修正.
1.8 转化率的测定方法
转化率的测定采用高效液相色谱(HPLC)法.色谱条件:采用C18柱(4.6,mm×250,mm,5,µm),流动相为 V(乙腈)∶V(水)=70∶30的混合溶液,流量0.8,mL/min,进样量 10,µL,柱温 25,℃;UV 240,nm检测.
2 结果与讨论
2.1 具有高效甾体转化能力菌株的筛选
用所筛选的霉菌对左旋乙基甾烯双酮进行甾体微生物转化实验,得到了一株转化能力强且底物特异性好的菌株5#,转化结果如图1所示,该菌催化左旋乙基甾烯双酮生成两个产物.
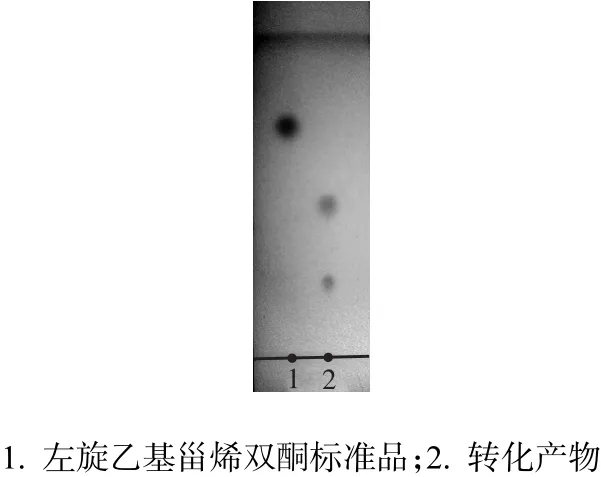
图1 TLC法分析5#菌株转化左旋乙基甾烯双酮的产物Fig. 1 TLC analysis of transformation products by strain 5#
2.2 转化产物的鉴定
通过单晶衍射鉴定该菌转化左旋乙基甾烯双酮(1)的产物分别为 6,β-羟基-13,β-乙基-4-烯-3,17-二酮(2)和 10,β-羟基-13,β-乙基-4-烯-3,17-二酮(3).米根霉生物催化左旋乙基甾烯双酮羟基化的反应式如图2所示.
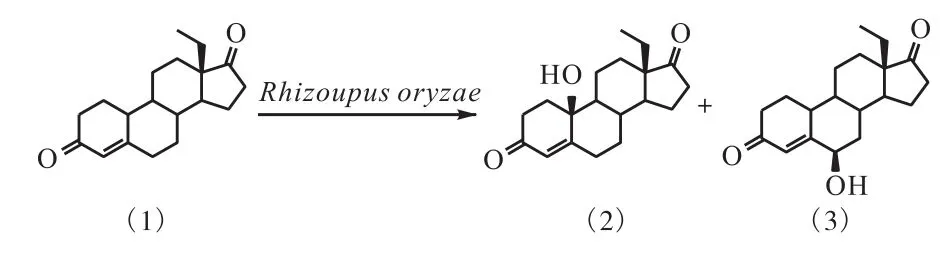
图2 13β-乙基-4-烯-3,17-二酮的羟基化反应Fig. 2 Hydroxylation of 13β-ethyl-4-gonene-3,17-dione bystrain 5#
6,β-羟基-13,β-乙基-4-烯-3,17-二酮的晶体结构如图3所示.晶体数据:分子式C19,H26,O3,相对分子质量 302.40,晶体尺寸 0.18,mm×0.17,mm× 0.16,mm,属正交晶系,空间群为 P2(1)2(1)2(1).晶胞参数 a=0.97,nm,b=1.23,nm,c=1.35,nm,α= 90°,β=90°,γ=90°,晶胞体积 V=1.61,nm3,晶胞内分子数 Z=4,晶体计算密度 Dcalcd=1.247,mg/m3.测量温度 173(2)K,吸收系数 0.083,mm-1,共收集到独立衍射点 2,839个,结构偏离因子 R1=0.038,2,wR2=0.093,2;R1=0.040,3,wR2=0.094,8.
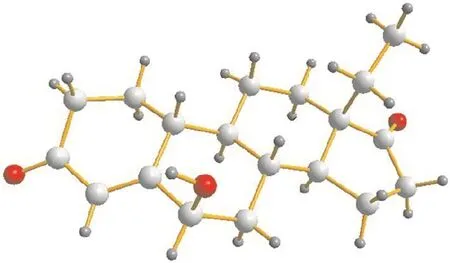
图3 6β-羟基-13β-乙基-4-烯-3,17-二酮的晶体结构Fig. 3 Crystal structure of 6β-hydroxy-13β-ethyl-4-gonene-3,17-dione
10,β-羟基-13,β-乙基-4-烯-3,17-二酮的晶体结构如图4所示.
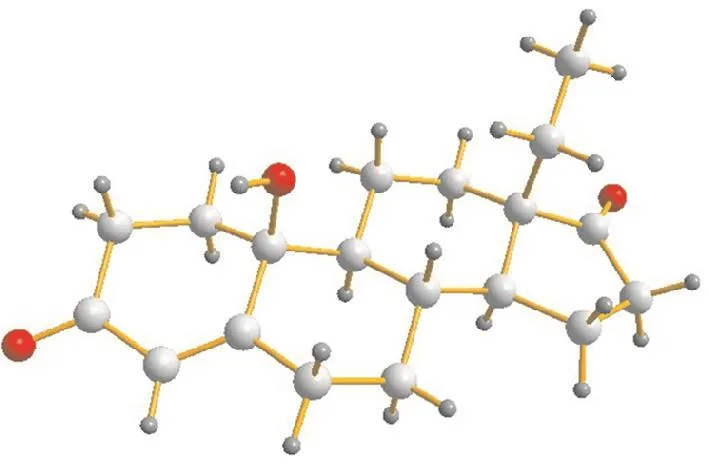
图4 10β-羟基-13β-乙基-4-烯-3,17-二酮的晶体结构Fig. 4 Crystal structure of 10β-hydroxy-13β-ethyl-4-gonene-3,17-dione
晶体数据:分子式 C19,H26,O3,相对分子质量302.40,晶体尺寸 0.18,mm×0.14,mm×0.12,mm,属正交晶系,空间群为 P2(1)2(1)2(1).晶胞参数 a= 0.73,nm,b=0.98,nm,c=2.30,nm,α=90°,β=90°,γ=90°,晶胞体积V=1.65,nm3,晶胞内分子数Z=4,晶体计算密度 Dcalcd=1.216,mg/m3.测量温度173(2)K,吸收系数 0.080,mm-1,共收集到独立衍射点 2,881个,结构偏离因子 R1=0.036,4,wR2= 0.084,1;R1=0.039,7,wR2=0.086,3.
化合物 6,β-羟基-13,β-乙基-4-烯-3,17-二酮(2)和 10,β-羟基-13,β-乙基-4-烯-3,17-二酮(3)均为已知化合物[20],周维善等[21]利用黑根霉在左旋乙基甾烯双酮的 C11,α,位引入羟基,同时得到了其他 3种羟基化产物,包括少量的 C6,β(18%)和 C10,β(9%)羟基产物.说明实验中所筛选的米根霉具有较好的特异性生物催化左旋乙基甾烯双酮羟基化的能力.
2.3 菌株分子生物学鉴定
依照 1.6所述的方法,将提取到的 5#菌株的DNA片段经过PCR扩增后进行琼脂糖凝胶电泳,结果如图5所示.
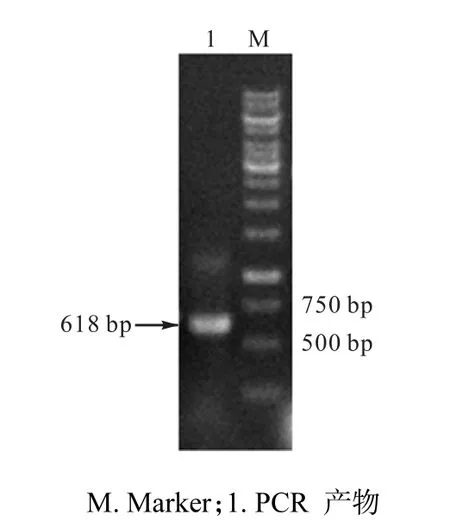
图5 菌株5#的18S rDNA PCR扩增结果得到618,bp片段Fig. 5 618,bp DNA fragment amplified by PCR from 18S rDNA of strain 5#
根霉菌5#的18S rDNA序列测序结果显示如下:TGCGGAAGGGGATCATTAATTATGTTAAAGCGCC TTACCTTAGGGTTTCCTCTGGGGTAAGTGATTGC TTCTACACTGTGAAAATTTGGCTGAGAGACTCA GACTGGTCATGGGTAGACCTATCTGGGGTTTGAT CGATGCCACTCCTGGTTTCAGGAGTACCCTTCAT AATAAACCTAGAAATTCAGTATTATAAAGTTTAAT AAAAAACAACTTTTAACAATGGATCTCTTGGTT CTCGCATCGATGAAGAACGTAGTAGCAAAGTGC GATAACTAGTGTGAATTGCATTCAGTGAATCGAG TCTTTGAACGCAGCTTGCACTCTATGGTTTTTCT ATAGAGTACGCCTGCTTCAGTATCATCACAAACC CACACATAACATTTGTTTATGTGGTGATGGGTCG CATCGCTGTTTTATTATTACAGTGAGCACCTAAA ATGTGTGTGATTTTCTGTCTGGCTTGCTAGGCAG GAATATTACGCTGGTCCTCAGGATCTTTTTTTTT GGTTCGCCCAGGAAGTAAAGTACAAGAGTATAA TCCAGTAACTTTCAAACTATTGATCTGAAGTCAG GTGGGATTACCCGCTGAACTTAAGCATATCAATA AGCGGAGGA
将根霉菌5#的18S rDNA片段在GenBank中进行BLAST比对,发现该根霉菌株与米根霉(Rhizopus oryzae)的同源性为100%,证实该菌为米根霉.
2.4 转化过程分析
米根霉转化左旋乙基甾烯双酮经过 24,h得到两个产物2和3,其高效液相图如图6所示.根据所鉴定的转化产物的液相图可知:液相3个主峰A、B、C分别为产物 2、3和底物 1,出峰时间分别为 3.626、3.972、6.745,min.
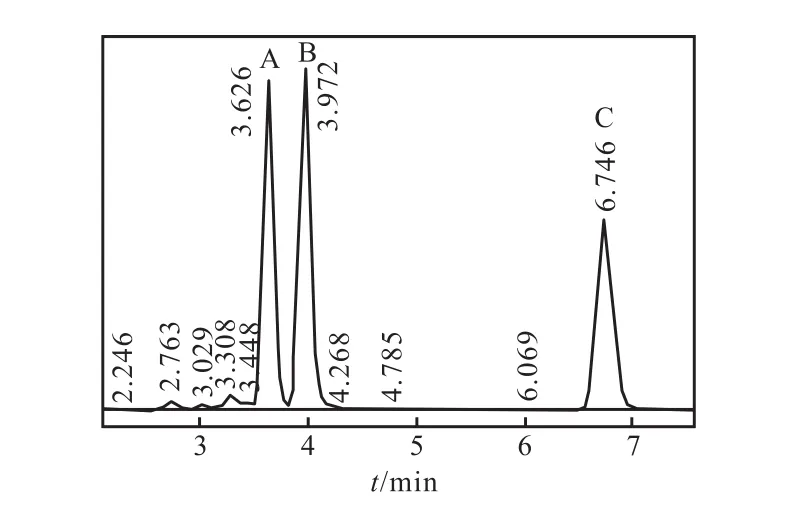
图6 米根霉转化左旋乙基甾烯双酮的高效液相色谱分析Fig. 6 HPLC chromatogram of transformation products of 13,β-ethyl-4-gonene-3,17-dione by R. oryzae
转化过程中的反应物及产物的质量分数见表 1.转化 6,h后发酵液中即可检测到产物 2,其质量分数在12,h后达到了16.2%,经过24,h产率达到32.2%,之后浓度不再增加;产物3在转化经过7,h后开始产生,且产物量一直增加,最终达 35.7%.转化达到24,h以后产物浓度不再随着时间增加.
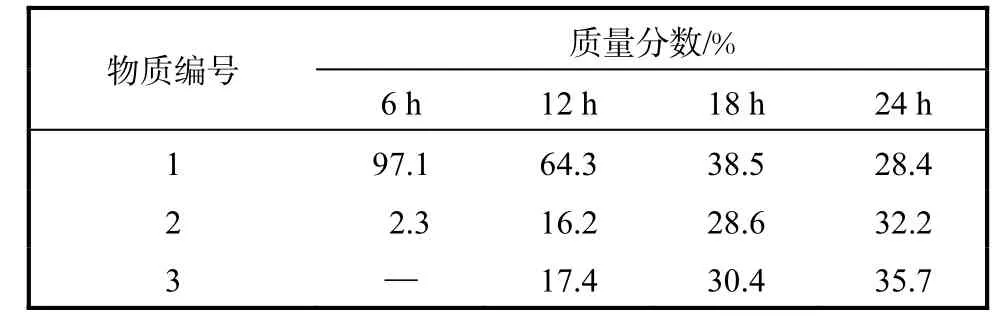
表1 转化过程中的反应物及产物的质量分数Tab. 1 Composition of crude mixtures obtained in transformation by R. oryzae
米根霉对于甾体化合物如17,β-羟基雄甾-4-烯-3-酮[22]及环氧黄体酮[23]等具有 1,β、6,β、7,α、11,α,羟基化能力,本实验所筛选的米根霉对左旋乙基甾烯双酮的转化结果表明具有 6,β、10,β羟基化能力,且所获得的左旋乙基甾烯双酮羟基化产率比周维善等[21]的报道有明显提高.
3 结 语
本实验发现米根霉对左旋乙基甾烯双酮具有特异性的羟基化生物催化活性,所获得的转化产物6,β-羟基-13,β-乙基-4-烯-3,17-二酮和10,β-羟基-13,β-乙基-4-烯-3,17-二酮为甾体药物工业新药的研发提供了一条新途径;但对于 6,β-羟基-13,β-乙基-4-烯-3,17-二酮和 10,β-羟基-13,β-乙基-4-烯-3,17-二酮的药理活性目前尚不清楚,后期将进行相关研究.
[1] Bhatti H N,Khera R A. Biological transformations of steroidal compounds:A review[J]. Steroids,2012,77(12):1267-1290.
[2] 李会,张明杰,张晓梅,等. 三羟基雄甾烯酮高转化菌株的选育及工艺优化[J]. 生物工程学报,2013,29(11):1687-1691.
[3] Zhou H L,Lu WY,Wen J P,et al. Kinetic analysis of 11,α-hydroxylation of steroids by Rhizopus nigricans[J]. Journal of Molecular Catalysis B:Enzymatic,2009,56(2/3):136-141.
[4] 茅燕勇,沈珈琦,范伟平. 葡枝根霉 NG0305酶催化甾体 C11,α-羟基化的研究[J]. 生物加工过程,2004,2(2):46-51.
[5] Martin G D A. Biotransformation reactions by Rhizopus spp.[J]. Current Organic Chemistry,2010,14(1):1-14.
[6] Mao S H,Hua B Y,Wang N,et al. 11,α-hydroxylation of 16,α,17-epoxyprogesterone in biphasic ionic liquid/ water system by Aspergillus ochraceus[J]. Journal of Chemical Technology and Biotechnology,2013,88(2):287-292.
[7] Hunter A C,Carragher N E. Flexibility of the endogenous progesterone lactonisation pathway in Aspergillus tamarii KITA:Transformation of a series of cortical steroid analogues[J]. The Journal of Steroid Biochemistry and Molecular Biology,2003,87(4/5):301-308.
[8] Kołek T,Szpineter A,Świzdor A. Baeyer-Villiger oxidation of DHEA,pregnenolone,and androstenedione by Penicillium lilacinum AM111[J]. Steroids,2008,73(14):1441-1445.
[9] 李骏,耿旭,翁亮,等. Penicillium raistrickii 15,α羟基化左旋乙基甾烯双酮工艺研究[J]. 微生物学通报,2005,32(5):87-91.
[10] Gao J M,Shen J W,Wang J Y,et al. Microbial transformation of 3,β-acetoxypregna-5,16-diene-20-one by Penicillium citrinum[J]. Steroids,2011,76(1/2):43-47.
[11] Bartmańska A,Dmochowska-Gładysz J,Huszcza E. Steroids' transformations in Penicillium notatum culture[J]. Steroids,2005,70(3):193-198.
[12] Faramarzi M A,Aghelnejad M,Tabatabaei Yazdia M,et al. Metabolism of androst-4-en-3,17-dione by the filamentous fungus Neurospora crassa[J]. Steroids,2008,73(1):13-18.
[13] Faramarzi MA,Badiee M,Tabatabaei Yazdia M,et al. Formation of hydroxysteroid derivatives from androst-4-en-3,17-dione by the filamentous fungus Mucor racemosus [J]. Journal of Molecular Catalysis B:Enzymatic,2008,50(1):7-12.
[14] Fernandes P,Cruz A,Angelova B,et al. Microbial conversion of steroid compounds:Recent developments[J]. Enzyme and Microbial Technology,2003,32(6):688-705.
[15] Huang L H,Li J,Xu G,et al. Biotransformation of dehydroepiandrosterone(DHEA)with Penicillium griseopurpureum Smith and Penicillium glabrum (Wehmer) Westling[J]. Steroids,2010,75(13/14):1039-1046.
[16] Yang J,Yang S K,Yang Y L,et al. Microbial hydroxylation of 16,α,17,α-dimethyl-17,β-(l-oxopropyl)androstal,4-dien-3-one to rimexolone by Curvularia lunata AS 3. 4381[J]. Journal of Molecular Catalysis B:Enzymatic,2007,47(3):155-158.
[17] Donova M V,Egorova O V,Nikolayeva V M. Steroid 17,β-reduction by microorganisms:A review [J]. Process Biochemistry,2005,40(7):2253-2262.
[18] Romano A,Romano D,Ragg E,et al. Steroid hydroxylations with Botryodiplodia malorum and Colletotrichum lini[J]. Steroids,2006,71(6):429-434.
[19] Andrushina V A,Druzhinina A V,Yaderets V V,et al. Hydroxylation of steroids by Curvularia lunata mycelium in the presence of methyl-β-cyclodextrine[J]. Applied Biochemistry and Microbiology,2011,47(1):42-48.
[20] Jekkel A,Ilkőy É,Horváth G,et al. Microbial hydroxylation of 13,β-ethyl-4-gonene-3,17-dione[J]. Journal of Molecular Catalysis B:Enzymatic,1998,5(1/2/3/4):385-387.
[21] 周维善,蔡峰,沈季铭. 18-甲基腺甾烯酮一类物的酶催化羟化[J]. 化学学报,2001,59(4):604-609.
[22] Peart P C,Reynolds W F,Reese P B. The facile bioconversion of testosterone by alginate-immobilised filamentous fungi[J]. Journal of Molecular Catalysis B:Enzymatic,2013,95(1):70-81.
[23] Petrič Š,Hakki T,Bernhardt R,et al. Discovery of a steroid 11,α-hydroxylase from Rhizopus oryzae and its biotechnological application[J]. Journal of Biotechnology,2010,150(3):428-437.
转化左旋乙基甾烯双酮的微生物筛选及转化产物研究
李宴清,毛淑红,于 璐,刘晓光,路福平
Screening Strains for 13,β-ethyl-4-gonene-3,17-dione Biotransformation and the Characterization of the Products
LI Yanqing,MAO Shuhong,YU Lu,LIU Xiaoguang,LU Fuping
(Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,College of Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China)
To meet the market demand for steroidal drugs,a filamentous fungus,Rhizopus oryzae with novel 13,β-ethyl-4-gonene-3,17-dione transformation ability was screened from the fresh bark of south China. The biotransformation efficiency of 13,β-ethyl-4-gonene-3,17-dione by this strain was studied. The transformation products were purified,recrystallized and determined ,by the single crystal X-ray diffraction as 6 α-hydroxy-13,β-ethyl-4-gonene-3,17-dione and 10,β-hydroxy-13,βethyl-4-gonene-3,17-dione. The biotransformation process monitored by HPLC revealed that after 24,h fermentation,the products of substrates 13,β-ethyl-4-gonene-3,17-dione,C6,β and C10,β were 28.4%,32.2% and 35.7% respectively.
13,β-ethyl-4-gonene-3,17-dione;Rhizopus oryzae;biotransform
Q93 文献标志码:A 文章编号:1672-6510(2015)02-0016-05
10.13364/j.issn.1672-6510.20140060
2014-04-16;
2014-05-06
国家自然科学基金资助项目(21206127)
李宴清(1987—),女,湖北人,硕士研究生;通信作者:毛淑红,副教授,shuhongmao@tust.edu.cn.
周建军
