体外诱导小鼠骨髓CD45—细胞向窦房结起搏样细胞定向分化
2015-08-06温昱李彬
温昱 李彬

[摘要] 目的 探讨体外诱导小鼠骨髓CD45-细胞向窦房结起搏样细胞定向分化的方法。 方法 免疫磁珠分选小鼠骨髓CD45-细胞,体外培养扩增后,采用添加了5-氮胞苷和小鼠窦房结组织培养上清液的诱导培养基培养,经免疫荧光染色检测起搏样细胞标志物神经丝蛋白-160(NF-160)和超级化激活环核苷酸门控阳离子通道(HCN)4表达,并采用qRT-PCR定量检测起搏基因NF-160、HCN4和HCN2表达。 结果 小鼠骨髓CD45-细胞经体外诱导培养后得到的分化细胞表达NF-160和HCN4;qRT-PCR分析显示,与体外培养的小鼠窦房结细胞比较,分化起搏样细胞NF-160和HCN4的表达升高,HCN2的表达降低。 结论 体外培养能够将小鼠骨髓CD45-细胞诱导分化为窦房结起搏样细胞,为构建生物起搏器种子细胞提供选择。
[关键词] 起搏样细胞;CD45;HCN4;NF-160;窦房结
[中图分类号] R329.2 [文献标识码] A [文章编号] 1673-7210(2015)06(b)-0009-04
Inducing directional differentiation of mouse bone marrow CD45-cells into sinoatrial node pacemaker-like cells in vitro
WEN Yu1 LI Bin2
1.Department of Histology & Embryology, Basic Medical College of China Medical University, Liaoning Province, Shenyang 110122, China; 2.Department of Sports Medicine, Affiliated Shengjing Hospital of China Medical University, Liaoning Province, Shenyang 110022, China
[Abstract] Objective To study method on inducing directional differentiation of mouse bone marrow CD45-cells into sinoatrial node pacemaker-like cells in vitro. Methods Mouse bone marrow CD45-cells were derived by using immunomagnetic beads system. After amplification in vitro, induced medium supplemented with 5-azacytidine and culture supernatant liquid of mouse sinoatrial node cells was used to cultivate. The expression on pacemaker-like cells markers of neurofilament protein (NF-160) and hyperpolarization activated cyclic nucleotide-gated potassium channel (HCN) 4 were detected by immunofluorescence staining. The expression of pacing genes (NF-160, HCN4 and HCN2) were detected by qRT-PCR. Results Differentiated cells of bone marrow CD45-cells after induced by culture in vitro expressed NF-160 and HCN4. qRT-PCR analysis showed, compared with cultured sinoatrial node cells in vitro, the expression of NF-160 and HCN4 were higher, while expression of HCN2 was lower. Conclusion The sinoatrial node pacemaker-like cells can be induced and differentiated from mouse bone marrow CD45-cells, and the cells will be one choice of ideal seeding cells for biological pacemaker building.
[Key words] Pacemaker-like cells; CD45; HCN4; NF-160; Sinoatrial node
心律失常是常见病,严重将危及患者生命。目前,对于严重心律失常、病态窦房结综合征患者,安装心脏起搏器是理想的治疗方法[1-3]。随着生物学及干细胞研究的发展,利用其相关技术逐步构建生物起搏器,对受损心传导系统的组织进行修复或替代,尤其是窦房结功能重建,可以使心脏的起搏和传导功能得以修复[4-5]。构建生物起搏器的种子细胞目前以干细胞为主[6-7]。由于骨髓源干细胞具有多向分化潜能,可自体获得,并能够在体外扩增,是比较理想的种子细胞,所以本研究采用5-氮胞苷联合窦房结细胞培养上清液体外诱导培养骨髓CD45-细胞,探讨其分化为起搏样细胞的可能性。研究周期为2014年8月~2015年1月,旨在为临床因窦房结起搏细胞数量减少或功能衰退造成的心传导系统功能障碍、严重心律失常等疾病的替代治疗以及生物起搏技术的应用奠定实验基础。
1 材料与方法
1.1 实验动物、仪器和试剂
1.1.1 实验动物 选取昆明小鼠10只,雌雄不限,4~5周龄,体重20~30 g,常规饲养,健康。
1.1.2 主要仪器和试剂 低糖DMEM和胎牛血清(fetal bovine serum,FBS)购自Hyclone;DMEM-F12购自Gibco;5-氮胞苷(5-azacytidine)购自Sigma;兔源HCN4一抗、小鼠来源NF-160一抗和TRITC标记山羊抗兔IgG购自Abcam;FITC标记山羊抗小鼠IgG和DAPI购自武汉博士德生物工程有限公司;RNA extraction kit购自Qiagen;PCR引物购自生工生物工程(上海)有限公司;SYBR Green Real Time-PCR Master Mix购自Invitrogen。免疫磁珠分选系统(Miltenyi Biotec),激光共聚焦显微镜(Nikon EZ-C1),PCR仪(Roche Light Cycler?誖480)。
1.2 小鼠骨髓CD45-细胞纯化、扩增
随机取5只小鼠经2.5%戊巴比妥钠腹腔注射麻醉后,70%乙醇浸泡30 min,超净台无菌条件下取出小鼠股骨和胫骨数根,用低糖DMEM反复冲洗髓腔,收集冲洗液,经400目尼龙筛网过滤,1000 r/min离心6 min,弃上清。采用添加了10%FBS的低糖DMEM培养基重新混悬细胞,37℃,5%CO2,饱和湿度培养,1 d后换液,弃去未贴壁细胞,以后每2天换液1次。细胞长至80%融合时,PBS洗涤2次,0.25%胰蛋白酶消化,1000 r/min离心5 min,弃上清,10%FBS的低糖DMEM培养基重新混悬,以1∶3传代。培养大约1个月后,采用免疫磁珠分选系统,选取CD45抗体,按照说明书操作,使细胞通过分选柱,收集CD45-细胞。采用添加了10%FBS的低糖DMEM培养基,37℃、5%CO2、饱和湿度培养。
1.3 小鼠窦房结组织分离、培养,收集培养基上清液
余下5只小鼠经2.5%戊巴比妥钠腹腔注射麻醉后,70%乙醇浸泡30 min,超净台无菌条件下取出心脏,解剖显微镜下将心脏界嵴中部静脉窦侧、前腔静脉根部0.3 cm × 0.3 cm × 0.3 cm大小组织块,剪成1 mm左右大小的碎块,添加0.07%胰蛋白酶消化,经筛网过滤后,1000 r/min离心5 min,加入添加了20%FBS的DMEM-F12培养基,37℃、5%CO2、饱和湿度培养4 h,吸出未贴壁细胞重置于6孔板中,继续培养。每天半量换液。
1.4 条件培养基诱导分化骨髓CD45-细胞
收集窦房结细胞培养后的培养液,经1000 r/min离心10 min,取上清与10%FBS的低糖DMEM培养基1∶1混合,并添加10 mmol/L的5-氮胞苷,作为CD45-细胞的条件培养基。CD45-细胞经条件培养基培养后2~3周,选取生长稳定细胞,进行检测。
1.5 免疫荧光检测分化细胞起搏标志物表达
将生长良好的分化细胞接种至8孔Chamber中,培养过夜,常规免疫荧光染色,一抗兔HCN4(1∶200)、小鼠NF-160(1∶300),二抗TRITC标记山羊抗兔IgG(1∶500),FITC标记山羊抗小鼠(1∶500)。激光共聚焦显微镜下观察,拍照。
1.6 qRT-PCR检测诱导分化细胞起搏基因表达
选择生长良好的分化起搏样细胞和小鼠窦房结细胞作为对照,采用RNA extraction kit提取两种细胞的总RNA,稀释浓度为200 ng/μL,然后逆转录合成cDNA,再采用SYBR Green Real Time-PCR Master Mix方法检测小鼠NF-160、HCN4和HCN2基因表达,选取GAPDH作为内参,引物序列见表1。NF-160、HCN4和HCN2基因表达结果以倍数变化表示。设立对照以确定无DNA污染。反应体系为20 μL,其中cDNA模板1 μL,Nuclease-free water 8.2 μL,NF-160、HCN4、HCN2基因引物序列上游引物和下游引物各0.4 μL,2X SYBR Green Master Mix 10 μL。PCR反应条件:94℃预变性3 min,进行35个循环(94℃ 30 s,52℃ 30 s,72℃ 30 s),然后72℃再延伸10 min,4℃保存。实验重复3次。
表1 SBYR Green法qRT-PCR引物
2 结果
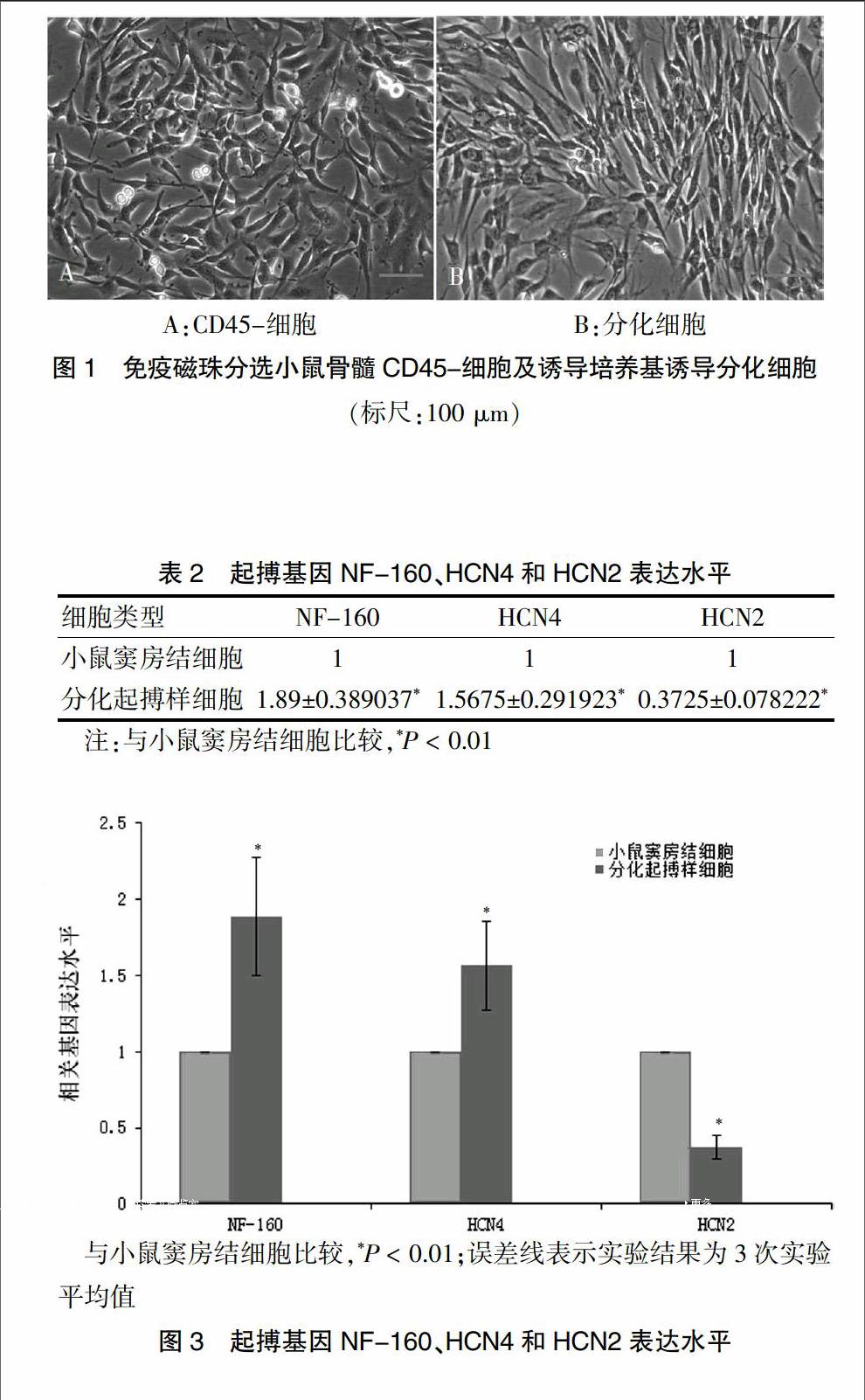
2.1 小鼠骨髓CD45-细胞及诱导培养基诱导分化细胞
CD45-细胞贴壁后多为短梭形、三角形、多边形,排列无规律,细胞体积较小,分散生长(图1A)。生长良好的CD45-细胞更换为条件培养基后,细胞形态发生明显变化,体积变大,大小比较一致,多呈长梭形,向同一方向生长(图1B)。
2.2 分化细胞起搏标志物表达
经免疫荧光染色后,发现绝大多数分化细胞NF-160和起搏离子通道HCN4表达阳性,可见胞质内呈丝状表达的NF-160和HCN4,胞核未着色(图2,见封三)。
2.3 诱导分化起搏样细胞起搏基因qRT-PCR检测
与培养的窦房结细胞比较,分化起搏样细胞NF-160、HCN4、HCN2基因表达水平不同,以倍数形式表示,其中NF-160、HCN4表达水平较培养的窦房结细胞高(P < 0.01),而HCN2表达水平低于培养的窦房结细胞(P < 0.01)。见表2和图3。
表2 起搏基因NF-160、HCN4和HCN2表达水平
注:与小鼠窦房结细胞比较,*P < 0.01
与小鼠窦房结细胞比较,*P < 0.01;误差线表示实验结果为3次实验平均值
图3 起搏基因NF-160、HCN4和HCN2表达水平
3 讨论
20世纪末,Makino等[8]首次以5-氮胞苷诱导培养骨髓间充质干细胞,发现能够体外分化为心肌样细胞,部分细胞的动作电位与心脏起搏细胞相似。随后,大量研究围绕起搏样细胞的诱导分化展开。目前,常用方法有应用5-氮胞苷诱导分化方法[8-9]、起搏离子通道基因转移方法[10-11]和窦房结细胞裂解液诱导分化方法[12]。但是这些体外诱导分化条件仍不完善,单独应用成功率低,所以本实验联合应用5-氮胞苷和窦房结细胞培养上清液,提高诱导效率。
5-氮胞苷诱导分化机制是可引起细胞DNA中某些胞嘧啶的去甲基化,激活表达肌细胞的特异性启动或分化调控基因,从而使启动细胞向心肌分化,并表达心肌细胞特异性标志物,并有一部分细胞具有自律性[8,13]。由于窦房结是一个多态性的结构,心脏成纤维细胞能通过缝隙连接提高心肌细胞间的交通,因而稳定培养心肌的自发性收缩节律。因此,体外培养时不必将窦房结细胞完全分离纯化。窦房结细胞培养液对CD45-细胞的诱导分化作用依赖于窦房结细胞分泌的细胞因子,可以为干细胞向起搏样细胞分化提供一个接近于窦房结细胞生长的环境。
研究表明,窦房结起搏细胞的电生理特性为舒张期自动除极化,起主要作用的是起搏电流,其分子基础是HCN,包括HCN1~HCN4,小鼠心脏主要表达HCN4和HCN2,以窦房结细胞HCN表达水平最高,所以选择HCN4和HCN2作为检测指标[14-17]。
本实验采用全骨髓细胞直接接种,然后经免疫磁珠分选其中的CD45-细胞,换用条件培养基诱导分化的方法,从成年小鼠骨髓源干细胞得到窦房结起搏样细胞。该方法操作简便,得到细胞量大,细胞成活率高,传代后,细胞形态渐趋同一,排列趋同一个方向,光镜下可见胞体呈梭形,胞质淡染,胞核明显,位于胞体中央。笔者采用小鼠窦房结细胞培养基上清液,并添加5-氮胞苷作为条件培养基,得到的起搏样细胞能够表达起搏离子通道HCN4和神经丝蛋白NF-160,由qRT-PCR结果看出,分化细胞表达起搏离子通道,符合起搏细胞特点,说明得到的细胞大部分是起搏样细胞。形态学和免疫组织化学染色研究显示,得到的细胞具有较好的生物学活性,证明诱导分化方法有效,得到起搏样细胞在体外能够存活较长时间,并保持其生物学活性,为生物起搏器奠定实验基础。
目前仍有尚未解决的问题,比如得到的细胞并非全部是起搏样细胞,还包含有其他细胞成分,这些混杂的细胞会对进一步研究带来干扰,因此进一步完善诱导分化条件或增加分化后的筛选指标,利用流式细胞分离技术或免疫磁珠分选,对得到的细胞进行分离提纯,以提高细胞纯度。
[参考文献]
[1] Gittenberger-de Groot AC,Calkoen EE,Poelmann RE,et al. Morphogenesis and molecular considerations on congenital cardiac septal defects [J]. Ann Med,2014,46(8):640-652.
[2] Sah R,Mesirca P,Mason X,et al. Timing of myocardial trpm7 deletion during cardiogenesis variably disrupts adult ventricular function,conduction,and repolarization [J]. Circulation,2013,128(2):101-114.
[3] 马立军,张勤.急诊心律失常中应用体外无创性心脏起搏的作用综合评价[J].中国现代医生,2014,52(9):31-33.
[4] Aanhaanen WT,Mommersteeg MT,Norden J,et al. Developmental origin,growth,and three-dimensional architecture of the atrioventricular conduction axis of the mouse heart [J]. Circ Res,2010,107(6):728-736.
[5] Hashem SI,Claycomb WC. Genetic isolation of stem cell-derived pacemaker-nodal cardiac myocytes [J]. Mol Cell Biochem,2013,383(1-2):161-171.
[6] Ye SX,Qu Y,Dan P,et al. Isolation and characterization of atrioventricular nodal cells from neonate rabbit heart [J]. Circ Arrhythm Electrophysiol,2011,4(6):936-946.
[7] Vincent SD,Buckingham ME. How to make a heart:the origin and regulation of cardiac progenitor cells [J]. Curr Top Dev Biol,2010,90:1-41.
[8] Makino S,Fukuda K,Miyoshi S,et al. Cardiomyocytes can be generated from marrow stromal cells in vitro [J]. J Clin Invest,1999,103(5):697-705.
[9] Pauza DH,Saburkina I,Rysevaite K,et al. Neuroanatomy of the murine cardiac conduction system:a combined stereomicroscopic and fluorescence immunohistochemical study [J]. Auton Neurosci,2013,176(1-2):32-47.
[10] Ou Y,Niu XL,Ren FX. Expression of key ion channels in the rat cardiac conduction system by laser capture microdissection and quantitative real-time PCR [J]. Exp Physiol,2010,95(9):938-945.
[11] Greener ID,Monfredi O,Inada S,et al. Molecular architecture of the human specialised atrioventricular conduction axis [J]. J Mol Cell Cardiol,2011,50(4):642-651.
[12] Pauza DH,Rysevaite K,Inokaitis H,et al. Innervation of sinoatrial nodal cardiomyocytes in mouse. a combined approach using immunofluorescent andelectron microscopy [J]. J Mol Cell Cardiol,2014,75:188-197.
[13] Moretti A,Caron L,Nakano A,et al. Multipotent embryonic isl1+ progenitor cells lead to cardiac,smooth muscle,and endothelial cell diversification [J]. Cell,2006, 127(6):1151-1165.
[14] Sp?覿ter D,Abramczuk MK,Buac K,et al. A HCN4+ cardiomyogenic progenitor derived from the first heart field and human pluripotent stem cells [J]. Nat Cell Biol,2013, 15(9):1098-1106.
[15] Yamamoto M,Dobrzynski H,Tellez J,et al. Extended atrial conduction system characterized by the expression of the HCN4 channel and connexin45 [J]. Cardiovasc Res,2006,72(2):271-281.
[16] Garcia-Frigola C,Shi Y,Evans SM. Expression of the hyperpolarization-activated cyclic nucleotide-gated cation channel HCN4 during mouse heartdevelopment [J]. Gene Expr Patterns,2003,3(6):777-783.
[17] Herrmann S,Layh B,Ludwig A. Novel insights into the distribution of cardiac HCN channels:an expression study in the mouse heart [J]. J Mol Cell Cardiol,2011,51(6):997-1006.
(收稿日期:2015-03-15 本文编辑:李亚聪)
