姬松茸粗多糖对K562细胞增殖、凋亡的影响及其作用机制探讨
2015-08-06林祥伟张苏伟
林祥伟 张苏伟
[摘要] 目的 研究姬松茸粗多糖在K562细胞的增殖、凋亡,以及对转录因子NF-κB的影响,并探究其中的作用机制。 方法 培养K562细胞,再分别将(2、5、10mg/mL)姬松茸粗多糖加入其中作用48h,之后应用流式细胞术、免疫荧光法等方法观察姬松茸粗多糖在K562细胞的增殖、凋亡和对NF-κB活性中的影响。 结果 姬松茸粗多糖对K562细胞增殖有很显著的抑制作用,还可以阻止细胞从G0/G1期到G2/M+S期过渡。经过10mg/mL的姬松茸粗多糖诱导48h后,K562细胞CML细胞的凋亡率65.41%,较对照组显著增加,差异有统计学意义(P<0.01)。而且NF-κB较对照组减少。 结论 姬松茸粗多糖能抑制K562细胞增殖,并且可以诱导其凋亡,其中的作用机制和NF-κB通道的异常激活明显相关,值得进一步的研究。
[关键词] 姬松茸;K562细胞;增殖;凋亡;NF-κB
[中图分类号] R285.5;R733.7 [文献标识码] A [文章编号] 2095-0616(2015)11-25-04
[Abstract] Objective To study the influence of Agaricus blazei on proliferation and apoptosis of cells K562 and transcription NF- κB, and to explore the mechanism. Methods Cells K562 were cultured, then the 2, 5,10mg/mL of Agaricus blazei polysaccharides were respectively added to react for 48 hours, and then the effects of Agaricus blazei on proliferation and apoptosis of cells K562 and activity of NF- κB were observed with the methods such as flow cytometry, immunofluorescence. Results Agaricus blazei significantly inhibited the proliferation of cells K562, and also could prevent the cell transition from phase G0/G1 to phase G2/M+S. After induction by 10mg/mL of Agaricus blazei for 48 hours, apoptosis rate of cells K562 was 65.41%, which was significantly higher than that in control groups, and the differences were statistically significant (P<0.01). However there were fewer factors of NF-κB than the control groups. Conclusion Agaricus blazei can inhibit the proliferation of cells K562, and can induce apoptosis of them, the mechanism of that is obviously related with abnormal activation of channel of factors NF- κB. However, it is worthy of further researches.
[Key words] Agaricus blazei; Cells K562; Proliferation; Apoptosis; NF-κB
目前有报道在人肝癌、前列腺癌、结肠癌等实体瘤中,姬松茸均有抑制增殖作用和促其凋亡作用[1-5]。核因子NF-κB存在于体内多种细胞中,是一组作用较广泛的真核细胞转录因子,它主要参与细胞内信号传递,并调控多种基因的表达。文献资料显示急性髓系白血病(AML)造血干细胞中绝大部分的细胞核因子NF-κB均有异常活化表达现象[6-9]。本实验以慢性粒细胞白血病(CML)细胞株K562作为实验对象,研究姬松茸粗多糖对K562细胞的增殖抑制作用以及其诱导凋亡的作用,并且阐述核因子NF-κB核因子在该过程中所起的作用。
1 材料与方法
1.1 细胞培养
慢性粒细胞白血病细胞株K562先在含10%胎牛血清和100U/L青霉素以及100U/L链霉素的RPMI-1640培养基里悬浮培养。
1.2 实验分组
培养K562细胞的过程中,往其加入ABM粗多糖,并使其终浓度为2、5、10mg/mL。接着再分别培养K562细胞48h,使用不含ABM粗多糖的培养基来培养K562细胞作为其对照组。
1.3 细胞周期检测
K562细胞周期的测定应用流式细胞术来分析。在姬松茸多糖作用48h后的K562细胞以1×10?5个以体积分数为0.7的乙醇固定以后,用PBS洗2次,加入RNA酶30μL,在37℃下水浴30min,最后冰浴终止反应;用PBS洗1次,加入PI染液0.5mL,避光孵育30min后,上机检测,并分析细胞的周期变化。
1.4 细胞凋亡检测
采用流式细胞术检测K562细胞凋亡率并收集姬松茸粗多糖作用过的K562细胞,使其在1500rpm的状态下离心5min,并且将上清液去掉,选择磷酸盐缓冲液(phosphate buffered saline,PBS)慢慢地的进行重悬细胞,然后进行计数,从重悬细胞中提取5~10万数目,同样在1500rpm下离心5min,去掉上清液,加入195μL Annexin V-FITC结合液缓慢地重悬细胞,继续加入5μL Annexin V-FITC并且慢慢地混合均匀,在常温(21~25℃)下,暗处孵育10min。在1500rpm下离心5min,去掉上清液摇晃均匀,放置避光处冰浴。经过流式细胞仪检测,Annexin V-FITC显示为绿色荧光、PI显示为红色荧光。其中正常活细胞Annexin V-FITC(-)PI(-);而凋亡早期细胞Annexin V-FITC(+)PI(-);坏死细胞以及凋亡晚期的细胞Annexin V-FITC(+)PI(+)。
1.5 用EMSA法检测K562细胞的核因子NF-KB的活性
核蛋白的提取:各组浓度的姬松茸粗多糖在作用K562细胞48h以后,收获细胞,使用核蛋白抽提试剂盒来提取细胞核蛋白,用BCA试剂盒进行蛋白的定量,保存在-80℃下备用。提取核蛋白提取物2μL,和γ-P32标记的NF-k寡聚核苷酸探针进行结合,并用聚丙烯胺凝胶电泳来分离NF-kB的探针复合物,接着电泳2h,然后在-70℃自显影72h。NF-kB活性检测的结果应用Bio-Rad公司Gel Doc凝胶成像系统对膜片进行扫描,同时使用GELpro3.0软件对其滞后带灰度进行分析。
1.6 统计学处理
使用SPSS11.5统计包来进行统计分析,计量资料用()表示,多组间比较用方差分析,P<0.05为差异有统计学意义。
2 结果
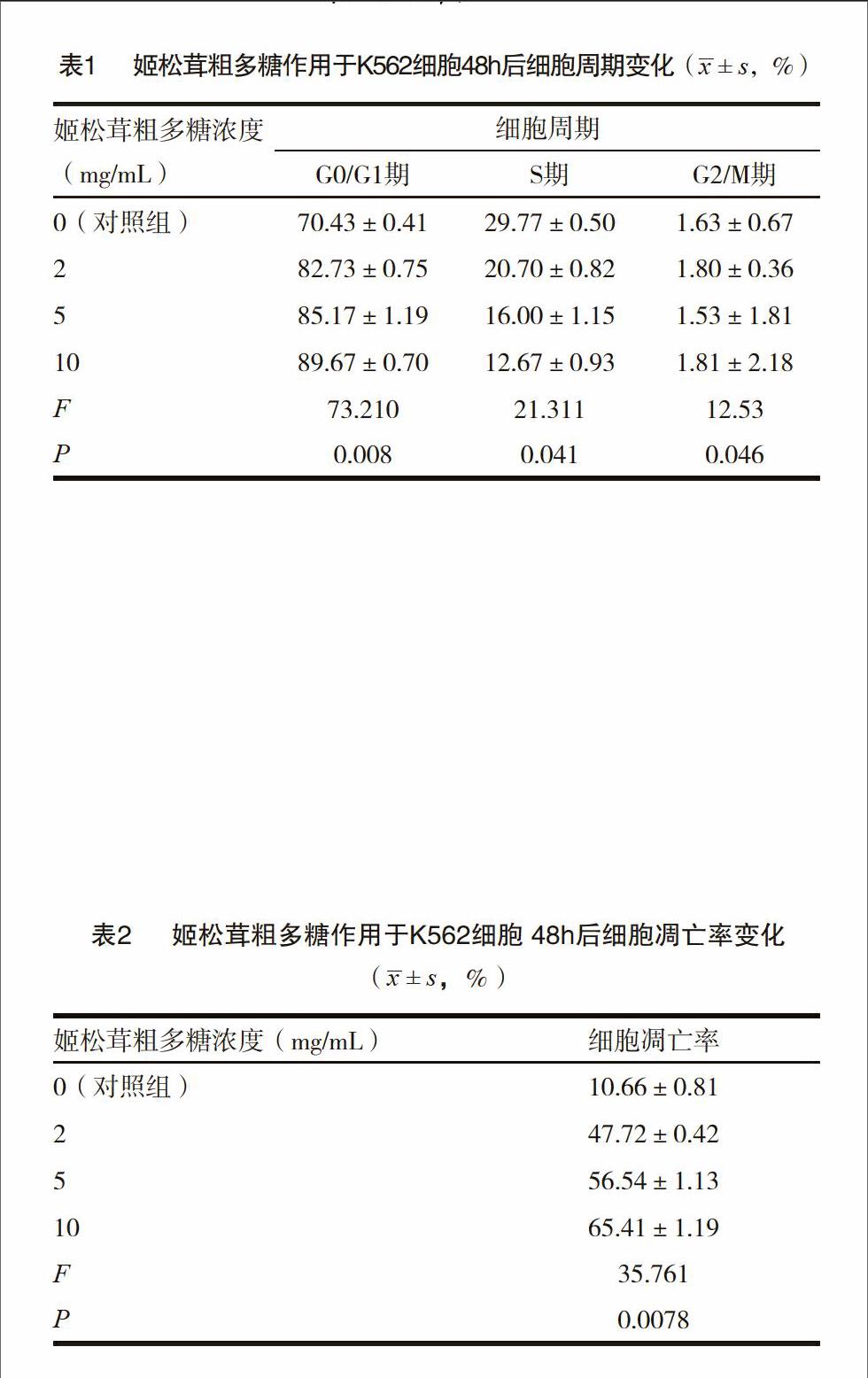
2.1 姬松茸粗多糖对K562细胞周期的影响
结果显示,处于G0/G1期的细胞明显增多,处于S期的细胞减少,而G2/M期的细胞则无明显变化。说明姬松茸粗多糖作用于K562细胞后,可以把细胞周期阻滞于G0/G1期,减少细胞进入S期,从而抑制细胞的增殖。
2.2 姬松茸粗多糖对K562细胞凋亡的影响
K562细胞经2、5、10mg/L的姬松茸粗多糖作用48h后,用流式细胞仪检测细胞凋亡率。结果显示,姬松茸粗多糖可以诱导K562细胞凋亡,且随着浓度增加其作用效果更强,差异有统计学意义(P<0.01)。
2.3 姬松茸粗多糖对K562细胞NF-κB 活性的影响
姬松茸粗多糖作用于K562细胞 48h后对照组细胞NF-κB灰度值为(712.12±24.15);2、5、10mg/mL三组值分别为(419.31±15.11)、(319.91±27.76)、(120.17±11.31),结果显示,K562细胞经过2、5、10mg/L的姬松茸粗多糖作用48h后,能引起NF-kB的DNA结合的活性呈现剂量依赖性地降低,三组较对照组比较F=215.781,差异有统计学意义(P<0.01)。
3 讨论
慢性粒细胞白血病是由于Ph染色体和p210 bcr-abl癌蛋白而导致的恶性造血干细胞疾病,是临床上罕见的一种恶性肿瘤,约占所有癌症的0.29%,接近占成人白血病的21%,在普通人群中的患病率达十万分之一。其主要的特征是细胞过度增长、凋亡受抑以及粘附、迁移功能的异常。此病的发生不受年龄的限制,但以老年群体常见,平均发病年龄为64岁,临床上男性患病的概率大于女性。目前,比较常用的治疗方法就是接受化学疗法,可一旦程度上缓解病情,但是毒副作用太大,受患者身体条件和耐受能力制约,骨髓移植可以治愈白血病,但是合适的配体较难找,移植后的抗排斥也是治疗的难点[10]。
当前国内外研究慢性粒细胞白血病的关注点集中于化疗药物的研究,而中药的抗白血病作用研究较少。尤其是姬松茸诱导肿瘤细胞的分化和促进凋亡,及其作用机制的研究更少。NF-κB是一类具有多向转录调节作用的细胞因子,在肿瘤的发生和发展过程中发挥着重要作用,它激活后参与多种基因的转录调控,且它在白血病等非实体瘤中能随染色体扩增或者易位而发生遗传学上的改变[11]。肿瘤细胞受肿瘤坏死因子刺激作用,引起细胞内激酶活化,导致NF-κB激活[12];NF-κB活化后进入细胞核可以阻止激酶caspase-9的活化,阻断细胞凋亡信号的释放,从而起到抗细胞凋亡的作用。因此,通过抑制NF-κB活性,从而诱导肿瘤细胞的凋亡,可以为肿瘤的治疗提供一个新的思路。
白血病是一种基因疾病,同时也是细胞周期的疾病。细胞周期是细胞存在的基本过程,每个细胞都在细胞周期中分化成熟衰老死亡,周而复始[13]。本实验是通过姬松茸粗多糖作用于K562细胞后,观察到处于G0/G1期的细胞显著增多,而处于S期的细胞减少,G2/M期的细胞却无明显变化。这表明姬松茸粗多糖作用于K562细胞后,能把细胞周期阻滞于G0/G1期,并减少细胞进入S期,最终抑制细胞的增殖。
细胞凋亡对机体维持动态平衡起到很关键的作用。肿瘤细胞就是细胞的凋亡机制失效导致细胞失控无限增殖肿瘤细胞的凋亡紊乱打破了机体的动态平衡,逃离凋亡调控的细胞增殖而不凋亡。因此诱导肿瘤细胞凋亡在当前是临床肿瘤治疗学研究非常热门的课题[14]。细胞凋亡是非常严格的基因调控过程,其主要的形态学改变是核固缩,核碎裂,核溶解,并且不引起周围组织细胞炎症反应[15]。本实验则通过姬松茸粗多糖作用于K562细胞48h后,采用流式细胞仪来检测细胞的凋亡率。而结果显示,姬松茸粗多糖可以诱导K562细胞的凋亡,并且能随着浓度的增加其作用的效果越明显,且差异有显著的统计学意义。
NF-κB作为一种核蛋白因子具有多向转录调节的特异性,它在肿瘤的发生发展中起到非常重要的作用,它的表达可以随着非实体瘤细胞的染色体基因型的改变而发生变化[16]。有些异常的信号分子或癌蛋白能激活NF-κB,活化的NF-κB 被释放进入细胞核,阻止caspase-9的活化从而起到抗凋亡的作用[17];另外NF-κB也通过抑制JNK的活性,促进抗凋亡蛋白的表达,从而起到抑制凋亡的作用;因此通过抑制NF-κB的异常表达活化,有望成为抗白血病治疗的新策略[18-19]。本实验应用EMSA法检测姬松茸粗多糖对K562细胞NF-κB的DNA结合活性,实验结果显示,姬松茸粗多糖作用于K562细胞48h后细胞核内的NF-κB的DNA结合活性显著降低,提示姬松茸粗多糖诱导K562细胞凋亡作用可能与抑制NF-κB的活性有关系。
综上所述,姬松茸粗多糖不仅可以抑制白血病细胞K562的增殖,同时通过抑制NF-kB的活性,来抑制了后者的抗细胞凋亡作用,从而促进了细胞凋亡。目前作为一种新的抗癌药,姬松茸粗多糖已经进入了临床试验,在过去几年中积累的一系列临床数据中姬松茸粗多糖有着非常广谱的抗肿瘤活性,并对各种肿瘤细胞有抑制的作用,但是对正常细胞无明显的作用[12]。这有望能成为新的抗白血病药物,并为治疗白血病提供新的思路。
[参考文献]
[1] Hetland G,Johnson E,Lyberg T,et al.Effects of the medicinal mushroom Agaricus blazei Murill on immunity,infection and cancer[J].Scand J Immunol,2008,68(4):363-370.
[2] Yu L,Yang S,Sun L,et al.Effects of selenium-enriched Agaricus blazei Murill on liver metabolic dysfunction in mice,a comparison with selenium-deficient Agaricus blazei Murill and sodium selenite[J].Biol Trace Elem Res,2014,160(1):79-84.
[3] Li X,Zhao X,Wang H,et al.A polysaccharide from the fruiting bodies of Agaricus blazei Murill induces caspase-dependent apoptosis in human leukemia HL-60 cells[J].Tumour Biol,2014,35(9):8963-8968.
[4] Sokovi M,?iri A,Glamo lija J,et al.Agaricus blazei hot water extract shows anti quorum sensing activity in the nosocomial human pathogen Pseudomonas aeruginosa[J].Molecules,2014,19(4):4189-4199.
[5] Zhang GJ,Chen TB,Bednar B,et al.Optical Imaging of Tumor Cells in Hollow Fibers:Evaluation of the Antitumor Activities of Anticancer Drugs and Target Validation[J].Neoplasia,2007,9(8):652-661.
[6] Grumont RJ,Gerondakis S.Rel induces interferon regulatory factor 4 (IRF-4)expression in lymphocytes:modulation of interferon regulated gene expression by Rel/nuclear factor[kappa]B[J].Exp Med,2000,1919(8):1281-1292.
[7] SilvermanN,Maniatis T.NF-kappaB signaling pathways in mammalian and insect innate immunity[J].Genes Dev,2001,15(18):2321-2342
[8] 蔡应木,张俏忻,肖颖秀,等.姬松茸诱导急性淋巴细胞性白血病细胞凋亡的研究[J].广东医学,2008,29(2):204-206.
[9] Ni WY,Wu MF,Liao NC,et al.Extract of medicinal mushroom Agaricus lazei Murill enhances the non-specific and adaptive immune activities in BALB/c mice[J].In Vivo,2013,27(6):779-786.
[10] Firenzuoli F,Gori L,Lombardo G.The medicinal mushroom agaricus blazei murrill:Review of literature and pharmaco-toxicological problems[J].eCAM,2008,5(1):3-15.
[11] Barbisan LF,Miyamoto M.Influence of aqueous extract of Agaricus blazei on rat liver toxicity induced by different doses of diethylnitrosamine[J].Ethnopharmacology,2002(83):25-32.
[12] Takeshi T,Yoshiyuki K,Hiromichi O,et al.Isolation of an Antitumor Compound from Agaricus blazei Murill and Its Mechanism of Action[J].Nutr,2001,13(5):1409-1413.
[13] Huang M,Ye Y,Chen S,et a1.Use of all-trans retinoic acid in the treatment of acute promyeloeytie leukemia[J].Blood,1988,72(2):567-572.
[14] Ohno R,Asou N,Ohnishi K.Treatment of acute promyeloeytie leukemia strategy toward further increase of cure rate[J].Leukemia,2003,17(8):1454-1463.
[15] Sanz MA,Martin G,Gonzalez M,et a1.Risk-adapted treatment of acute promyelocytie leukemia with all-trans-retinoie acid and anthraeyeline monoehemotherapy:a multicenter study by the PETHEM A group[J].Blood,2004,103(4):1237-1243.
[16] Xu W,Chen J,Lin J,et al.Exogenous H2S protects H9c2 cardiac cells against high glucose-induced injury and inflammation by inhibiting the activation of the NF-κB and IL-1β pathways[J].Int J Mol Med,2015,35(1):177-186.
[17] Chang PJ,Michaeloudes C,Zhu J,et al.Impaired nuclear translocation of the glucocorticoid receptor in corticosteroid-insensitive airway smooth muscle in severe asthma[J].Am J Respir Crit Care Med,2015,191(1):54-62.
[18] Sunakawa Y,Stremitzer S,Cao S,et al.Association of variants in genes encoding for macrophage-related functions with clinical outcome in patients with locoregional gastric cancer[J].Ann Oncol,2015,26(2):332-339.
[19] Zhao X,Hsu KS,Lim JH,et al.α-Actinin 4 potentiates nuclear factor κ-light-chain-enhancer of activated B-cell(NF-κB) activity in podocytes independent of its cytoplasmic actin binding function[J].Biol Chem,2015,290(1):338-349.
(收稿日期:2015-03-23)
