基于氯霉素单克隆抗体的ELISA方法的建立
2015-07-22张立辰生威胡高爽张燕王硕天津科技大学食品工程与生物技术学院教育部食品营养与安全重点实验室天津300457
张立辰,生威,胡高爽,张燕,王硕(天津科技大学食品工程与生物技术学院,教育部食品营养与安全重点实验室,天津300457)
基于氯霉素单克隆抗体的ELISA方法的建立
张立辰,生威,胡高爽,张燕,王硕*
(天津科技大学食品工程与生物技术学院,教育部食品营养与安全重点实验室,天津300457)
摘要:旨在建立一种用于检测海产品中氯霉素残留的ELISA检测方法。利用活化酯法将氯霉素半抗原连接到载体蛋白KLH上,制备氯霉素人工抗原,并免疫小鼠。通过杂交瘤技术筛选出一株能稳定分泌抗体的细胞株10A3B6E,经小鼠体内培养制备腹水并经纯化得到单克隆抗体。单克隆抗体的重链为IgG1,轻链为Kappa。通过对免疫分析方法工作条件的优化,建立了一种简便、快捷、实用的检测氯霉素的直接竞争ELISA方法。该方法IC50值为(0.54±0.04)ng/mL,IC15值为(0.10±0.03)ng/mL。该抗体与氯霉素琥珀酸钠、甲砜霉素、氟甲砜霉素、链霉素的交叉反应率分别为78%、0.09%、0.25%和0.05%,与四环素的交叉反应率低于0.002%,说明该抗体是一种高特异性抗体。利用所建立的直接竞争ELISA方法对鳕鱼和虾样品进行检测,添加回收率在62.6%~120.0%之间,变异系数在0.94%~13.52%之间。本研究所建立的直接竞争ELISA方法具有较好的准确性和灵敏度,可以用来对海产品中的氯霉素残留情况进行检测。
关键词:氯霉素;海产品;兽药残留;单克隆抗体;直接竞争ELISA
氯霉素是由委内瑞拉链霉菌的培养液中提取出来的一种抗生素类药物,现主要用合成法生产[1]。氯霉素类药物具有吸收良好、价格便宜、抑菌性强和体内分布广泛等特点,因而被广泛应用于水产动物疾病防控[2]。但是,氯霉素在养殖业生产中的过量使用会对食用者造成过敏、再生性障碍贫血、机体正常菌群失调和诱发癌症等危害[3]。农业部在2002年发布的第235号公告《动物源性食品中兽药最高残留限量》中明确规定禁止氯霉素在所有可食动物中使用,在所有的可食动物组织中,不得有氯霉素检出。
目前,用于动物源性食品中氯霉素残留的国家标准检测方法是气相色谱-质谱法和液相色谱-质谱-质谱法[4]。除此之外,传统的检测方法还有微生物法[5]、高效液相色谱法[6]、液相色谱电喷雾质谱联用法[7]、毛细管电泳法[8]和免疫检测方法[9-13]等。免疫检测方法具有成本低、检测时间短、易于操作、灵敏度高等优点,因而在实际生产中得到广泛的应用。本研究使用单克隆抗体技术,得到了一种高特异性的单克隆抗体,并利用该抗体建立了一种用于检测海产品中氯霉素残留的直接竞争ELISA方法。
1 材料与方法
1.1免疫动物与细胞株
实验动物为健康雌性BALB/c小鼠:购自北京军事医学科学院。骨髓瘤细胞为SP2/0细胞:教育部食品营养与安全重点实验室保存。
1.2试剂
氯霉素(CAP)标准品:购置于德国Dr.Ehrenstorfer公司;氯霉素琥珀酸钠标准品、N-羟基琥珀酰亚胺(NHS)、N,N-二环己基碳二亚胺(DCC)、钥孔嘁血蓝蛋白(KLH)、辣根过氧化氢酶(HRP)、弗氏完全佐剂、弗氏不完全佐剂:均购置于美国Sigma公司;Free DMEM培养基、胎牛血清(FBS)、HAT、HT、青链霉素双抗:均购置于美国GIBCO公司;单克隆抗体亚型鉴定试剂盒:购置于美国Thermo公司;四氢呋喃:购置于天津市化学试剂六厂;乙酸乙酯:购置于国药集团化学试剂有限公司。
1.3人工抗原的合成
1.3.1氯霉素半抗原与活化酯的合成
1.3.1.1氯霉素琥珀酸的合成
称取氯霉素琥珀酸钠1.1 g,溶于3 mL去离子水中,用1 mol/L HCl调pH到2,可以见到溶液中有大量沉淀生成。收集沉淀,用去离子水洗涤,冻干,即可得到白色粉末状氯霉素琥珀酸。
1.3.1.2氯霉素琥珀酸活化酯的合成
称取上步反应制得的氯霉素琥珀酸423.2 mg、N-羟基琥珀酰亚胺(NHS)126.7 mg溶于20 mL无水四氢呋喃(THF)中,冰浴环境下搅拌0.5 h。将227.0 mg N,N-二环己基碳二亚胺(DCC)溶于5 mL THF溶液,随后加入到上述反应体系中。冰浴下继续搅拌1 h,撤掉冰浴,搅拌过夜。用硅胶柱分离目标产物和其它杂质(展开剂,乙酸乙酯∶石油醚=3∶1)。氯仿—石油醚重结晶,得到白色晶状氯霉素琥珀酸活化酯固体。
1.3.2氯霉素免疫原的制备
将10 mg KLH载体蛋白溶于2 mL PBS中。称取制得的氯霉素活化酯1 mg,用100 μL DMF溶解。在冰浴条件下,将活化酯溶液缓慢加入到蛋白溶液中。4℃反应16 h,反应结束后4℃透析3 d[透析液为0.01 mol/L、pH为7.4的磷酸盐缓冲溶液(PBS)],即可得到氯霉素免疫原,将免疫原置于-20℃下储存。
1.3.3氯霉素酶标抗原的制备
将2mg辣根过氧化物酶(HRP)溶于2mL、50mol/L的磷酸氢二钾溶液中。称取氯霉素活化酯0.2 mg,用50 μL DMF溶解。在冰浴条件下,将活化酯溶液缓慢加入到蛋白溶液中。4℃反应16 h,反应结束后4℃透析3 d,即可得到氯霉素酶标抗原,将酶标抗原与等体积甘油混匀,置于-20℃下储存。
1.4单克隆抗体的制备
1.4.1动物免疫
将制备好的氯霉素免疫原用生理盐水稀释成1 μg/μL的溶液(质量以载体蛋白的量计算),用等量弗氏完全佐剂制成油包水乳浊液。采用腹腔注射法免疫BALB/c小鼠,每只200 μL乳化剂(其中含有100 μg免疫原)。初次免疫后14 d进行第二次免疫,剂量与初免相同,但佐剂换为弗氏不完全佐剂,以后每隔14天免疫1次,所用佐剂都为弗氏不完全佐剂。用间接ELISA法测定小鼠的抗血清效价与特异性,选择抗血清效价高、特异性强的小鼠进行细胞融合实验。在第三次免疫完成后的14 d内进行冲刺免疫,免疫前不需乳化,但免疫原量加倍,冲刺免疫后3 d进行细胞融合。
1.4.2细胞融合与筛选
取出小鼠的脾脏,将小鼠的脾细胞与SP2/0骨髓瘤细胞融合。融合后的细胞加入96孔板中,用含有HAT的培养基培养。用间接ELISA法筛选出能够特异性分泌氯霉素抗体的细胞。用有限稀释法进行克隆化,得到能够稳定分泌氯霉素抗体的杂交瘤细胞株。1.4.3单克隆抗体的大量制备与纯化
选取10周龄大的Balb/c小鼠,将石蜡油注入小鼠腹腔中。7 d后将筛选得到的细胞株接种到小鼠腹腔中制备腹水,收集的腹水4 000 r/min下离心10 min,除去脂肪、纤维和细胞,收集中层的液体,-20℃下储存。腹水采用辛酸-硫酸铵沉淀法纯化。
1.5抗体的亚型鉴定
使用单克隆抗体亚型鉴定试剂盒(Therm,USA)对细胞株所产抗体进行亚型鉴定。
1.6直接竞争ELISA检测方法的操作步骤
将氯霉素单克隆抗体用包被缓冲液稀释,以每孔100 μL(抗体0.01 μg/孔)的体积加入到96孔酶标板中。将酶标板放置于4℃条件下过夜。第二天弃去孔中液体,用PBST清洗板孔3次,拍干;每孔加入200 μL封闭液(0.5%脱脂乳粉),37℃下孵育1 h,弃去孔中液体,洗板3次,拍干;每孔加入50 μL稀释到一定浓度的标准品(或样品)和50 μL的酶标抗原,以加入50 μL PBS和50 μL酶标抗原的孔作为对照,只加入100 μL PBS的孔作为空白,37℃孵育1 h,洗板3次,拍干;每孔加入100 μL显色液,37℃显色15 min后,每孔加入50 μL终止液终止显色反应。在双波长方式(450 nm为检测波长,650 nm为参比波长)下用酶标仪测定各孔的OD值。
1.7样品稀释液离子强度和pH的优化
分别使用0.01、0.03 mol/L和0.05 mol/L的PBS (pH 7.4)作为样品稀释液,建立直接竞争ELISA标准曲线,选择方法IC50值较低,且ODmax值(对照孔的吸光度值)较为适宜的PBS浓度。
在相同离子强度的前提下,分别使用pH为5.7、7.4和8.5的PBS作为样品稀释液,建立直接竞争ELISA标准曲线,选择方法IC50值较低,且ODmax值较为适宜的pH的PBS。
1.8抗体交叉反应性的测定
使用3种氯霉素的结构类似物(氯霉素琥珀酸钠、甲砜霉素、氟甲砜霉素)和两种其它兽药(链霉素、四环素)代替氯霉素用直接竞争ELISA法建立标准曲线,并分别计算其IC50值。交叉反应率计算公式如下:

1.9样品处理
称取2 g均质过的样品(鳕鱼或对虾),加入6 mL乙酸乙酯,震荡1 min,4 729 r/min离心20 min。取3 mL上清液,60℃下氮气吹干。1 mL PBS(0.05 mol/L,pH5.7)复溶残余物,用于ELISA检测。
1.10添加回收率的测定
向鳕鱼、对虾样品中分别添加10、30、100 ng/g的氯霉素,用以上优化好的方法处理样品后,用直接竞争ELISA方法检测样品中氯霉素的含量并计算相应的回收率。
2 结果与讨论
2.1小鼠抗血清效价与特异性测定
经过3次免疫,小鼠体内抗血清的效价都能达到1∶64 000。从中选择抗血清特异性最强的小鼠,进行细胞融合实验。
2.2单克隆抗体细胞筛选
经过细胞融合与筛选,最终得到一株既能稳定分泌氯霉素单克隆抗体、又能无限增殖的杂交瘤细胞10A3B6E。细胞上清液特异性测定对100 ng/mL氯霉素标准品抑制率为91%。
2.3单克隆抗体亚型鉴定
经单克隆抗体亚型鉴定试剂盒鉴定,细胞株10A3B6E所产单克隆抗体重链亚型为IgG1,轻链亚型为Kappa。
2.4标准品稀释液离子强度和pH的优化
分别使用3种不同离子强度的PBS作为稀释液进行标准曲线的建立见表1。

表1 稀释液离子强度的优化Table 1 Optimization of ionic strength of assay buffer
如表1,不同浓度的PBS对ODmax的影响不大,但用0.05 mol/L的PBS建立的标准曲线IC50值最低,因此在后续实验中采用该种PBS。
在0.05 mol/L的浓度下,分别使用3种不同pH的PBS作为稀释液进行标准曲线的建立见表2。

表2 稀释液pH的优化Table 2 Optimization of pH of assay buffer
如表2,不同pH的PBS对ODmax的影响不大,但用pH 5.7的PBS建立的标准曲线IC50值最低,因此在后续实验中采用该种PBS。
2.5氯霉素ELISA方法标准曲线
以氯霉素浓度的对数值作为标准曲线的横坐标,以抑制率作为纵坐标建立标准曲线,如图1所示。
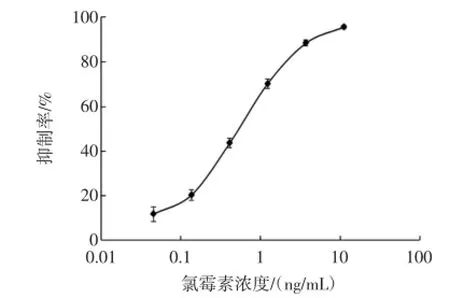
图1 氯霉素直接竞争ELISA标准抑制曲线Fig.1 Standard inhibition curve of ELISA for chloramphenicol
IC50值为(0.54±0.04)ng/mL、IC15值为(0.10±0.03)ng/mL。
2.6抗体交叉反应性
抗体交叉反应的结果如表3所示。
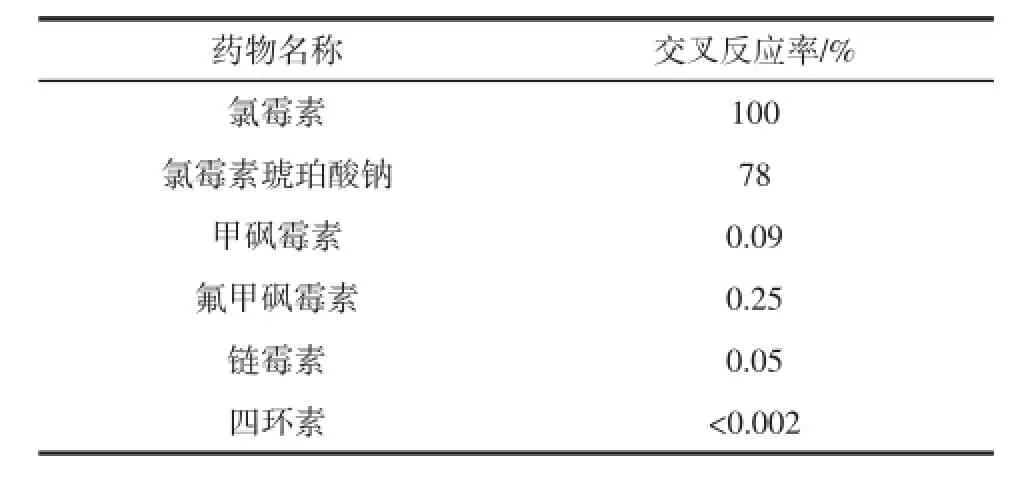
表3 氯霉素抗体与其它兽药的交叉反应Table 3 Cross-reactivity of chloramphenicol monoclonal antibody with other veterinary drugs
该单克隆抗体与氯霉素琥珀酸钠有较大的交叉反应,这是由于半抗原是用氯霉素琥珀酸钠合成的。而抗体与其结构类似物:氟甲砜霉素、甲砜霉素交叉反应较小,与其他常用兽药链霉素、四环素并无交叉反应。说明该单克隆抗体对氯霉素有很好的特异性。
2.7添加回收实验
将3种不同浓度的氯霉素标准品添加到鳕鱼与对虾样品中,进行添加回收实验见表4。

表4 ELISA检测样品中氯霉素含量的回收率Table 4 Recoveries of chloramphenicol in spiked samples by ELISA
如表4所示,添加回收率在62.6%~120%之间,变异系数在0.94%~13.52%之间,方法具有较好的准确性和灵敏度。
3 结论
氯霉素相对分子质量为323.13,是一种小分子物质。本身不具有免疫原性,必须与大分子载体蛋白连接才能在动物体内形成免疫应答。本研究将氯霉素的衍生物氯霉素琥珀酸钠用盐酸酸化形成羧基末端,制备半抗原氯霉素琥珀酸。利用活化酯法将半抗原与载体蛋白KLH偶联制备人工免疫原。免疫原免疫小鼠后,利用杂交瘤技术,制得氯霉素单克隆抗体。使用该单克隆抗体建立的直接竞争ELISA检测方法,IC50值为(0.54±0.04)ng/mL,IC15值为(0.10±0.03)ng/mL。抗体与合成半抗原的原料氯霉素琥珀酸钠有交叉反应,与其余几种常用兽药交叉反应很小,特异性较好。通过对鳕鱼、对虾两种基质的样品检测可以看出,方法有很好的准确性。所建立的直接竞争ELISA方法可以应用于海产品中氯霉素残留的检测。
参考文献:
[1]SANDRA IMPENS,WIM REYBROECK,JAN VERCAMMEN,et al. Screening and confirmation of chloramphenicol in shrimp tissue using ELISA in combination with GC-MS2 and LC-MS2[J].Analytica Chimica Acta,2003,483:153-163
[2]方晓明,丁卓平.动物源食品兽药残留分析[M].北京:化学工业出版,2009:129-130
[3]杨洪波,王荻,卢彤岩.氯霉素类药物的药理学在水产动物中的研究现状[J].水产学杂志,2013,26(4):61-64
[4]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 22338-2008动物源性食品中氯霉素类药物残留量测定[S].北京:中国标准出版社,2008:1
[5]谢恺舟.兽药残留分析方法[J].中国家禽,2001,23(17):5-7
[6]KEUKENS H J,BEEK W M,AERTS M M.High performance liquid chromatographic screening and confirmation methods for chloramphenicol residues in meat with off-line cartridge sample clean-up and on-line diode array UV-VIS detection[J].Journal of Chromatography,1986,352(6):445-453
[7]MOHAMED R,RICHOZ-PAYOT J,GREMAUD E,et al.Advantages of molecularly imprinted polymers LC-ESI-MS/MS for the seleetive extraetion and quantification of chloramphenicol in milk-based matrixes:comparison with a classical sample preparation[J].Anal Chem, 2007,79(24):955-956
[8]LUCIANA VERA-CANDIOTI,ALEJANDRO C OLIVIERI,HECTOR C GOICOECHEA.Development of a novel strategy for preconcentration of antibiotic residues in milk and their quantitation by capillary electrophoresis[J].Talanta,2010,82(1):213-221
[9]NAN LIU,ZHIXIAN GAO,HONGWEI MA,et al.Simultaneous and rapid detection of multiple pesticide and veterinary drug residues by suspension array technology[J].Biosensors and Bioelectronics,2013, 41(5):710-716
[10]NA SAI,YIPING CHEN,NAN LIU,et al.A sensitive immunoassay based on direct hapten coated format and biotin-streptavidin system for the detection of chloramphenicol[J].Talanta,2010,82(4):1113-1121
[11]XIUXIA YU,YI HE,JIE JIANG,et al.A competitive immunoassay for sensitive detection of small molecules chloramphenicol based on luminol functionalized silver nanoprobe[J].Analytica Chimica Acta, 2014,812(2014):236-242
[12]TERENCE L FODEYA,SUJA E GEORGED,IMELDA M TRAYNOR,et al.Approaches for the simultaneous detection of thiamphenicol,florfenicol and florfenicol amine using immunochemical techniques[J].Journal of Immunological Methods,2013,393(1/2):30-37
[13]MEI LING REN,XUE LAN CHEN,CHAO HUI LI.Lateral Flow Immunoassay for Quantitative Detection of Ractopamine in Swine Urine[J].Biomedical and Environmental Sciences,2014,27(2):134-137
DOI:10.3969/j.issn.1005-6521.2015.24.033
收稿日期:2014-07-16
基金项目:“十二五”国家科技支撑计划(2012BAD28B05);天津市科技计划项目(11ZCGHHZ01100)
作者简介:张立辰(1988—),男(汉),硕士,研究方向:食品安全检测。*通信作者:王硕(1969—),教授,博导,研究方向:食品安全和免疫学检测。
Study on An Enzyme Linked Immunosorbent Assay Based on A Monoclonal Antibody for the Detection of Chloramphenicol
ZHANG Li-chen,SHENG Wei,HU Gao-shuang,ZHANG Yan,WANG Shuo*
(Key Laboratory of Food Nutrition and Safety,Ministry of Education of China,The School of Food Engineering and Biological Technology Tianjin University of Science and Technology,Tianjin 300457,China)
Abstract:The aim of this research was to develop an ELISA to detect chloramphenicol in marine products.The chloramphenicol succinate was conjugated to keyhole limpet hemocyanin by activated ester method to prepare the immunogen for immunizing mices.Through a hybridoma cell line,a strain of cells which can produce antichloramphenicol monoclonal antibody was obtained.Ascites was produced by mice vivo culcure and purified to obtain monoclonal antibody.The heavy chain of the antibody was IgG1,and the light chain was Kappa.A direct competitive ELISA using above-mentioned monoclonal antibody was developed for the detection of chloramphenicol by optimizing the working conditions of assay.The IC50value was(0.54±0.04)ng/mL,IC15value was(0.10±0.03)ng/mL.Cross-reactivities with chloramphenicol sodium succinate,thiamphenicol,florfenicol,streptomycin and tetracycline were 78%,0.09%,0.25%,0.05%and<0.002%respectively,which indicated that the assay had high specificity.The recoveries for chloramphenicol from cod and shrimp samples were ranged from 62.6%to 120%and the coefficients of variation were between 0.94%-13.52%.The ELISA allows for a rapid,sensitive,specific,accurate,and low-cost determination of chloramphenicol residues in marine products.
Key words:chloramphenicol;marine products;veterinary drug residues;monoclone antibody;direct competitive ELISA
