利用家蚕杆状病毒表达家蚕肌质网型钙离子ATP酶蛋白
2015-07-19王鑫李懿陈慧芳周小英谢康赵萍
王鑫,李懿,陈慧芳,周小英,谢康,赵萍
利用家蚕杆状病毒表达家蚕肌质网型钙离子ATP酶蛋白
王鑫,李懿,陈慧芳,周小英,谢康,赵萍
家蚕基因组生物学国家重点实验室西南大学,重庆 400716

王鑫, 李懿, 陈慧芳, 等. 利用家蚕杆状病毒表达家蚕肌质网型钙离子ATP酶蛋白. 生物工程学报, 2015, 31(3): 421–430.Wang X, Li Y, Chen HF, et al. Expression of sacro/endoplasmic reticulum Ca2+-ATPase from Bombyx mori by baculovirus expression system. Chin J Biotech, 2015, 31(3): 421–430.
肌质网型钙离子ATP酶 (Sacro/endoplasmic reticulum Ca2+-ATPase, Serca) 负责将细胞中多余的Ca2+转运并存储于内质网中,从而维持细胞内适宜的Ca2+环境。家蚕Serca创造的细胞内及细胞外Ca2+平衡对家蚕正常生命活动的维持具有重要作用。由于Serca分子量较大并具有10次跨膜结构,很难在大肠杆菌表达系统中表达。为了获得具有生物学活性的重组Serca蛋白,利用pFastBac Dual载体构建了用于表达和的双元杆状病毒表达载体,转染细胞后获得重组病毒,将重组病毒感染细胞后,成功地在细胞中表达了EGFP和Serca。通过荧光观察及Western blotting分析表明,感染后细胞中Serca和EGFP表达模式一致,从感染后48 h开始表达,在感染后96 h表达量最大。对获得的重组蛋白进行酶活分析,发现感染后48 h至120 h的细胞Serca酶活显著提高。表明具有生物学活性的Serca在此系统中成功获得表达,为深入研究Serca蛋白的功能奠定了基础。
家蚕,杆状病毒,基因表达,双元表达系统,肌质网型钙离子ATP酶,酶活
钙离子(Ca2+) 是细胞中作用最为广泛的信号之一。在鳞翅目模式昆虫家蚕的生命周期中,钙离子参与了其重要的生长、发育、变态和生殖过程[1-3]。由于过量的Ca2+会引起细胞毒性[4],在细胞中Ca2+的含量受到精确调控。在这个过程中,很多钙离子转运蛋白如肌质网型钙离子ATP酶(Sacro/endoplasmic reticulum Ca2+-ATPase, Serca) 发挥着很重要的作用。
Serca定位于细胞内质网上,利用水解ATP的能量将一个Ca2+转运进内质网中,同时将一个H+由内质网转运到细胞质中[5-7]。目前有研究报道,Serca与昆虫肌肉收缩、心脏节律及抵御冬季寒冷环境相关[8-9]。虽然Serca参与昆虫重要的生命活动,但在家蚕中相关研究却很少。2012年,张松斗等对家蚕肌质网型钙离子ATP酶 (BmSerca) 时空表达特征进行了分析,推测BmSerca可能参与了家蚕PBAN信号转导级联途径中Ca2+的转运[10]。
我们前期分析发现,BmSerca属于典型的P型ATP酶,预测的相对分子量为112.7 kDa,具有10个跨膜结构域。由于其具有如此复杂的结构,BmSerca很难在大肠杆菌中进行表达,这也为其功能的研究制造了很多障碍。昆虫杆状病毒表达载体系统是当今基因工程领域四大表达系统之一,其具有安全性高、易于筛选、具有完备的翻译后加工修饰系统和高效表达外源蛋白的能力[11]。因此,为了获得具有生物学活性的家蚕Serca重组蛋白,本研究采用了家蚕杆状病毒表达系统对家蚕Serca进行了表达。首先,我们克隆了增强型绿色荧光蛋白基因和含有6×His-tag的家蚕基因,将其构建进具有双启动子的pFastBac Dual载体中,获得了重组供体质粒。通过转座作用构建整合表达和的重组杆状病毒颗粒,提取Bacmid后转染家蚕卵巢细胞系BmN-SWU1,通过观察EGFP的表达情况判定细胞中病毒颗粒扩增。收集感染后细胞培养基后,感染细胞。感染后每24 h收集细胞,对细胞总蛋白进行SDS-PAGE检测和Western blotting分析,结果表明重组Serca表达模式与EGFP相同,在感染后48 h的细胞中开始表达。对感染后的细胞匀浆进行酶活分析,发现感染后细胞Serca酶活显著提高。本研究可为家蚕Serca活性形式的获得及进一步阐明其功能奠定坚实的基础。
1 材料与方法
1.1 质粒、菌株、细胞和试剂
供体质粒pFastBac Dual及昆虫细胞培养基TC-100购自Invitrogen公司。用于克隆的菌株Trans1-T1购自北京全式金公司。含有家蚕Bacmid和辅助质粒 (pMON7124) 的DH10Bac宿主菌由家蚕基因组生物学国家重点实验室保存。表达所用细胞系为家蚕基因组生物学国家重点实验室构建并保存的BmN-SWU1细胞系,此细胞系来源于家蚕卵巢。胎牛血清购自PAA公司。转染试剂购自Roche公司。限制性内切酶Ⅰ、ⅠⅠⅠ酶购自宝生物工程有限公司。T4 DNA连接酶购自NEB公司。引物合成及测序由上海生工生物工程公司完成。细菌培养使用的抗生素及测定酶活所用试剂MOPS、蔗糖、PMSF、苯甲脒、蛋白酶抑制剂、EGTA、MgCl2、KCl、CaCl2、磷酸烯醇式丙酮酸、乳糖脱氢酶、丙酮酸激酶、NADH、TritonX-100、叠氮化钠及ATP均购自Sigma公司。
1.2 重组供体质粒的构建
首先利用Primer Premier 5.0软件设计特异性引物 (表1),通过PCR分别从本实验室保存的质粒中扩增得到和含有6×His-tag的片段。对扩增得到的片段和片段利用Ⅰ、Ⅰ及Ⅰ、Ⅰ分别进行双酶切,经过切胶纯化后通过T4 DNA连接酶依次克隆到pFastBac Dual载体上,获得含有[P--HSVtk]和[P--sv40]两个表达框的重组供体质粒 (图1)。
1.3 重组病毒的构建及重组蛋白的表达
病毒载体的构建及重组蛋白Serca的表达过程如图1所示。首先将重组载体转化入DH10Bac感受态细胞,涂布于含有三抗 (50 μg/mL卡那霉素、10 μg/mL四环素、7 μg/mL庆大霉素) 及40 μg/mL IPTG和20 mg/mL X-gal 的LB平板上。37 ℃培养48 h后,挑取白色菌落扩大培养,进行菌液PCR鉴定。将经PCR验证正确的克隆接种于三抗的LB培养基中,培养48 h后提取Bacmid。利用脂质体介导的方法将Bacmid转染BmN-SWU1细胞。感染后72 h收集培养基,为P1代病毒粒子,取250 μL P1代病毒粒子加入细胞中,感染72 h,收集P2代病毒粒子,重复直到获得P3代病毒粒子后,测定病毒滴度 (PFU/mL)。
以PFU及感染复数 (MOI=10) 计算表达所需病毒粒子含量,将适量病毒感染细胞,感染后每24 h通过荧光显微镜进行荧光观察。

表1 本研究所用引物
Underlined letters indicate restriction enzyme digestion sites; the dashed line represents the sequence of 6×His-tag.
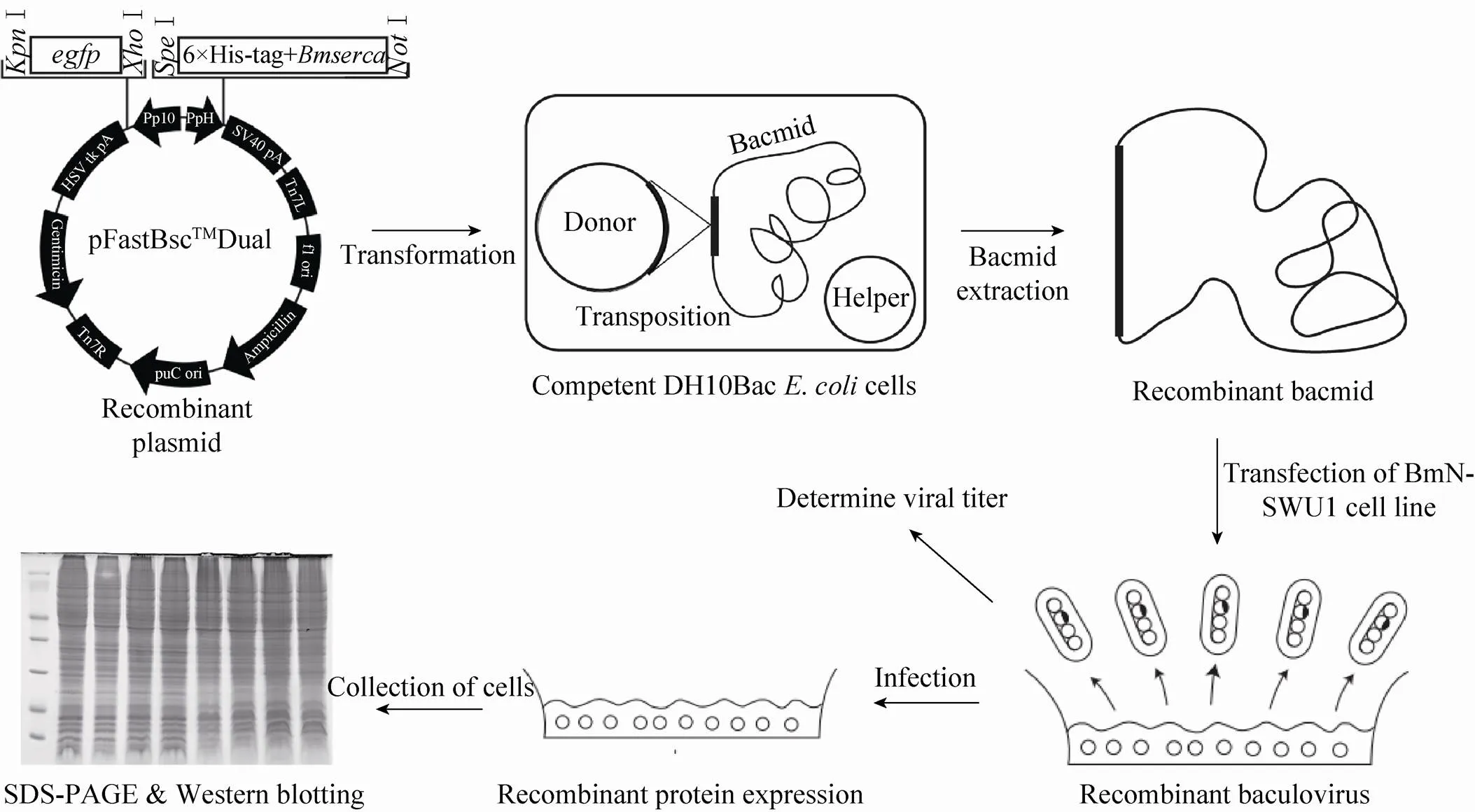
图1 家蚕杆状病毒表达系统表达外源蛋白流程图
1.4 SDS-PAGE及Western blotting分析
感染后每24 h收集细胞,利用Buffer A (20 mmol/L MOPS、0.25 mol/L蔗糖、100 μg/mL苯甲脒、0.23 mmol/L PMSF及1倍的蛋白酶抑制剂,pH 7.0) 重悬细胞后用玻璃小研棒将细胞充分裂解。5 000 r/min、4 ℃离心10 min后取上清,利用BCA蛋白定量法对总蛋白进行定量。取5 μg蛋白进行SDS-PAGE,电泳结束后利用考马斯亮蓝对胶块进行染色。
设计引物时,我们在Serca的N端添加了6×His的序列标签,因此可以利用Western blotting对重组蛋白的表达情况进行分析。SDS-PAGE后将蛋白通过半干转的方法转移到PVDF膜上,以抗6×His-tag单克隆抗体 (钟鼎生物) 作为一抗,HRP标记的山羊抗小鼠IgG (碧云天) 为二抗杂交后利用ECL显色液进行显色反应。另外,选取β-Actin作为内参。
1.5 重组蛋白的酶活测定
Serca酶活测定方法参考Saborido等[12]的方法,首先以细胞中β-Actin对酶活实验的蛋白质量进行均一化。将含有相同β-Actin蛋白量的匀浆液加入到标准酶活测定溶液 (25 mmol/L MOPS、0.2 mmol/L EGTA、5 mmol/L MgCl2、100 mmol/L KCl、1 mmol/L CaCl2、5 mmol/L叠氮化钠、 0.6 mmol/L磷酸烯醇式丙酮酸、2.4 U/mL丙酮酸激酶、10 U/mL乳酸脱氢酶、0.27 mmol/L NADH)中。制备两管平行实验体系,其中一管中额外加入20 mmol/L CaCl2、10 mmol/L 叠氮化钠和0.005% Triton X-100。然后将含有细胞匀浆的溶液于37 ℃孵育5 min。再向其中加入ATP使其终浓度达到4 mmol/L以起始反应。3 min后,每隔 20 s测定溶液340 nm处吸光度值,拟合曲线后计算斜率差,以消光系数ε=6.22 (mmol/L·cm)–1计算酶活。酶活单位定义为每分钟1 g组织匀浆水解的ATP的物质的量 (μmol/(min·g))。
2 结果与分析
2.1 重组供体质粒的构建
为了利用杆状病毒表达系统表达家蚕Serca,我们首先克隆了和的DNA片段,经过测序验证正确后,将其依次克隆到pFastBac Dual载体上。双酶切结果表明,和成功连接到了供体质粒上 (图2)。说明我们成功获得了含有两个表达框[P--HSVtk]和[P--sv40]的重组供体质粒。
2.2 重组Bacmid的获得
将获得的重组质粒转化入DH10Bac感受态细胞后,在辅助质粒表达的转座酶的作用下,含有目的基因的片段通过转座作用插入家蚕Bacmid中。通过蓝白斑筛选与菌液PCR鉴定,我们成功获得了含有目的片段的重组Bacmid。

图2 重组质粒的双酶切检测
2.3 用于表达的重组病毒的获取
利用含有目的片段的Bacmid转染细胞后,获得了P1代重组病毒,通过重复感染,扩增出P3代病毒。通过测定P3代病毒的滴度为1.2×108。
2.4 感染后细胞的荧光显微观察
通过滴度计算所需的病毒量,将其感染细胞后,每隔24 h对细胞进行荧光显微观察,结果如图3所示。在感染后24 h,荧光观察视野下,只有很少的细胞发出绿色荧光,表明此时只有少量细胞开始表达EGFP。随着感染时间的延长,大量细胞开始发出绿色荧光。在感染后48 h,约50%的细胞发出绿色荧光。感染后72 h,表达EGFP的细胞达到约80%。而在感染后96 h和120 h,由于病毒的大量繁殖导致细胞状态异常甚至死亡,很多细胞不能贴壁,漂浮在培养基中。这些结果表明,EGFP在感染后的细胞中成功表达,并在感染后72−120 h表达量较大。
2.5 Serca蛋白的表达和检测
用于表达Serca的启动子和用于表达EGFP的启动子均为晚期启动子,为此,通过荧光观察,不仅可以判断病毒感染细胞的全过程,也可以从侧面监测重组蛋白的表达情况。因此,我们猜测Serca在细胞中的表达模式可能与EGFP相似。
将野生型病毒感染的细胞及重组病毒感染后24 h、48 h、72 h、96 h和120h的细胞通过离心的方法收集,充分裂解后离心提取上清。首先将蛋白样品进行SDS-PAGE检测,发现感染后的细胞总蛋白与未感染的细胞总蛋白模式上并无太大差异 (图4)。由于细胞内蛋白比较丰富,目的蛋白的表达量较低,因此从胶块上并不能明显地看出EGFP和Serca的表达。

图3 细胞感染后的荧光观察图
在我们前期的实验中发现,BmNs-SWU1细胞中含有本底表达的Serca,若直接用Serca的抗体进行Western botting检测,重组Serca的表达情况不够明确,故在设计引物时,我们在片段的5′端添加了6×His-tag标签,因此,可以利用His抗体对目的蛋白进行检测。Western blotting结果显示,感染后48 h、72 h、96 h和120 h的细胞总蛋白中在约110 kDa处均检测到了明显的单一条带 (图4),分子量大小与预测的Serca的大小相一致,说明家蚕Serca在感染后的细胞中成功地得到了表达。
利用β-Actin蛋白作为内参蛋白,我们可以对不同时期表达的Serca蛋白进行粗略的定量分析。通过灰度比较,发现家蚕Serca在感染后48 h之前开始表达,并且随着感染时间的延长,其表达量逐渐增加,在96 h的表达量最大。这一表达模式与EGFP的表达模式相似。另外,在感染后120 h的细胞中,重组Serca的含量却开始下降,这可能与细胞在感染的后期裂解死亡相关。以上的结果说明,我们利用这一双元表达系统成功地表达了家蚕Serca蛋白。

图4 重组蛋白的表达检测
2.6 重组蛋白的酶活分析
参考Saborido等[12]的方法,我们首先利用小鼠肌肉组织匀浆作为阳性对照 (CT),建立酶活测定体系。对小鼠肌肉匀浆进行酶活分析后,测得其Serca酶活为40.26 μmol/(min·g) (图5),所得数值与Saborido等测得的酶活相似[12],说明本酶活测定体系可以为后续研究所使用。
利用这一酶活测定体系,我们对感染后不同时期的细胞进行了裂解,抽提总蛋白并测定其Serca酶活,以野生型病毒感染的细胞作为阴性对照 (WT)。酶活测定结果如图5所示,感染后24 h细胞内酶活与阴性对照相比,酶活差异不大,为0.04 μmol/(min·g)。感染后48 h,由于细胞开始表达Serca重组蛋白,细胞的酶活显著提高。随着感染时间的延长,细胞内重组蛋白增多,Serca的酶活也增大,到感染后96 h,细胞内的Serca酶活达到最大,为0.33 μmol/(min·g),从另一方面说明此时细胞内重组蛋白的表达量最高。而在感染后120 h,细胞内Serca的酶活开始下降,这可能是由于感染后120 h细胞中重组蛋白量减少导致的。这一结果表明,我们利用家蚕杆状病毒表达系统成功地表达了具有生物学活性的重组Serca蛋白,并且在感染后96 h,表达的重组蛋白量最大,酶活最高。

图5 重组蛋白的酶活分析
3 讨论
作为一种高效表达外源蛋白的真核生物表达系统,杆状病毒表达系统可以在不用筛选的情况下短时间内获得100%纯度的重组病毒,通过病毒感染昆虫细胞系或者昆虫幼虫从而快速获得大量的基因表达产物[11],目前已经利用此系统成功地表达了上千种功能蛋白[13-15]。
杆状病毒表达系统的另外一个优势在于可以容纳表达较大及结构较为复杂的外源蛋白。利用多元表达载体还可同时表达两个或者多个外源基因。因此,杆状病毒表达系统成为了细胞内研究P型ATP酶功能的首选系统。近年,研究者利用杆状病毒表达系统获得了具有生物学活性的钠钾ATP酶各亚单位,并对其αβ复合体的结构、功能、装配、运输及亚单位进行了功能研究[16-18]。另外,2002年,有研究者利用杆状病毒表达系统对P型ATP酶家族的另一成员人类铜转运ATP酶进行了表达及功能特征进行了很好的研究,结果证实了哺乳动物铜转运ATP酶具有P型ATP酶家族成员的催化活性[19]。以上结果均说明杆状病毒表达系统十分适宜表达分子量较大,具有多次跨膜结构的复杂蛋白。Serca与钠钾ATP酶同属于P型ATP酶,为此,本研究利用家蚕杆状病毒表达系统对家蚕进行了表达,获得了具有生物学活性的重组蛋白。本研究发现,在细胞感染后48 h,重组蛋白开始表达,在感染后96 h表达量最大。而进一步,在细胞感染后120 h,重组蛋白的含量却降低了,推测这可能与细胞在感染的后期裂解死亡相关。在NPV感染细胞的极晚期,NPV病毒会利用细胞表达组织蛋白酶、几丁质酶等一系列的酶使细胞裂解[20]。在本实验中,可能由于感染后120 h细胞裂解,重组蛋白被释放到培养基中并快速被各种蛋白酶降解,从而导致在此时期重组蛋白的含量降低。另外,本研究中目的蛋白在此系统中的表达水平较低,只能采用Western blotting才能检测到目的蛋白,其可能原因在于,首先Serca作为10次跨内质网膜的复杂蛋白,可能使得细胞表达时重组蛋白的折叠受到压力,导致表达量较低。其次,本研究未有对感染条件进行摸索,而是直接采用感染复数MOI为10的病毒感染细胞。2011年有研究者对PRG-1蛋白在家蚕杆状病毒表达系统中的表达进行摸索后发现,利用不同感染复数的重组感染细胞后,重组蛋白的表达量差异较大[21]。因此,若要获得表达量较大的重组蛋白可能还需要对感染的条件进行摸索。
2014年,李国辉等[22]创建了可视化的家蚕杆状病毒表达系统,利用启动子控制基因表达,成功地利用EGFP作为标签,进而可以迅速判定病毒粒子的产生情况。本研究采用类似的方法,利用双元表达载体,引入基因作为标记基因,成功地构建了同时表达EGFP和Serca的重组病毒。本双元载体采用的启动子分别为和多角体基因 () 启动子,均为BmNPV来源的晚期启动子[20,23]。P10蛋白比多角体蛋白的表达早几个小时[24]。由于所使用的启动子均在病毒感染的同一时期表达,因此本研究中也可以通过观察启动子驱动的的表达情况来判断病毒繁殖的情况。另外,本研究发现,在感染后的细胞中,EGFP和Serca的表达模式一致,因此本研究构建的双元杆状病毒表达系统还可利用EGFP的表达来监测目的蛋白的表达情况。
本研究成功构建了含有两个表达框[P--HSVtk]和[P--sv40]的重组供体质粒,利用此双元表达载体在家蚕BmN-SWU1细胞系中成功地表达了具有生物学活性的家蚕肌质网型钙离子ATP酶Serca。同时,本研究对重组Serca蛋白的酶活性进行了初步分析,这对于进一步研究Serca的具体功能奠定了坚实的基础,也对杆状病毒表达系统的优化和应用研究具有十分重要的意义。
[1] Birkenbeil H, Dedos SG. Ca2+as second messenger in PTTH-stimulated prothoracic glands of the silkworm,. Insect Biochem Mol Biol, 2002, 32(12): 1625–1634.
[2] Hull JJ, Lee JM, Kajigaya R, et al.homologs of STIM1 and Orai1 are essential components of the signal transduction cascade that regulates sex pheromone production. J Biol Chem, 2009, 284(45): 31200–31213.
[3] Ohnishi A, Hull JJ, Kaji M, et al. Hormone signaling linked to silkmoth sex pheromone biosynthesis involves Ca2+/calmodulin-dependent protein kinase II-mediated phosphorylation of the insect PAT family proteinlipid storage droplet protein-1 (BmLsd1). J Biol Chem, 2011, 286(27): 24101–24112.
[4] Carafoli E, Santella L, Branca D, et al. Generation, control, and processing of cellular calcium signals. Crit Rev Biochem Mol Biol, 2001, 36(2): 107–260.
[5] Bublitz M, Musgaard M, Poulsen H, et al. Ion pathways in the sarcoplasmic reticulum Ca2+-ATPase. J Biol Chem, 2013, 288(15): 10759–10765.
[6] Cahalan MD, Zhang SL, Yeromin AV, et al. Molecular basis of the CRAC channel. Cell Calcium, 2007, 42(2): 133–144.
[7] Lukyanenko V, Gyorke I, Wiesner TF, et al. Potentiation of Ca2+release by cADP-ribose in the heart is mediated by enhanced SR Ca2+uptake into the sarcoplasmic reticulum. Circ Res, 2001, 89(7): 614–622.
[8] Abraham DM, Wolf MJ. Disruption of sarcoendoplasmic reticulum calcium ATPase function inleads to cardiac dysfunction. PLoS ONE, 2013, 8(10): e77785.
[9] McMullen DC, Ramnanan CJ, Storey KB. In cold-hardy insects, seasonal, temperature, and reversible phosphorylation controls regulate sarco/endoplasmic reticulum Ca2+-ATPase (SERCA). Physiol Biochem Zool, 2010, 83(4): 677–686.
[10] Zhang SD, Chen LJ, An SH, et al. Molecular identification of sacro/endoplasmic reticulum Ca2+-ATPase gene involved in PBAN-stimulated pheromone production in. J Henan Agric Univ, 2012, 46(5): 577–583 (in Chinese).张松斗, 陈丽君, 安世恒, 等. 家蚕性信息素腺体肌质网膜 Ca2+-ATP酶基因的分子鉴定. 河南农业大学学报, 2012, 46(5): 577–583.
[11] Cao CP. Development of a novel BmNPV expression vector system using silkworm as bioreactor and the application [D]. Hangzhou: Zhejiang University, 2007 (in Chinese).曹翠平. 家蚕新型高效杆状病毒表达系统的开发和应用研究[D]. 杭州: 浙江大学, 2007.
[12] Saborido A, Delgado J, Megias A. Measurement of sarcoplasmic reticulum Ca2+-ATPase activity and E-type Mg2+-ATPase activity in rat heart homogenates. Anal Biochem, 1999, 268(1): 79–88.
[13] Bae JE, Toth TE. Cloning and kinetics of expression of Brucella abortus heat shock proteins by baculovirus recombinants. Vet Microbiol, 2000, 75(2): 199–204.
[14] Chen W, Fu F, Tang SM, et al. Expression of human leptin inusing Bac-to-Bac baculovirus system. Acta Sericol Sin, 2011, 37(2): 325–329 (in Chinese).陈蔚, 付凡, 唐顺明, 等. 利用Bac-to-Bac杆状病毒表达系统在家蚕中表达人瘦素蛋白. 蚕业科学, 2011, 37(2): 325–329.
[15] Bai LH, Hou SH, Jia H, et al. Bac to Bac expression and antigenicity identification ofgene of ASFV. Chin Anim Husb Vet Med, 2012, 39(3): 19–23 (in Chinese).柏丽华, 侯绍华, 贾红, 等. 非洲猪瘟P72基因在Bac to Bac系统中表达及抗原性鉴定. 中国畜牧兽医, 2012, 39(3): 19–23.
[16] Detomaso AW, Xie ZJ, Liu G, et al. Expression, targeting, and assembly of functional Na, K-ATPase polypeptides in baculovirus-infected insect cells. J Biol Chem, 1993, 268 (2): 1470–1478.
[17] Laughery MD, Todd ML, Kaplan JH. Mutational analysis of α-β subunit interactions in the delivery of Na, K-ATPase heterodimers to the plasmamembrane. J Biol Chem, 2003, 278 (37): 34794–34803.
[18] Laughery MD, Todd ML, Kaplan JH. Oligomerization of the Na, K-ATPase in cell membranes. J Biol Chem, 2004, 279 (35): 36339–36348.
[19] Tsivkovskii R, Eisses JF, Kaplan JH, et al. Functional properties of copper-transporting ATPase ATP7B (the wilson’s disease protein) expressed in insect cells. J Biol Chem, 2002, 277 (2): 976–983.
[20] Xue J, Qiao N, Zhang W, et al. Dynamic interactions betweennucleopolyhedrovirus and its host cells revealed by transcriptome analysis. J Virol, 2012, 86(13): 7345–7359.
[21] Hao BF, Shen XJ, Wang M, et al. Soluble expression of PRG-1 in BmN cells usingnucleopolyhedrovirus Bac-to-Bac expression system. Acta Sericol Sin, 2011, 37(5): 0832–0836 (in Chinese).郝碧芳, 沈兴家, 王猛, 等. 利用家蚕核型多角体病毒Bac-to-Bac表达系统在BmN细胞中可溶性表达PRG-1蛋白. 蚕业科学, 2011, 37(5): 0832–0836.
[22] Li GH, Wang P, Li MM, et al. Expression of ns1 gene frombidensovirus by a novel baculovirus expression system. Chin J Biotech, 2014, 30(4): 625−635 (in Chinese).李国辉, 王鹏, 李芒芒, 等. 创建可视化的家蚕杆状病毒表达系统表达家蚕二分浓核病毒非结构蛋白 NS1. 生物工程学报, 2014, 30(4): 625−635.
[23] Vlak JM, Klinkenberg FA, Zaal KJM, et al. Functional studies on the p10 gene ofnuclear polyhedrosis virus using a recombinant expressing a p10-galactosidase fusion gene. J Gen Virol, 1988, 69(4): 765–777.
[24] Roelvink PW, vanMeer MMM, deKort CAD, et al. Dissimilar expression ofmulticapsid nuclear polyhedrosis virus polyhedron and p10 genes. J Gen Virol, 1992, 73(6): 1481–1489.
(本文责编 陈宏宇)
Expression of sacro/endoplasmic reticulum Ca2+-ATPase fromby baculovirus expression system
Xin Wang, Yi Li, Huifang Chen, Xiaoying Zhou, Kang Xie, and Ping Zhao
State Key Laboratory of Silkworm Genome Biology, Southwest University, Chongqing 400716, China
Sacro/endoplasmic reticulum Ca2+-ATPase (Serca) is responsible for transporting Ca2+into the endoplasmic reticulum and maintaining a suitable calcium environment in cells. The suitable calcium environment created by BmSerca is vital for the growth and development of silkworm. With a large molecular weight and 10 transmembrane domains, Serca is very difficult to express inexpression system. In order to obtain recombinant Serca with biological activity, pFastBac Dual vector was used to construct a binary baculovirus expression vector for expressingandin cells. After transfection and infection, EGFP and Serca were expressed successfully in BmN-SWU1 cell line. Fluorescent observation revealed that the expression patterns of EGFP and Serca in infected cells were the same. Western blotting analysis showed that the recombinant proteins were about to express in cells 48 h post infection and highly expressed 96 h post infection. Ca2+-ATPase activities assays were used to evaluate the enzyme activities of recombinant Serca and found that the enzyme activities increased significantly after infection. The obtained data showed that this binary baculovirus expression system can be successfully used to express Serca with biological activity. The expression of Serca protein with this system is useful for further research on the function of Serca.
silkworm, baculovirus, gene expression, binary expression system, sacro/endoplasmic reticulum Ca2+-ATPase, enzyme activity
June 26, 2014; Accepted:August 15, 2014
Ping Zhao. Tel: +86-23-68250885; E-mail: zhaop@swu.edu.cn
Supported by: National High Technology Research and Development Program of China (863 Program) (No. 2011AA100306), National Natural Science Foundation of China (Nos. 31201853, 31172157).
国家高技术研究发展计划(863计划) (No. 2011AA100306),国家自然科学基金(Nos. 31201853, 31172157) 资助。
2014-09-23
http://www.cnki.net/kcms/doi/10.13345/j.cjb.140347.html
