携带HIV-1抗原的单纯疱疹病毒载体疫苗的构建及鉴定
2015-07-19赵晓飞郭景霞刘晓娟马正海
赵晓飞,郭景霞,刘晓娟,马正海
携带HIV-1抗原的单纯疱疹病毒载体疫苗的构建及鉴定
赵晓飞,郭景霞,刘晓娟,马正海
新疆大学生命科学与技术学院,新疆乌鲁木齐 830046

赵晓飞, 郭景霞, 刘晓娟, 等. 携带HIV-1抗原的单纯疱疹病毒载体疫苗的构建及鉴定. 生物工程学报, 2015, 31(3): 384–393.Zhao XF, Guo JX, Liu XJ, et al. Construction and identification of HSV-1 vector vaccine carrying HIV-1 antigen. Chin J Biotech, 2015, 31(3): 384–393.
利用细菌人工染色体技术将串联的HIV-1160、和基因以及表达元件插入1型单纯疱疹病毒 (Herpes simplex virus type 1, HSV-1) 内部反向重复序列区,以获得携带HIV-1抗原的单纯疱疹病毒载体疫苗。首先将HIV-1160 (B型和C型)、和基因串联克隆入pcDNA3获得重组质粒pcDNAB和pcDNA/C,重组质粒转染293FT细胞,Western blotting检测HIV抗原表达。继而将pcDNAB和pcDNA/C中包括HIV-1抗原基因和表达元件的表达框克隆入pKO5/BN获得重组穿梭质粒pKO5/BN/B和pKO5/BN/C,穿梭质粒电转含BAC-HSV的大肠杆菌,筛选重组菌,提取重组DNA并转染Vero细胞,挑取病毒蚀斑纯化重组病毒,Southern blotting鉴定重组病毒DNA,Western blotting检测重组病毒感染细胞中HIV抗原表达,并分析病毒的增殖特性。结果表明,Western blotting在pcDNA/B和pcDNA/C转染的293FT细胞中检测到表达的gp160和gag蛋白。pKO5/BN/B和pKO5/BN/C分别电转获得重组菌,并从重组DNA转染的Vero细胞中纯化获得重组HSV,Southern blotting 检测表明重组HSV基因组发生特异性重组,重组病毒感染细胞中检测到gp120和gp41,且重组HSV保留了在哺乳动物细胞中的复制能力。本研究获得携载HIV-1160、和基因的重组HSV,并保留了在哺乳动物细胞中的复制能力,可作为HIV-1复制型病毒载体疫苗。
1型单纯疱疹病毒,HIV-1抗原,病毒载体疫苗,细菌人工染色体
人类免疫缺陷病毒 (Human immune deficiency virus, HIV) 感染机体后主要侵犯 CD4+ T 细胞,导致机体免疫缺陷并继发各种机会性感染和肿瘤。自首例艾滋病报道以来,全球科学家一直致力于艾滋病疫苗的研制[1]。针对HIV这类高度变异、攻击免疫系统且能引起持续感染和产生免疫病理反应的病毒而言,研制能有效诱导机体全面免疫反应的疫苗尤为重要。目前,HIV病毒样颗粒疫苗、亚单位疫苗、合成多肽疫苗、DNA疫苗、细菌活载体疫苗和病毒载体疫苗均见报道,上述疫苗在非人类灵长类动物模型中均可引起不同程度的免疫保护反应。
HSV-1是一种嗜神经性病毒,在人群中感染非常普遍,常见的临床表现为黏膜和皮肤局部集聚的疱疹等轻微症状[2]。HSV-1为双链DNA病毒,基因组152 kb,由独特的长片段 (Unique long sequence, UL) 和短片段 (Unique short sequence, US) 组成,两端为末端重复序列,两片段连接处为内部反向重复序列 (Internal inverted repead sequence,IR)[2]。HSV-1编码约90种蛋白,功能大多已明确,其中约一半为病毒复制所必需,另一些为复制非必需,删除非必需基因并以外源基因代之不会影响病毒复制,故HSV-1可改造为病毒载体。HSV-1作为疫苗载体有其独特的优势,如:HSV-1感染机体后潜伏于神经元,机体针对HSV-1的预存免疫很低; HSV-1载体疫苗可通过口服和黏膜等途径免疫并激发机体全面的免疫应答;另外,有研究表明HSV-1能激发机体的固有免疫反应[3]。与其他病毒载体相比,HSV-1作为HIV载体疫苗的优势在于其宿主范围广、感染效率高、基因组游离存在、抗疱疹病毒药物可终止治疗意外感染和具有靶向性,遗传背景清楚,重组方法成熟[4-5]等 方面。
目前,以HSV-1为载体的HIV-1疫苗已有报道[6-8],这些疫苗能够诱导HIV-1特异性的细胞免疫和体液免疫反应。本研究利用细菌人工染色体技术将串联的HIV-1160、和抗原基因以及表达元件重组至IR区,以期获得新型HIV病毒载体疫苗。
1 材料与方法
1.1 菌种、质粒及细胞系
含HSV-1 F株全长基因组的细菌人工染色体BAC-HSV及其转化的大肠杆菌、含HSV-1基因组HⅠB片段的质粒pRB112由芝加哥大学微生物系Roizman Bernard教授惠赠。穿梭质粒pKO5/BN为研究组前期构建,含HSV-1基因组HⅠB片段和HⅠN片段,在本研究中两个片段为同源重组臂。pIRES/和pcDNA3.1质粒为本室保存。pcDNA3/160B、pcDNA3/160C、pMT/Bip/v5-his-、HIV-1 Bru3以及183H12细胞 (gag单克隆抗体杂交瘤细胞) 均由上海巴斯德研究所周保罗研究员惠赠。293FT和Vero细胞系为本室保存。
1.2 主要试剂
DNA marker 购自东盛公司;限制性内切酶、T4 DNA连接酶、Ex、AMV反转录酶、Klenow Fragment、DNA连接试剂盒均购自TaKaRa宝生物公司;RNA提取试剂盒、DNA回收及纯化试剂盒购自天根生化科技 (北京) 有限公司;质粒大量提取试剂QIAGEN Plasmid Maxi Kit购自QIAGEN公司;细胞培养液基质HGDMEM和Medium 199购自GIBCO公司;Southern blotting试剂盒购自Roche公司;转染试剂Lipofectamine 2 000购自Invitrogen公司;其余试剂均为国产分析纯。
1.3 引物设计及合成
根据GenBank公布的HIV-1基因组序列设计引物序列 (表1)。
1.4 方法
1.4.1 HIV-1抗原基因串联质粒的构建及鉴定
质粒HIV-1 Bru 3含HIV-1全长基因组,以其为模板PCR扩增片段,以该片段替换pIRES/中的Neo基因,即经Ⅰ和Ⅰ位点克隆入pIRES/,获得重组质粒pIRES/;将pMT/Bip/v5-经Ⅰ(消化后补平) 和RⅠ酶切获得的片段经HⅠ(消化后补平) 和RⅠ克隆入pIRES/多克隆位点,获得重组质粒pIRES//;RⅠ (消化后补平)和Ⅱ酶切pIRES//获得含HIV-1和的DNA片段,以之取代pcDNA3/160B和pcDNA3/160C中的新霉素抗性基因,即经Ⅰ和Ⅱ位点克隆入pcDNA3/160B和pcDNA3/160C,获得重组质粒pcDNA3/160B//(pcDNA/B) 和pcDNA3/160C//(pcDNA/C),酶切鉴定重组质粒。

表1 HIV-1基因组所需扩增基因的引物序列
pcDNA/B和pcDNA/C分别转染293FT细胞,于CO2培养箱37 ℃培养48 h后收集细胞,常规方法裂解细胞,Western blotting 检测细胞裂解液上清和沉淀中的HIV抗原。
1.4.2 重组穿梭质粒的构建和重组BAC-HSV的筛选
pcDNA/B和pcDNA/C分别经Ⅰ和Ⅰ (消化后补平) 双酶切后得到HIV-1抗原基因串联的DNA片段,并经R Ⅴ位点克隆入穿梭质粒pKO5/BN,获得重组质粒pKO5/BN/160B//(pKO5/BN/B)和pKO5/ BN/gp160C//(pKO5/BN/C),酶切鉴定重组质粒。
按Horsburgh等[9]报道的方法制备含BAC-HSV大肠杆菌的感受态细胞,以pKO5/BN/B和pKO5/BN/C分别电转感受态细胞,转化细胞经温度 (包括43 ℃和30 ℃) 以及添加抗生素 (包括氯霉素和博莱霉素) 和蔗糖的培养基筛选重组菌,菌落PCR检测重组菌中HIV-1抗原基因。按QIAGEN Plasmid Maxi Kit说明书提取重组菌DNA,PCR鉴定重组BAC-HSV。
1.4.3 重组病毒的纯化与鉴定
重组BAC-HSV转染Vero细胞后收集病毒蚀斑区细胞,经冻融和超声处理的细胞裂解液感染Vero细胞,经3轮蚀斑挑选纯化病毒,随后大量感染Vero细胞并提取重组病毒基因组。以pRB112中HⅠ和Ⅰ酶切片段为模板,随机引物法制备探针,病毒基因组经RⅠ酶切、电泳并转至硝酸纤维素膜上进行Southern blotting检测,探针制备及Southern blotting按DIG DNA Labelling and detection Kit的说明书进行。鉴定正确的重组HSV大量感染Vero细胞,以25 cm2培养瓶为例,每瓶感染细胞经冻融和超声处理后加入1 mL病毒储液,于-86 ℃保存备用。
1.4.4 Western blotting检测重组病毒感染细胞中HIV抗原的表达
HSV/Bp和HSV/Cp分别感染Vero细胞,收集细胞沉淀,细胞裂解液经SDS-PAGE分离并电转移至硝酸纤维素膜,30 g/L脱脂奶粉4 ℃过夜封闭,按1∶2 000稀释小鼠抗HIV gp160抗体 (多抗),室温孵育1.5 h,加入以1∶5 000稀释的辣根过氧化物酶标记的山羊抗鼠IgG,室温反应1 h,DAB避光显色,拍照。
1.4.5 重组HSV增殖特性的检测
重组HSV病毒储液以无血清培养基按10倍梯度稀释后感染Vero细胞,于CO2培养箱中37 ℃培养1-2 h,期间间断振荡培养瓶5-6次,之后换为199Ö培养基 (含0.1 ‰人γ球蛋白),于CO2培养箱37 ℃培养48 h。细胞经甲醇固定和吉姆萨染液染色后于显微镜下进行病毒蚀斑计数,并计算病毒储液的蚀斑形成单位 (Plaque forming unit,PFU)。重组HSV按0.5感染复数 (Multiplicity of infection, MOI) 感染Vero细胞,分别于感染后12 h、18 h、24 h、48 h收集感染细胞,并按上述方法测定细胞裂解液中重组病毒的PFU,绘制重组病毒在Vero细胞中的生长曲线。
2 结果
2.1 HIV-1抗原基因串联质粒的鉴定
pcDNA/B和pcDNA/C中HIV-1抗原基因及表达元件的结构如图1A所示。图1B为pcDNA/B的酶切鉴定结果,该质粒经Ⅰ酶切产生3 416 bp和6 456 bp的DNA片段;经Ⅰ酶切产生9 872 bp的DNA片段;经Ⅰ酶切产生2 479 bp和7 393 bp的DNA片段;经Ⅰ和Ⅰ双酶切产生7 200 bp、2 500 bp和172 bp的DNA片段;经Ⅰ和HⅠ双酶切产生2 600 bp和7 272 bp的DNA片段;经Ⅰ和Ⅱ双酶切产生2 690 bp和7 182 bp的DNA片段;经RⅠ和Ⅰ双酶切产生 3 563 bp和6309 bp的DNA片段;以上结果均与预期相符。pcDNA3/C经上述酶酶切鉴定亦正确。
pcDNA/B和pcDNA/C转染293FT细胞后,Western blotting在细胞沉淀和细胞裂解液上清中均检测到约55 kDa的gag蛋白和约43 kDa的gag蛋白降解产物 (图2A),以及约160 kDa的gp160蛋白及其降解产物gp120蛋白 (图2B)。
2.2 穿梭质粒的鉴定和重组BAC-HSV的筛选
PKO5/BN/B和pKO5/BN/C的酶切分析见图3,两个重组质粒经Ⅰ酶切均线性化产生约15 500 bp的DNA片段。pKO5/BN /C经RⅠ酶切产生约8 500 bp和7 000 bp的DNA片段,经Ⅰ酶切产生约15 000 bp和500 bp的DNA片段,经Ⅰ酶切产生约6 900 bp、 6 300 bp和1 800 bp的DNA片段,说明串联的HIV-1基因表达框正向克隆入pKO5/BN质粒。pKO5/BN/B经R Ⅰ酶切产生约14 700 bp和800 bp的DNA片段,经Ⅰ酶切产生约12 900 bp和2 600 bp的DNA片段,经Ⅰ酶切产生约6 300 bp、5 800 bp和2 900 bp的DNA片段,说明串联的HIV-1基因表达框反向克隆入pKO5/BN质粒。

图1 pcDNA3/gBgp和pcDNA3/gCgp的结构及其酶切分析

图2 pcDNA3/gBgp和pcDNA3/gCgp转染细胞中gag和gp160的检测

图3 pKO5/BN/gBgp和pKO5/BN/gCgp的酶切分析
2.3 重组病毒的纯化与鉴定
重组BAC-HSV转染Vero细胞后获得病毒蚀斑,挑取病毒蚀斑并在Vero细胞连续传代以纯化病毒,图4为在Vero细胞中获得的三轮病毒蚀斑。纯化的重组HSV大量感染Vero细胞并提取病毒基因组,Southern blotting检测到约 7 000 bp的重组区特异性DNA片段 (图5),说明重组病毒正确,分别命名为HSV/B和HSV/C。
2.4 感染细胞中HIV抗原的检测
经Western blotting法检测,在HSV/B和HSV/B感染的Vero细胞中均检测到约120 kDa大小的gp120和约41 kDa的gp41,正常Vero细胞中未检测到上述特异性蛋白 (图6)。
2.5 重组HSV增殖特性的检测
HSV/B和HSV/C感染Vero细胞48 h后病毒PFU分别达到1.26×108PFU/mL和1.53×108PFU/mL,略低于野生型HSV-1感染Vero细胞48 h时病毒PFU (3.82×108PFU/mL)。以0.5 MOI重组病毒感染Vero细胞12 h、18 h、 24 h、48 h时的病毒PFU略低于野生型HSV-1的PFU,但无显著差异 (>0.05) (图7)。
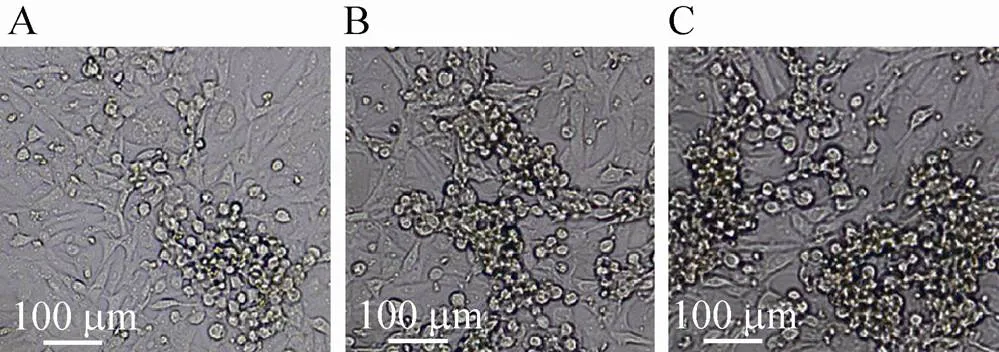
图4 重组HSV-1的获得及纯化

图5 Southern blotting鉴定重组病毒基因组

图6 重组HSV-1感染细胞中HIV-1抗原的检测

图7 野生型病毒与重组病毒在Vero细胞中的生长曲线
3 讨论
近年来,艾滋病疫苗领域出现了许多新的疫苗设计理念,如改造HIV天然抗原的新免疫原设计路线、以诱导中和抗体产生为目标的B细胞疫苗技术路线、以提高免疫原性并兼顾细胞免疫和体液免疫的复制型病毒载体疫苗路线以及以诱导黏膜免疫为主的活载体疫苗等技术路线[10-11]。HIV活载体疫苗能引起较强的细胞免疫反应,并能模拟HIV抗原的天然构象,已成为HIV疫苗研究的热点领域,其中以痘病毒和腺病毒为载体的HIV疫苗研究得最为深入[12-13]。HSV-1载体作为基因治疗载体和疫苗载体的研究已有很长的历史。目前,HSV-1为载体的HIV疫苗也有大量研究,如研究报道表达HIV-1和的HSV-1扩增子(Amplicon) 能诱导机体产生针对HIV的免疫应答。Knipe课题组[14]构建了含SIV的复制缺陷型和复制型HSV-1重组病毒,该研究组将包括gp120、gag和ref-tat-nef融合蛋白在内的SIV基因重组至复制缺陷型HSV-1载体d106中,该重组病毒能诱导短尾猴产生针对SIV的中和抗体和细胞免疫反应,攻毒实验中免疫组的病毒载量减少。为增强疫苗载体抗原表达水平和诱导的免疫应答水平,该研究组恢复d106中部分立即早期 (IE) 基因以提高病毒载体的复制能力,获得的HSV-1重组病毒d106S细胞毒性较低,并保持了对抗疱疹病毒药物的敏感性,故其安全性较高。目前,研究者已将HIV囊膜蛋白gp120基因重组至d106S并获得表达[15]。另有研究者构建了含或基质蛋白基因等HIV基因的复制缺陷型HSV-1,这些重组疫苗均能诱导HIV特异性的免疫反应[16-17]。
本研究将HIV-1、和基因以及表达元件串联后克隆入真核表达质粒pcDNA3.1,在重组质粒pcDNA/B和pcDNA/C转染的293FT细胞沉淀和细胞裂解液上清中均检测到gag蛋白、gp160蛋白及其降解产物,说明HIV-1抗原基因及表达元件的串联框架保证了各基因的表达,且表达的gag蛋白和gp160蛋白能够在细胞内进行加工。随后将HIV-1抗原基因及表达元件的串联框架克隆至穿梭质粒pKO5/BN,利用细菌人工染色体技术获得重组BAC-HSV,继而转染Vero细胞获得重组病毒,Southern blotting检测结果表明重组区已发生特异性重组。重组HSV-1感染的Vero细胞中检测到gp120和gp41,说明表达的gp160经酶解产生了gp120和gp41,与HIV-1感染细胞时gp160的加工过程一致。病毒增殖特性的研究表明,获得的重组病毒HSV/B和HSV/C在Vero细胞中的增殖水平略低于野生型HSV-1,但与野生型HSV-1的增殖水平无显著性差异 (>0.05)。
研究中,重组病毒的获得是基于穿梭质粒pKO5/BN中HSV-1H ⅠB和H ⅠN片段在含BAC-HSV的大肠杆菌中与HSV-1基因组的同源区发生重组,故HIV-1抗原基因及表达元件的串联框架重组至HSV-1基因组的同时,删除了HSV-1HⅠB和HⅠN片段之间约15 kb的内部反向重复序列 (Internal inverted repeat sequences, IR),IR区包括3个IE基因、神经毒性基因和病毒潜伏相关转录本LAT。Roizman课题组[18]早在1988年就报道了删除大部分IR区并插入HSV-2多个囊膜糖蛋白编码基因的重组HSV-1 R7020 (又称NV1020),构建R7020的最初目的是研制预防HSV-1和HSV-2感染的疫苗,研究中发现其保留了在哺乳动物细胞中的复制能力,安全性较高,抗肿瘤活性明显[19],并将其改造为NV1023、NV1042、NV1066等溶瘤病毒[20]。本研究获得的重组病毒HSV/B和HSV/C在插入HIV-1多价抗原的同时删除了完整的IR区,其感染特性和安全性等方面可能与R7020有相似之处,本研究也证实获得的重组HSV保留了感染能力,其安全性尚待进一步研究证实。
HIV-1疫苗抗原选择方面,病毒囊膜糖蛋白 (Env) 和衣壳蛋白 (gag) 是主要的候选抗原。HIV-1感染过程中,Env是中和抗体的主要靶点,同时也是诱导中和抗体的主要抗原。gp160是HIV-1 Env的前体蛋白,在宿主细胞蛋白酶的作用下酶解成gp120和gp41,gp120为外膜蛋白,其上分布有大量的糖基化位点[21-22],gp41为跨膜蛋白,在病毒感染过程中介导病毒脂膜与细胞膜融合[7,23]。Hocknell等[24]以表达HIV-1 gp120的HSV-1扩增子诱导小鼠产生了较强的细胞免疫和体液免疫反应。Gag作为免疫原主要激发细胞免疫反应,能自我装配成病毒粒颗粒 (VLP)[25-27],经改造后仍能够自我组装成VLP并保持天然构象。Parker等[7]构建了表达gag的复制型重组HSV-1,其可诱导小鼠产生特异性细胞免疫反应。除Env和gag之外,Pol、Tat、Nef等为抗原以及多价抗原的HIV疫苗研究也均见报道。本研究中将HIV-1 B型和C型,和基因的表达框重组至HSV获得HIV-1多价病毒载体疫苗,表达的gp160和gag经宿主细胞蛋白酶和外源表达的protease降解及各组分间互作更接近HIV-1感染细胞时HIV-1蛋白表达和加工的过程,其诱发的免疫反应也将针对并阻断HIV-1感染过程,我们后期将通过动物免疫试验深入探讨该载体疫苗的免疫效果。
[1] Soshin Ahn, Youngchul Sung. AIDS vaccine development: the past, the present, and the future. Immune, 2009, 9(1): 1–3.
[2] Manservigi R, Argnani R, Marconi P, et al. HSV recombinant vectors for gene therapy. Open Virol J, 2010, 4: 123–156.
[3] Tsitoura E, Epstein AL. Constitutive and inducible innate responses in cells infected by HSV-1-derived amplicon vectors. Open Virol J, 2010, 4: 96–102.
[4] Chen NG. Cancer Management in Man: Chemotherapy, Biological Therapy, Hyperthermia and Supporting Measures.New York: Springer Press, 2011, 13: 295–316.
[5] Todo T. Oncolytic virus therapy using genetically engineered herpes simplex viruses. Front Biosci, 2008, 13: 2060–2064.
[6] Santos K, Duke CM, Rodriguez-Colon SM. Effect of promoter strength on protein expression and immunogenicity of an HSV-1 amplicon vector encoding HIV-1 Gag. Vaccine, 2007, 25(9): 1634–1646.
[7] Parker SD, Rottinghaus ST, Zajac AJ, et al. HIV-189.6Gag expressed from a replication competent HSV-1 vector elicits persistent cellular immune responses in mice. Vaccine, 2007, 25(37/38): 6764–6773.
[8] Duke CM, Maguire CA, Keefer MC, et al. HSV-1 amplicon vectors elicit polyfunctional T cell responses to HIV-1 Env, and strongly boost responses to an adenovirus prime. Vaccine, 2007, 25(42): 7410–7421.
[9] Horsburgh BC, Hubinette MM, Tufaro F. Genetic manipulation of herpes simplex virus using bacterial artificial chromosomes. Methods Enzymol, 1999, 306: 337–352.
[10] Cohen J. Promising AIDS vaccine's failure leaves field reeling. Science, 2007, 318(5847): 28–29.
[11] Kadoki M, Choi BI, Iwakura Y. The mechanism of LPS-induced HIV type I activation in transgenic mouse macrophages. Int Immunol, 2010, 22(6): 469–478.
[12] Kim JH, Rerks-Ngarm S, Excler JL, et al. HIV vaccines: lessons learned and the way forward. Curr Opin HIV AIDS, 2010, 5(5): 428–434.
[13] Esteban M. Attenuated poxvirus vectors MVA and NYVAC as promising vaccine candidates against HIV/AIDS. Hum Vaccin, 2009, 5(12): 867–871.
[14] Watanabe D, Brockman MA, Ndung'u T, et al. Properties of a herpes simplex virus multiple immediate-early gene-deleted recombinant as a vaccine vector. Virology, 2007, 357(2): 186–198.
[15] Liu X, Broberg E, Watanabe D, et al. Genetic engineering of a modified herpes simplex virus 1 vaccine vector. Vaccine, 2009, 27(21): 2760–2767.
[16] Fiorentini S, Marconi P, Avolio M, et al. Replication-deficient mutant Herpes Simplex Virus-1 targets professional antigen presenting cells and induces efficient CD4+ T helper responses. Microbes Infect, 2007, 9(8): 988–996.
[17] Bozac A, Berto E, Vasquez F, et al. Expression of human immunodeficiency virus type 1 tat from a replication-deficient herpes simplex type 1 vector induces antigen-specific T cell responses. Vaccine, 2006, 24(49/50): 7148–7158.
[18] Meignier B, Longnecker R, Roizman B.behavior of genetically engineered herpes simplex viruses R7017 and R7020: construction and evaluation in rodents. J Infect Dis, 1988, 158(3): 602–614.
[19] Kemeny N, Brown K, Covey A, et al. Phase I, open-label, dose-escalating study of a genetically engineered herpes simplex virus, NV1020, in subjects with metastatic colorectal carcinoma to the liver. Hum Gene Ther, 2006, 17(12): 1214–1224.
[20] Geevarghese SK, Geller DA, de Haan HA, et al. PhaseI/II study of oncolytic herpes simplex virus NV1020 in patients with extensively pretreated refractory colorectal cancer metastatic to the liver. Hum Gene Ther, 2010, 21(9): 1119–1128.
[21] Zhang PF, Cham F, Dong M, et al. Extensively cross-reactive anti-HIV-1 neutralizing antibodies induced by gp140 immunization. Proc Natl Acad Sci USA, 2007, 104(24): 10193–10198.
[22] Morrison LA, Knipe DM. Immunization with replication-defective mutants of herpes simplex virus type 1: sites of immune intervention in pathogenesis of challenge virus infection. J Virol, 1994, 68(2): 689–696.
[23] Dudek T, Knipe DM. Replication-defective viruses as vaccines and vaccine vectors. Virology, 2006, 344(1): 230–239.
[24] Hocknell PK, Wiley RD, Wang X, et al. Expression of human immunodeficiency virus type 1 gp120 from herpes simplex virus type 1-derived amplicons resµLts in potent, specific and durable cellular and humoral immune responses. J Virol, 2002, 76(11): 5565–5580.
[25] Promkhatkaew D, Pinyosukhee N, Thongdeejaroen W, et a1. Prime-boost immunization of codon optimized HIV-1 CRF01-AE Gag in BCG with recombinant vaccinia virus elicits MHC class I and II immune responses in mice. Immunol Invest, 2009, 38(8): 762–779.
[26] Himmel ME, Ding SY, Johnson DK, et al. Biomass recalcitrance: engineering plants and enzymes for biofuels production. Science, 2007, 315(5813): 804−807.
[27] Wen Y, Song Y, Li JL. The effects of Vitreoscilla hemoglobin expression on growth and antibiotic production in. Chin J Biotech, 2001, 17(1): 24–28 (in Chinese).文莹, 宋渊, 李季伦. 透明颤菌血红蛋白在肉桂地链霉菌中的表达对其细胞生长及抗生素合成的影响. 生物工程学报, 2001, 17(1): 24–28.
(本文责编 郝丽芳)
Construction and identification of HSV-1 vector vaccine carrying HIV-1 antigen
Xiaofei Zhao, Jingxia Guo, Xiaojuan Liu, and Zhenghai Ma
College of Life Science and Technology Xinjiang University, Urumqi 830046, Xinjiang, China
To construct an HSV-1 vector vaccine carrying HIV-1 antigens, HIV-1160,,and the expression elements were chained together, and then inserted into the internal inverted repeat sequence region of HSV-1 by bacterial artificial chromosome technology. Firstly, HIV-1(including type B and C),andgenes were cloned into pcDNA3 in series to generate the pcDNA/Band pcDNA/C, then the recombinant plasmids were transfected into 293FT cells, and HIV-1 antigen was detected from transfected cells by Western blotting. Then the expression cassettes from pcDNA/Band pcDNA/C, comprising HIV-1 antigen genes and expression elements, were cloned into pKO5/BN to generate the shuttle plasmids pKO5/BN/Band pKO5/BN/C. The shuttle plasmids were electroporated intocells that harbor an HSV-BAC, the recombinant bacteria were screened, and the recombinant DNA was extracted and transfected into Vero cells. The recombinant virus was purified through picking plaques, the virus’ DNAs were identified by Southern blotting; HIV-1 antigen was detected from the recombinant HSV-1 infected cells by Western blotting, and the virus’ replication competent was analyzed. As the results, gp160 and gag proteins were detected from 293FT cells transfected with pcDNA/Band pcDNA/Cby Western blotting. The recombinant bacteria were generated from theelectroporated with pKO5/BN/Bor pKO5/BN/C. The recombinant HSV was purified from the Vero cells transfected with the recombinant DNA, the unique DNA fragment was detected from the genome of recombination HSV by Southern blotting; gp120 and gp41 were detected from the infected cells by Western blotting, and the recombinant HSV retained replication competent in mammalian cells. The results indicate that the recombinant HSV carrying HIV-1,andgenes was generated, the virus retains replication competent in mammalian cells, and could be used as a replicated viral vector vaccine.
herpes simplex virus type 1, HIV-1 antigen, a viral vector vaccine, bacterial artificial chromosome
June 10, 2014; Accepted: July 22, 2014
Zhenghai Ma. Tel: +86-991-8582500; E-mail: mzhxju@126.com
Supported by: Xinjiang Uygur Autonomous Region High-tech Research and Development Project (No. 2010016).
2014-08-20
http://www.cnki.net/kcms/doi/10.13345/j.cjb.1400320.html
新疆维吾尔自治区高技术研究发展项目 (No. 2010016) 资助。
