配体对钯纳米催化剂的形成及其电活性的影响
2015-07-14陈清华易清风
陈清华 易清风
(湖南科技大学化学化工学院,湘潭 411201)
0 前 言
直接醇燃料电池(DAFC)是一种绿色环保、能量转换率高的电化学装置[1]。近年来乙醇作为直接醇燃料电池的燃料引起了广泛关注,因为乙醇具有来源广,储存方便,毒性低,可再生等优点,使其成为直接醇燃料电池中的燃料的优先选择[2-3]。铂基催化剂是醇氧化反应优异的催化剂[4-5],对铂基催化剂的研究已有大量报道[6-8],然而乙醇的电氧化反应仍然相当缓慢[9-10]。此外,金属铂高昂的成本和有限的资源也进一步限制了铂基催化剂的应用。研究发现,在碱性溶液中Pd是一种很好的催化乙醇氧化的催化剂,比Pt催化剂有更好的催化性能,且它在自然界的丰度至少是铂的50倍[4,11]。因此,在碱性溶液中,Pd是一个用来替代Pt基催化剂的最好材料。目前已经报道的Pd基催化剂包括Pd/C[12-13],Pd/MWCNT等[14-17]等。研究表明,配位体对水热法形成的Pd纳米颗粒的表面状态与分散度有重要影响[18]。本工作研究了硼氢化钠NaBH4还原Pd2+的过程中,不同的配位体如EDTA,甘氨酸(Gly)和木质素磺酸钠(Ls)存在下,对形成的钯纳米颗粒的形貌的影响,同时研究了碱性溶液中,它们对乙醇氧化反应的电催化活性。
1 实验部分
1.1 实验试剂与仪器
所用试剂为浓硝酸,浓硫酸,氯化钯,乙醇,氢氧化钠,硼氢化钠,EDTA,甘氨酸(Gly),木质素磺酸钠(Ls)等,所有试剂均为分析纯(天津市科密欧化学试剂有限公司),未对其进行后续提纯;多壁碳纳米管(MWCNT,北京德科岛金,≥95%)管径为 20~30 nm;所用纯水为实验室自制二次蒸馏水。实验仪器:XRD衍射仪(UltimaⅣMultipurposeX-RayDiffraction System,Rigaku,Japan),辐射源为 Cu Kα(λ=0.154 18 nm),管电压为40 kV,管电流为40 mA,扫描速率为5°·min-1, 扫描范围为 20°~90°; 场发射扫描电镜(Nova NanoSEM230),加速电压为15 kV;透射电子显微镜(Tecnai G20,FEI Company,USA),加速电压为200 kV;等离子体发射光谱仪(ICPS-7510,日本岛津株式会社)。Autolab PGSTAT30电化学工作站 (荷兰)。
1.2 催化剂的制备
首先在浓H2SO4/浓HNO3混合液中对MWCNT进行酸化处理[17],然后将 5 mmol·L-1PdCl2溶液与酸化处理的MWCNT混合,超声分散30 min,按nPd∶nEDTA=1∶1,nPd∶nGly=1∶3,nPd∶nLs=1∶1 的比例,分别加入相应的配体,继续超声分散30 min后置于磁力搅拌器上搅拌1 h,用2 mol·L-1NaOH溶液调节pH值至8~9,随后分3次慢慢滴加2%的NaBH4溶液9 mL,每隔1 h加一次,每次约为3 mL。滴加完毕,继续搅拌1 h,随后减压抽滤,并用纯水洗至中性,40℃下真空干燥10 h,得到的催化剂分别记为Pd-EDTA/MWCNT,Pd-Gly/MWCNT和 Pd-Ls/MWCNT。作为对比,在同样条件下制备无配体存在下的催化剂Pd/MWCNT。
1.3 样品测试
工作电极为直径3 mm的玻碳电极(GC几何面积 0.071 cm2)。将 5 mg 催化剂、950 μL 无水乙醇和50 μL 5%Nafion溶液混合,超声分散40 min至形成均一的悬浊液,用移液枪量取12 μL悬浊液滴在经过处理的GC电极表面,空气中干燥,得到催化剂修饰的GC。等离子体发射光谱分析表明,催化剂Pd/MWCNT,Pd-EDTA/MWCNT,Pd-Gly/MWCNT 和Pd-Ls/MWCNT在GC上的Pd负载量分别为59.6,57.1,58.4 和 69.8 μg·cm-2。
电化学性能测试在常规的三电极体系中进行,参比电极为Hg/HgO(1 mol·L-1NaOH),辅助电极为铂电极,工作电极为催化剂修饰的玻碳电极。本文所报道的电位均相对于Hg/HgO。电化学测试所用电解质均为 1.0 mol·L-1NaOH 或含乙醇的 1.0 mol·L-1NaOH。循环伏安(CV)测试电位控制在0.9 V到0.5 V,扫描速度为 50 mV·s-1。测试均在室温下进行。
2 结果与讨论
2.1 形貌特征
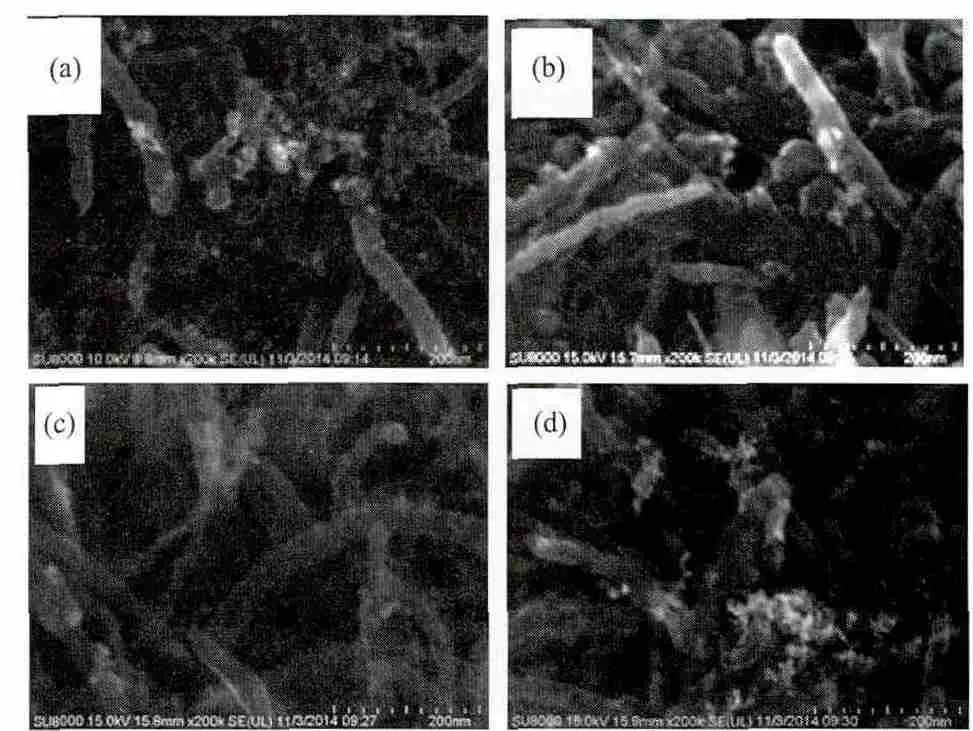
图1 Pd/MWCNT(a),Pd-EDTA/MWCNT(b),Pd-Gly/MWCNT(c)和 Pd-Ls/MWCNT(d)的 SEM 图Fig.1 SEM images of Pd/MWCNT(a),Pd-EDTA/MWCNT(b),Pd-Gly/MWCNT(c)and Pd-Ls/MWCNT(d)
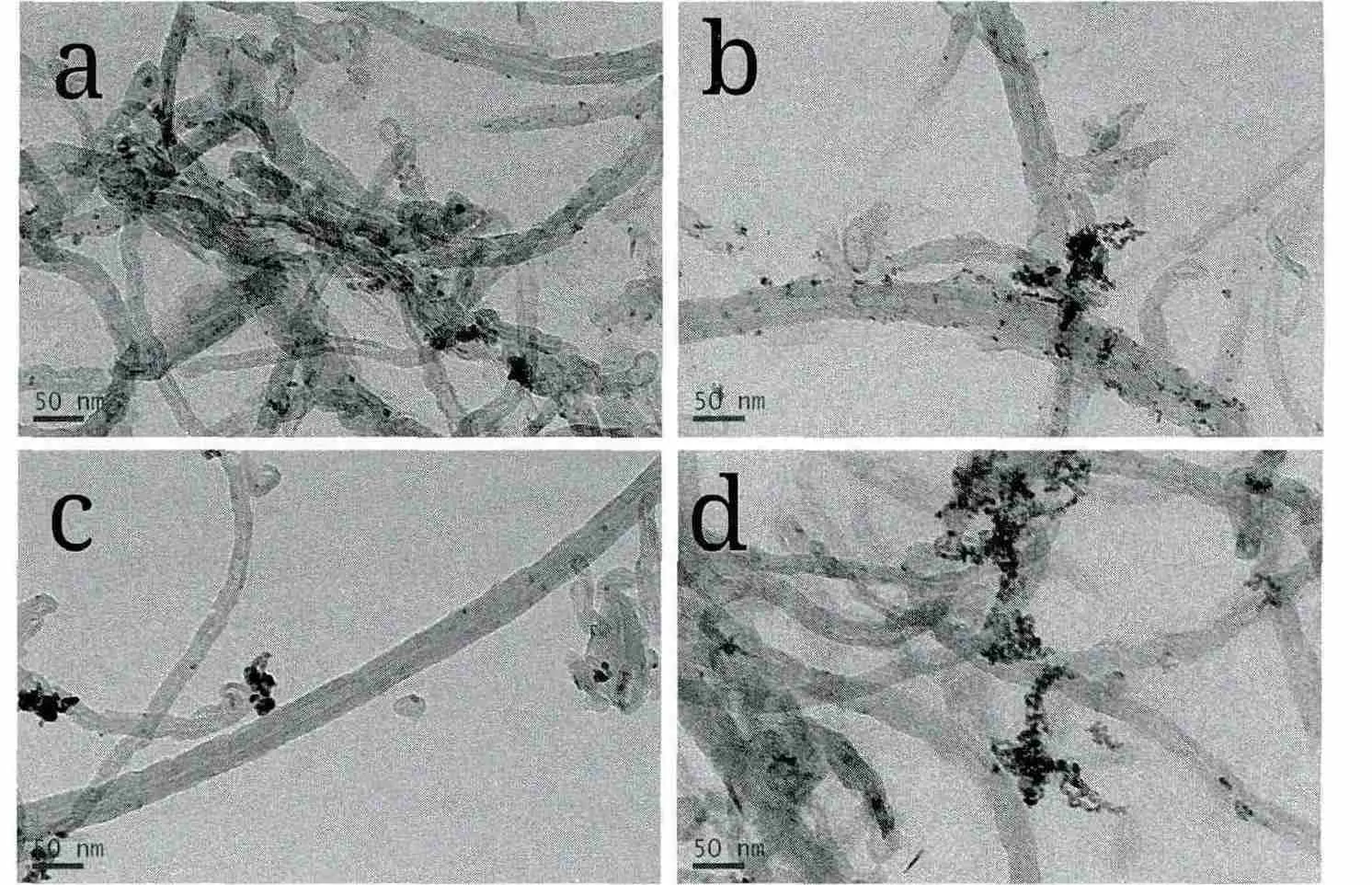
图 2 Pd/MWCNT(a),Pd-EDTA/MWCNT(b),Pd-Gly/MWCNT(c)和 Pd-Ls/MWCNT(d)的 TEM 图Fig.2 TEM images of Pd/MWCNT(a),Pd-EDTA/MWCNT(b),Pd-Gly/MWCNT(c)and Pd-Ls/MWCNT(d)
催化剂的扫描电镜图见图1。从图1看出,4种催化剂中MWCNT上均有Pd纳米颗粒的分布。从图1(a)看出,大部分颗粒大小均匀,但有少量团聚现象,这是因为无配体存在时,Pd2+的浓度较大,还原为Pd纳米颗粒的速率比较快,导致Pd纳米颗粒沉积速率过快,形成的Pd纳米颗粒来不及分散在MWCNT表面而导致部分团聚。图1(b)表明,EDTA存在时,在碳纳米管上形成的颗粒的分散度比较好,颗粒均匀,碳纳米管之间留有大量空隙,使得催化剂拥有更大的表面积。加入甘氨酸后(图1(c)),其金属颗粒数量比另外3种催化剂少,颗粒大小相近。加入木质素磺酸钠后(图1(d)),MWCNT上有大量金属颗粒,但团聚现象比(a)更严重。结果表明,加入EDTA和甘氨酸有利于形成的Pd纳米颗粒的分散。
进一步用TEM对催化剂颗粒在MWCNT上的分布进行了分析。从图2看出,催化剂颗粒大小比较均匀,催化剂 Pd/MWCNT,Pd-EDTA/MWCNT,Pd-Gly/MWCNT和Pd-Ls/MWCNT的Pd颗粒大小分别集中在 4~6 nm,3~5 nm,4~6 nm 和 4~6 nm。少量催化剂颗粒发生了团聚,且Pd-Ls/MWCNT上Pd的团聚较为明显。另外,Pd-Gly/MWCNT催化剂中Pd颗粒比较少。结果与图1的SEM分析是一致的。
图3为催化剂的XRD图,从图中看出,在2θ为 39.1°,45.5°,66.3°,79.6°和 83.9°处有 Pd 的晶面衍射峰,分别对应于 Pd 晶体(111),(200),(220),(311)和(222)的面心立方晶体结构,其中加入EDTA和甘氨酸后,在2θ为79.6°处的衍射峰比另外两种催化剂更明显,说明在EDTA和甘氨酸存在时,晶型为(311)的面的生长比较占优势。从图中还可以看出,(111)面的衍射峰宽化得较多,说明所制备的催化剂颗粒很小,其粒径大小可用谢乐公式算出,通过计算 得 到 Pd/MWCNT,Pd-EDTA/MWCNT,Pd-Gly/MWCNT和Pd-Ls/MWCNT催化剂的Pd颗粒的平均大小分别为 4.8,3.81,3.85 和 3.57 nm,结果与SEM和TEM的分析得出的粒径大小不完全一致,这是因为在SEM和TEM的测试图中颗粒边缘不明显,而且TEM图中的颗粒通常由若干粒子(grain)组成,所以XRD算出的数据与TEM的结果不完全一样。
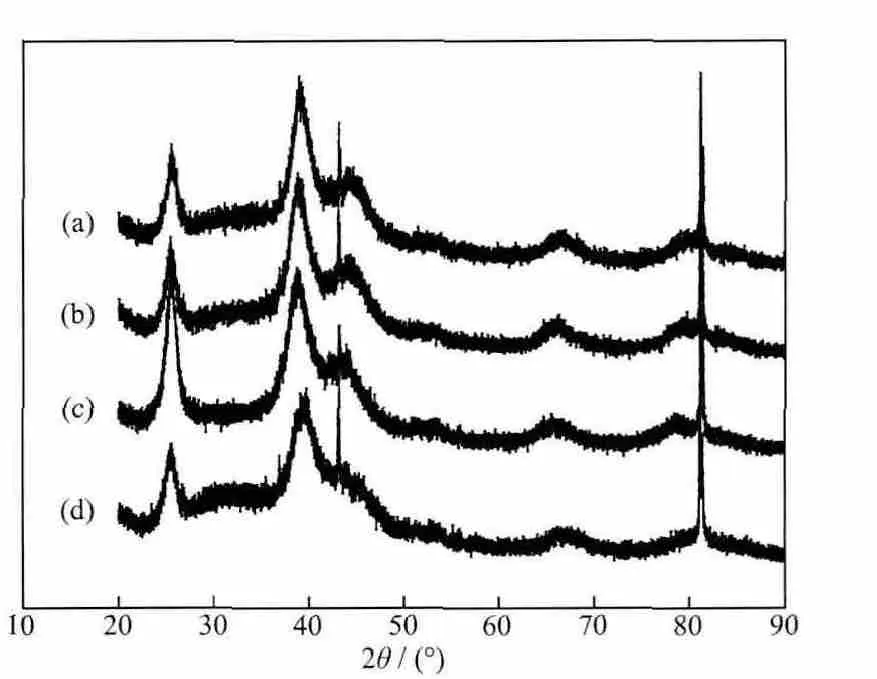
图3 Pd/MWCNT(a),Pd-EDTA/MWCNT(b),Pd-Gly/MWCNT(c)和 Pd-Ls/MWCNT(d)的 XRD 图Fig.3 XRD patterns of Pd/MWCNT(a),Pd-EDTA/MWCNT(b),Pd-Gly/MWCNT(c)and Pd-Ls/MWCNT(d)
2.2 催化剂在空白溶液中的循环伏安特性
图4为催化剂样品在1.0 mol·L-1NaOH溶液中的CV图。从图中看出,催化剂的CV图形状很相似,在电位-0.25 V下均出现了明显的Pd催化剂的特征阴极还原峰,这是在正向扫描过程中形成的Pd氧化物,在反向扫描时发生还原反应所致,该还原峰的大小反映了催化剂中Pd颗粒的分散情况。从图中还可以看出,在Pd/MWCNT,Pd-EDTA/MWCNT,Pd-Gly/MWCNT和Pd-Ls/MWCNT催化剂上,该还原峰的峰电流密度分别为 19.1,26.1,13.3和 13.6 mA·cm-2。根据平滑的多晶钯电极在相同条件下该还原峰所需要的电量,将其与上述催化剂的该还原峰所需要的电量进行比较,可以计算出Pd/MWCNT,Pd-EDTA/MWCNT,Pd-Gly/MWCNT 和 Pd-Ls/MWCNT催化剂中,GC电极上Pd纳米颗粒的活性表面积分别为 1.9,2.4,1.2,1.7 cm2,远远大于它们的几何面积 (0.071 cm2)。结果表明,Pd-EDTA/MWCNT催化剂的Pd活性表面积最大,具有较好的电催化活性。通过测量催化剂在0.5 mol·L-1KOH溶液中的计时电量数据,结合表面光滑的汞电极的界面双电层电容(20 μF·cm-2)[19],以此求得上述催化剂在GC电极上的活性面积分别为16.3,15.1,16.6和18.2 cm2。由于这些催化剂是由少量Pd颗粒负载在大量的MWCNT表面,所以它们的活性面积基本一致,而且也大于它们的Pd纳米颗粒的活性表面积。
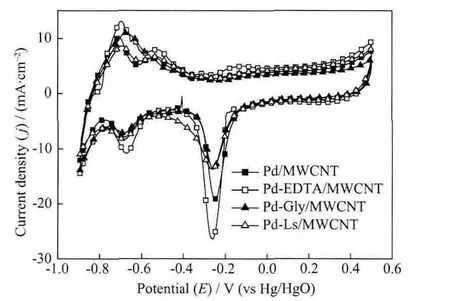
图4 催化剂在1.0 mol·L-1NaOH溶液中的循环伏安曲线,v=50 mV·s-1Fig.4 CVs of the prepared catalysts in 1.0 mol·L-1 NaOH solution at 50 mV·s-1
2.3 催化剂对乙醇氧化的电活性
图5为加入乙醇后各催化剂的CV图。从图中可知,Pd/MWCNT,Pd-EDTA/MWCNT,Pd-Gly/MWCNT和Pd-Ls/MWCNT 4种催化剂的氧化峰电流密度分别为 105,123,47 和 59 mA·cm-2。而且在 Pd-EDTA/MWCNT催化剂上,乙醇电氧化的起始电位相对于其它催化剂有少量的负移,表明EDTA的加入有利于钯纳米颗粒的分散,同时形成了更多的催化活性位点,即Pd-EDTA/MWCNT催化剂对乙醇氧化有最好的催化活性;相反,与Pd/MWCNT相比,Pd-Gly/MWCNT和Pd-Ls/MWCNT对乙醇氧化的电流密度降低,起始电位正移,说明甘氨酸和木质素磺酸钠的加入降低了形成的Pd纳米颗粒的电催化活性。
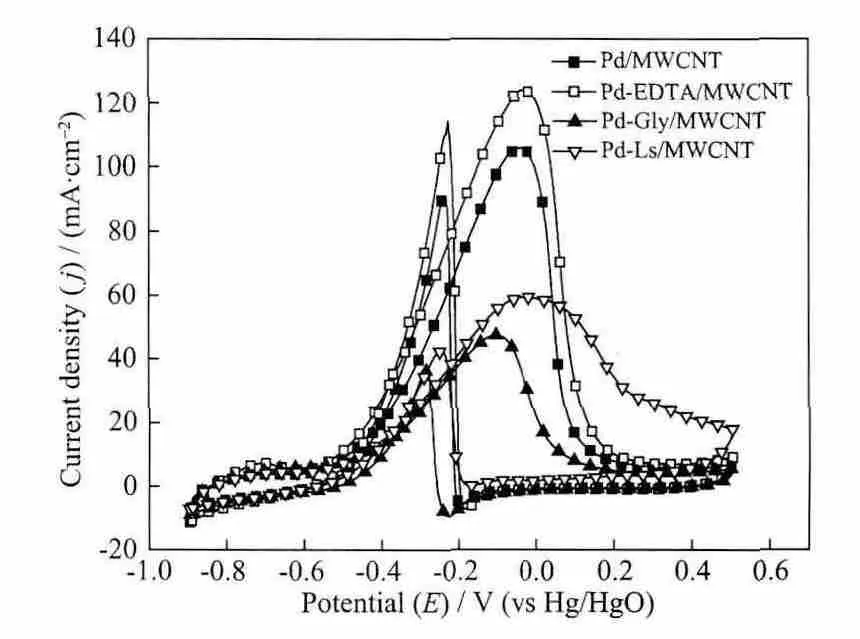
图5 催化剂在 1.0 mol·L-1NaOH+0.5 mol·L-1EtOH溶液中的循环伏安曲线,v=50 mV·s-1Fig.5 CVs of the prepared catalysts in 1.0 mol·L-1 NaOH+0.5 mol·L-1EtOH solution at 50 mV·s-1
采用计时电流法进一步研究了在电位分别为-0.25,-0.3和-0.4 V时,乙醇在催化剂存在下的电解氧化电流变化情况见图6。从图6看出,在4种催化剂上,乙醇氧化电流密度在电解初始阶段都迅速下降,但在约200 s之后电流都趋于稳定。电解开始时电流迅速下降,原因可能是双电层的充电、电极/溶液界面处乙醇浓度迅速下降而引起的。当反应进行到一定程度后,双电层充电的影响不明显,乙醇迁移到电极/溶液界面处的速度也趋于稳定,从而使电解电流保持一个相对稳定的值。从不同电位下的CA图可以看到,Pd-EDTA/MWCNT催化剂对乙醇氧化的电流密度都明显高于另外3个催化剂,而且电流密度大小顺序与循环伏安中的顺序一致,表明Pd-EDTA/MWCNT催化剂对乙醇氧化具有较好的稳定性。进一步比较图6(a)、(b)和(c)发现,随着阶跃电位从-0.4 V(图6(c)),增加到-0.3 V(图 6(b))和-0.25 V(图6(a)),乙醇在Pd-EDTA/MWCNT催化剂上的氧化电流密度也相应增加,在电解时间为600 s时它们相应的电流密度分别为 4,13和18 mA·cm-2。
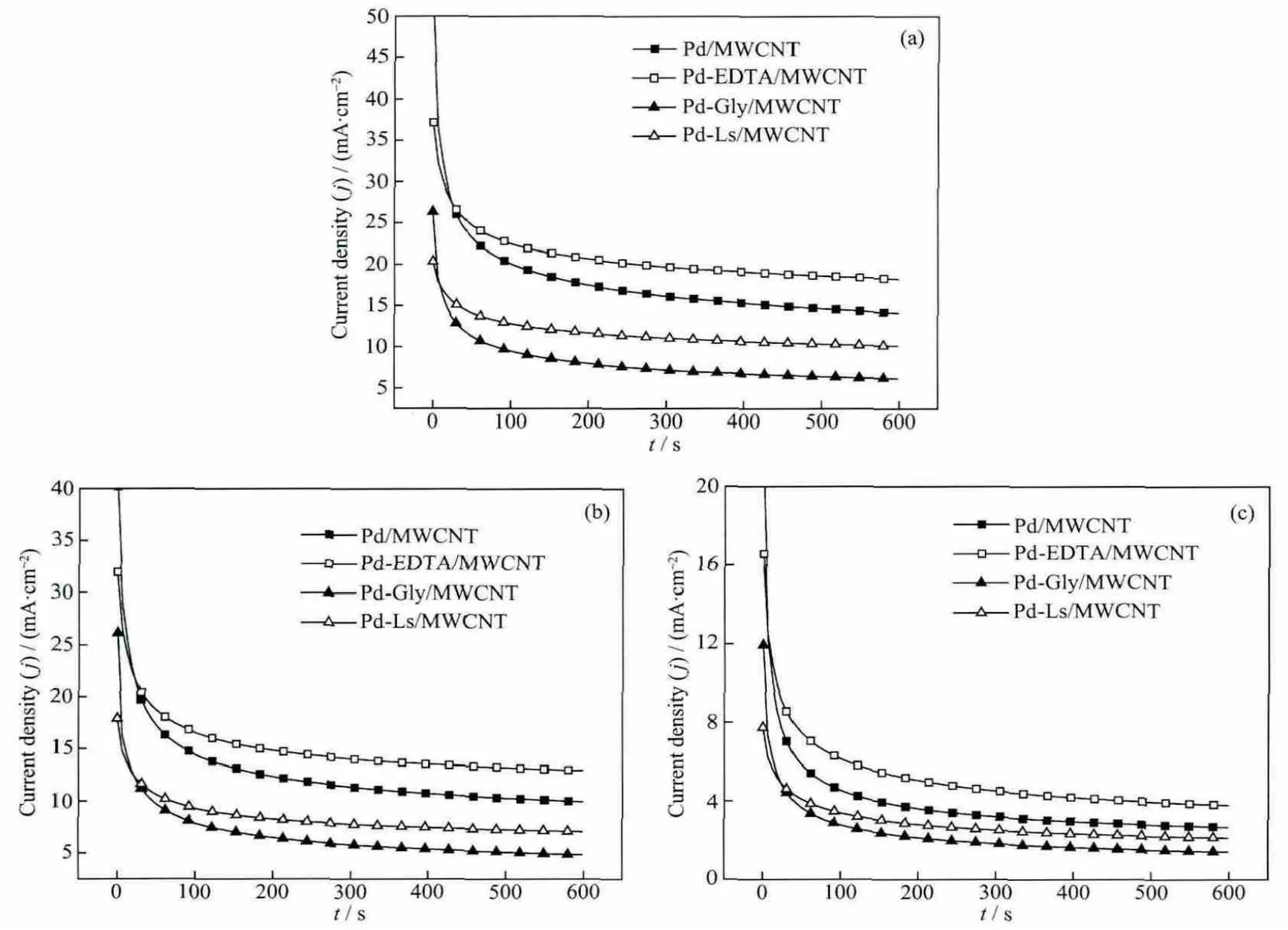
图6 催化剂在1.0 mol·L-1NaOH+0.5 mol·L-1EtOH溶液中的计时电流曲线,阶跃电位分别为-0.25 V(a),-0.3 V(b),-0.4 V(c)Fig.6 Chronoamperometric responses of the prepared catalysts in 1.0 mol·L-1NaOH+0.5 mol·L-1EtOH solution at-0.25 V(a),-0.3 V(b)and-0.4 V(c)respectively
催化剂在含乙醇的NaOH溶液中电位为-0.3 V时的交流阻抗图如图7所示。4个催化剂中,Pd-EDTA/MWCNT的交流阻抗图的半径最小,Pd-Gly/MWCNT的图半径最大,而Pd/MWCNT和Pd-Ls/MWCNT的交流阻抗图的半径较为接近。表明在Pd-EDTA/MWCNT催化剂上,乙醇氧化过程的电荷转移电阻最小,即Pd-EDTA/MWCNT对乙醇氧化具有最强的电催化活性。
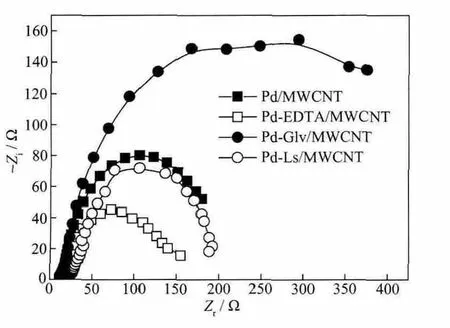
图7 -0.3 V 时催化剂在 1.0 mol·L-1NaOH+0.5 mol·L-1 EtOH溶液中的交流阻抗图Fig.7 Electrochemical impedance spectra of the prepared catalysts in 1.0 mol·L-1NaOH+0.5 mol·L-1EtOH solution at-0.3 V
采用计时电量法计算了乙醇在不同催化剂上的氧化反应速率常数。图8是电位为-0.3 V时不同催化剂的Q-t曲线。根据Q与t1/2的关系[20]:
Q=4nFAkfC*(t1/2ti1/2-ti)/π (1)作出相应的Q-t1/2曲线(见图8的插图)。式(1)中,n为乙醇在钯电极上氧化反应的转移电子数,其值为2.8[21];F为Faraday常数;A为根据图3计算出的Pd纳米颗粒的活性表面积;kf为乙醇氧化反应速率常数;C*为乙醇浓度;ti1/2为t1/2轴上的截距。从图8插图的直线斜率,计算出 Pd/MWCNT,Pd-EDTA/MWCNT,Pd-Gly/MWCNT和 Pd-Ls/MWCNT催化剂的 kf值分别为 3.38×10-5,3.57×10-5,7.31×10-6和2.13×10-5m·s-1。
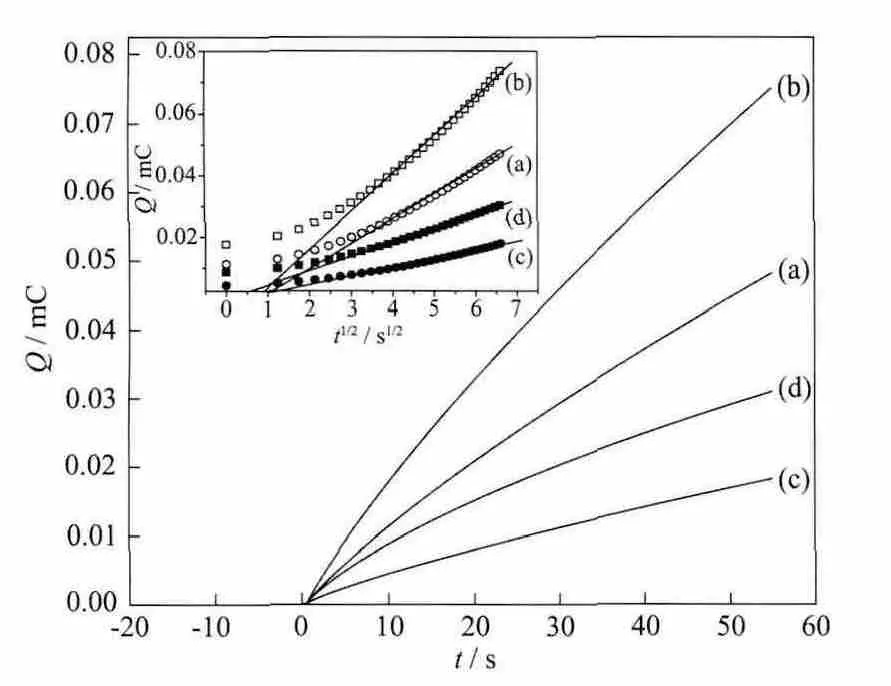
图8 -0.3 V时催化剂Pd/MWCNT(a),Pd-EDTA/MWCNT(b),Pd-Gly/MWCNT(c)和Pd-Ls/MWCNT(d)在 1.0 mol·L-1NaOH+0.5 mol·L-1 EtOH溶液中的Q-t曲线Fig.8 Q-t curves of Pd/MWCNT(a),Pd-EDTA/MWCNT(b),Pd-Gly/MWCNT(c)and Pd-Ls/MWCNT(d)in 1.0 mol·L-1NaOH+0.5 mol·L-1EtOH solution at-0.3 V
进一步研究了Pd-EDTA/MWCNT催化剂对乙醇氧化的电活性。图9为不同乙醇浓度下Pd-EDTA/MWCNT的循环伏安图,从图9(a)看出,乙醇电氧化的电流密度随乙醇浓度的增加而增大,但浓度在1.5 mol·L-1时,乙醇氧化的电流密度反而下降,峰电位向更正的电位偏移。根据乙醇在钯电极上电氧化的机理[22],反应开始时,在电极表面上吸附了大量的氢氧根OHads,它与乙醇反应形成中间体CH3COads;随着反应的进行,CH3COads迁移到电极表面,取代了OHads的位置,使峰电流密度增大,当乙醇浓度达到一定值(1.0 mol·L-1)时,电极表面的 OHads浓度降低,而催化剂对乙醇催化氧化的峰电流是OHads和CH3COads共同作用的结果[22],使得乙醇浓度超过1.0 mol·L-1后峰电流下降。图9(b)显示了乙醇浓度与对应的阳极峰电流之间的关系,图9(c)是乙醇浓度与阳极峰电位之间的关系。从图9(b~c)看出,随乙醇浓度增大,峰电位正向偏移幅度降低,随着反应的进行,溶液中OHads的浓度逐渐降低,从而出现图 9(c)的结果[21]。在乙醇浓度为 1.0 mol·L-1,电位为-0.101 6 V时,Pd-EDTA/MWCNT对乙醇催化氧化的电流密度是152.11 mA·cm-2。当电位超过峰电位时,电极表面的Pd纳米颗粒开始氧化,阻挡了金属颗粒对乙醇的催化作用,导致电流密度下降;反向扫描后,形成的氧化物被还原成金属单质,从而在电位约为-0.2 V时乙醇再次开始被还原,并在电位约为-0.3 V时出现反向扫描时的氧化峰。
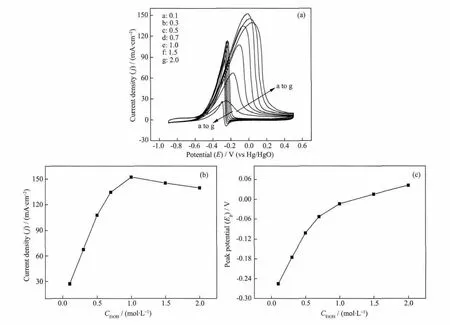
图9 (a)Pd-EDTA/MWCNT在1.0 mol·L-1NaOH中,不同浓度乙醇(图中数字)的循环伏安曲线,v=50 mV·s-1,(b)乙醇浓度与峰电流的关系,(c)乙醇浓度与峰电位的关系Fig.9 CVs of Pd-EDTA/MWCNT catalyst in 1.0 mol·L-1NaOH with different C2H5OH concentrations at 50 mV·s-1(a),plots of C2H5OH concentration vs anodic peak current density jp(b)and C2H5OH concentration vs anodic peak potential Ep(c)
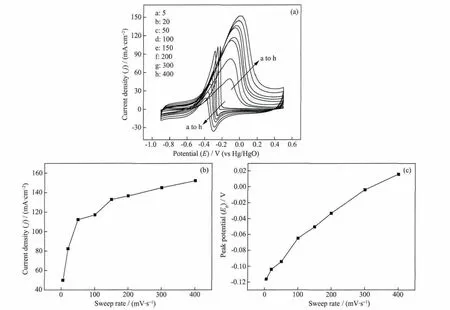
图10 Pd-EDTA/MWCNT在1.0 mol·L-1NaOH+0.5 mol·L-1C2H5OH溶液中不同扫速(图中数字)的循环伏安曲线(a),扫速与峰电流的关系(b),扫速与峰电位的关系(c)Fig.10 CVs of Pd-EDTA/MWCNT catalyst in 1.0 mol·L-1NaOH+0.5 mol·L-1C2H5OH solution at various sweep rates(a),plots of sweep rate vs anodic peak current density jp(b)and sweep rate vs anodic peak potential Ep(c)
不同电位扫描速度下,Pd-EDTA/MWCNT催化剂对乙醇氧化的循环伏安图见图10(a)。图10(a)显示,催化剂对乙醇电氧化的催化活性随扫速的增大而增大,峰电位出现向正电位方向偏移的趋势,这是因为随着扫速的增大,乙醇氧化反应速率跟不上外电路所提供的推动力,即乙醇在电极上的氧化过程主要由电化学极化控制,致使阳极电极电位发生偏移。从图10(b)进一步看出,在高的扫描速度下峰电流的增长幅度降低了,因为在扫描速度较高时,电极附近的乙醇很快消耗,但溶液内部的乙醇来不及扩散到电极表面,从而产生浓差极化,因此乙醇氧化电流的增加变得缓慢。而从扫描速度与峰电位之间的关系看出(图10(c)),随着扫描速度的增加,阳极峰电位呈现出缓慢的增加(正移),这是乙醇氧化反应的极化增大而引起的。
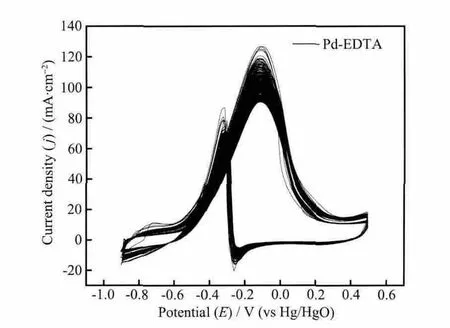
图11 Pd-EDTA/MWCNT 在 1.0 mol·L-1NaOH+0.5 mol·L-1C2H5OH溶液中,连续循环扫描400次的循环伏安曲线,v=100 mV·s-1Fig.11 CVs of Pd-EDTA/MWCNT catalyst in 1.0 mol·L-1 NaOH+0.5 mol·L-1C2H5OH solution for consecutive 400 cycles at 100 mV·s-1
采用连续循环伏安法进一步研究了Pd-EDTA/MWCNT催化剂对乙醇电催化氧化活性的稳定性,结果见图11。从图11看出,在含0.5 mol·L-1EtOH的1.0 mol·L-1NaOH溶液中,在Pd-EDTA/MWCNT催化剂上连续进行400次的循环扫描,其CV图的形状保持不变。随着循环扫描次数的增加,催化剂对乙醇催化氧化的峰电流呈现下降的趋势,而且除峰电位附近的氧化电流有所降低之外,其他电位下的电流密度并未发生很大的改变,反应开始时的阳极峰电流密度约为120 mA·cm-2,循环400圈后该峰电流约为90 mA·cm-2,降幅25%,这是因为随着反应的进行,乙醇渐渐消耗了,反应进行到峰电位附近时乙醇浓度的降低比较明显,从而导致峰电流下降较为明显。但总的来说,Pd-EDTA/MWCNT催化剂对乙醇的催化氧化具有比较好的稳定性。
3 结 论
采用化学还原法,以硼氢化钠为还原剂将Pd2+还原为Pd纳米颗粒,研究了EDTA,甘氨酸(Gly)和木质素磺酸钠(Ls)存在时对形成的Pd纳米颗粒的形貌和电催化活性的影响。结果表明EDTA存在时,所形成的Pd纳米颗粒的粒径更小,在MWCNT上的分散度更高,而木质素磺酸钠的存在不利于Pd纳米颗粒的分散,甘氨酸存在时,Pd纳米颗粒的负载量降低。在碱性溶液中对乙醇氧化的电化学研究表明,在Pd-EDTA/MWCNT催化剂上,乙醇氧化的起始电位比在 Pd/MWCNT,Pd-Gly/MWCNT和 Pd-Ls/MWCNT催化剂上的低,乙醇氧化反应的电流密度更大。在 1.0 mol·L-1NaOH+0.5 mol·L-1EtOH 溶液中,Pd-EDTA/MWCNT对乙醇氧化的阳极峰电流密度为124 mA·cm-2。交流阻抗和计时电量测试表明,Pd-EDTA/MWCNT催化乙醇氧化的电荷转移电阻最小,表现出较大的反应速率,并且对乙醇氧化的电催化活性保持稳定,表明EDTA的存在有利于形成分散度高、稳定性好的Pd纳米颗粒。
[1]Barragán V M,Heinzel A.J.Power Sources,2002,104(1):66-72
[2]Rousseau S,Coutanceau C,Lamy C,et al.J.Power Sources,2006,158(1):18-24
[3]ZHU Ke(朱科),CHEN Yan-Xi(陈延禧),ZHANG Ji-Yan(张继炎).Chinese J.Power Sources(电源技术),2004,28(3):187-190
[4]Zhou W J,Zhou Z H,Song S Q,et al.Appl.Catal.B:Environ.,2003,46(2):273-285
[5]Iwasita T.Electrochim.Acta,2002,47(22/23):3663-3674
[6]CHEN Yu(陈煜).Thesis for the Master of Nanjing Normal University(南京师范大学硕士论文).2006.
[7]JIANG Lu-Hua(姜鲁华).Thesis for the Doctorate of Graduate University of Chinese Academy of Sciences(Dalian Institute of Chemical Physics)(中国科学院研究生院(大连化学物理研究所)),2005.
[8]LUO Bin(罗彬),ZHOU Di-Bi(周地璧),ZHAO Da-Peng(赵大鹏),et al.Mater.Rev.(China)(材料导报),2007,21(6):288-291
[9]Lamy C,Lima A,LeRhun V,et al.J.Power Sources,2002,105(2):283-296
[10]Habibi E,Bidad E,Feizbakhsh A,et al.Inter.J.Hydrogen Energy,2014,39(32):18416-18423
[11]ZENGXiang-An(曾湘安).J.Graduates,SUN YET-SEN Univ.:Natural Sciences,Medicine(中山大学研究生学刊:自然科学,医学版),2010,31(3):9-16
[12]Xu C W,Shen P K,Liu Y L.J.Power Sources,2007,164(2):527-531
[13]Ma L,Chu D,Chen R R.Inter.J.Hydrogen Energy,2012,37(15):11185-11194
[14]Xu C W,Tian Z Q,Chen Z C,et al.Electrochem.Commun.,2008,10(2):246-249
[15]Li Z P,Li J F,Wu X,et al.Sens.Actuattors B:Chem.,2009,139(2):453-459
[16]Singh P,Kulkarni M V,Gokhale S P,et al.Appl.Surf.Sci.,2012,258(8):3405-3409
[17]Yi Q F,Chu H,Chen Q H,et al.Electroanal.,2015,27:388-397
[18]Yi Q F,Niu F J.Thin Solid Films,2011,519(10):3155-3161
[19]SUN Gang-Wei(孙刚伟).Thesis for the doctor of East China University of Science and Technology(华东理工大学博士论文).2012.
[20]Bard A J,Faulknler L R.Translated by SHAO Yuan-Hua(邵元华),ZHU Guo-Yi(朱果逸),DONG Xian-Dui(董献堆).Electrochemical Methods:Fundamentals and Applications(电化学方法原理和应用).Beijing:Chemical Industry Press,2005.
[21]Liu J P,Ye J Q,Xu C W,et al.Electrochem.Commun.,2007,9:2334-2339
[22]Modibedi R M,Masombuka T,Mathe M K.Inter.J.Hydrogen Energy,2011,36(8):4664-4672
