4种化学调控剂对烟草幼苗耐冷性及其光合特性的效应研究
2015-07-05王丽特徐照丽杨利云段胜智崔明昆
王丽特,徐照丽,杨利云,段胜智,崔明昆,龚 明*
(1 云南师范大学 生命科学学院,生物能源持续开发利用教育部工程研究中心,云南省生物质能与环境生物技术重点实验室,云南呈贡650500;2 云南省烟草农业科学研究院,昆明650021)
Ca2+在植物生长发育中有重要的作用,能活化某些酶类,提高膜的稳定性,调控植物的生长发育,其最显著的效应之一是作为细胞内第二信使参与植物的抗逆性应答[1]。外源Ca2+能减轻环境胁迫对植物细胞膜的伤害,提高植物的抗逆性,且外源钙能有效改善逆境下植物的光合能力[2-3]。赤霉素(GA3)作为植物激素之一,最显著的效应是促进植物茎伸长,具有生物活性的GA3能够在植物不同的生长发育阶段发挥功能,参与植物体内的信号转导,对植物的抗逆性有一定的促进作用[4]。水杨酸(SA)是一种植物体内普遍存在的内源信号分子,已被广泛认为是植物激素之一,参与植物对病原菌、低温、干旱、盐渍和紫 外 线 等 胁 迫 的 响 应 与 适 应 过 程[5-9]。多 效 唑(PP333)是一种植物生长延缓剂,可抑制植物内源赤霉素的生物合成,使细胞分裂速度下降而延缓其生长,应用PP333能有效地改善营养分配方向,增强植物抗逆性,提高产量[10-11]。尽管有分别的报告表明上述4种化学调控剂能显著改善植物的多种抗逆性,但目前尚未见到这4种化学调控剂对植物抗冷性调控的比较性研究。
烟草(Nicotiana tabacum L.)作为一种重要的经济作物,全球每年的种植面积在250万公顷以上,总产超过400万吨[12]。早春低温危害是中国南方烟区普遍存在的问题,它会影响烟草种子发芽、出苗和幼苗生长、花芽分化、光合作用,以及烟草体内正常生理生化过程,最终影响烟草的质量和产量[12]。烟草生长最适温度为25~28 ℃,当温度降低到12℃以下时则造成出苗慢,出苗率降低,苗期生长缓慢[13]。为保证烟草早春阶段育苗工作的顺利进行,通过栽培措施和化学调控手段提高烟草幼苗的抗冷性非常必要。有关研究表明,CaCl2处理提高了烟草幼苗中结合钙含量,增强了细胞膜结构的稳固作用,减缓了低温对烟草幼苗细胞膜的伤害,提高了烟草幼苗的耐冷性[14];SA 参与了植物对多种生物和非生物逆境胁迫的响应和适应过程,它能使低温胁迫烟苗MDA 含量降低,而使游离脯氨酸和可溶性糖含量提高[15-16]。但迄今有关GA3和PP333对烟草抗冷性效应的研究尚未见报道,也未见到这4种化学调控剂(CaCl2、GA3、SA 和PP333)对烟草抗冷性调控的比较性研究。因此,本研究针对目前烟草育苗生产中存在的实际问题,通过对烟草幼苗进行不同浓度的CaCl2、GA3、SA 和PP333预处理,考察4种化学调控剂处理在低温胁迫下对烟草幼苗耐冷性及其光合生理特性的影响,并从中筛选出作用效果较好的化学调控剂及其使用剂量,为烟草植株生长前期抗逆性的调控提供理论支撑。
1 材料和方法
1.1 材料和试剂
实验用烟草品种为‘云烟97’,种子由云南省玉溪中烟种子有限责任公司提供,按(GB/T25241.1-2010)的方法培育和管理烟苗。
实验用4种化学调控剂分别为CaCl2、GA3、SA和PP333。其中,CaCl2剂量水平为3.0和6.0mmol/L,赤霉素剂量水平为100和200mg/L,水杨酸剂量水平为1.0 和2.0mmol/L,多效唑剂量水平为100和200mg/L,共同对照组为蒸馏水(0mmol/L),共组成9个处理,依次用C1、C2、G1、G2、S1、S2、P1、P2、CK表示。
即相当于每种试剂3个剂量水平处理,每个处理3次实验重复,每个重复使用2盘烟草漂浮育苗盘、共计336株烟草幼苗。
1.2 烟草幼苗预处理及低温处理
待烟草幼苗长到3叶1心时,叶面分别喷施各浓度的CaCl2、GA3、SA、PP333,每隔2d喷施1次,共喷施4次,喷施时以全株淋湿、药液欲滴下为标准。同时,对照组用蒸馏水喷施。最后一次喷完后让其继续置于育苗池内生长2d,然后转入人工气候室内进行10 ℃低温处理,光周期为14h/10h(昼/夜),光强为400μmol·m-2·s-1,室内湿度为75%。
1.3 测定指标与方法
1.3.1 植株生长指标 在低温处理的0、10、20d,每个处理选择长势均匀并随机选取30株烟苗,平均分为3组,洗净自然晾干,用于测量单株鲜重。在取样时,用吸水纸轻轻将叶片上残留的水分吸干,用天平直接称整株鲜重,再分别称其地上部分和地下部分鲜重。
然后,于烘箱内杀青后烘至恒重,分别称干重,再计算相关生长指标。
相对生长速率(RGR)=lnW2-lnW1
t2-t式中,W1、W2分别表示在时间t1和t2时的干重。
干物质积累速率=(t2天后的干物质量-t1天后的干物质量)/(t2-t1)
1.3.2 生理生化指标 丙二醛含量采用硫代巴比妥酸(TCA)法测定,具体参照赵世杰等[17]的操作方法。参照王学奎[18]的方法进行叶绿素含量、根系活力(TTC法)和脯氨酸含量(酸性茚三酮比色法)测定。
1.3.3 光合指标 净光合速率、胞间CO2浓度、气孔导度、蒸腾速率等参数采用Li-6400XT 光合仪(Li-COR,美国)于人工气候室进行活体测定,测定方法和相关参数设定参照柯学等[19]的进行。
1.4 数据处理与分析
每组实验重复3次,每次测定2次重复。实验原始数据计算用Excel 2003,统计分析用SPSS 11.5,作图用Sigma Plot 12.0。数据经单因素方差分析后比较不同药剂处理组与对照组之间的差异显著性。
2 结果与分析
2.1 化学调控剂预处理对低温下烟草幼苗干物质积累和根系活力的影响
2.1.1 单株干重 干重表示的是植物体内最终干物质的积累量[20-21]。由图1可看出,在进入低温处理前,烟苗经过不同浓度的CaCl2、GA3、SA 和PP333预处理10d后,其单株干重均比同期对照(CK)显著增加,且不同处理增加的幅度不同,C1、C2、G1、G2、S1、S2、P1、P2处理增幅分别为63.5%、46.5%、46.8%、34.3%、64.4%、45.3%、51.2%、24.1%,其中处理作用效果较好的是C1(3.0mmol/L CaCl2)和S1(1.0mmol/L SA)。
当经过上述4种化学调控剂预处理后的烟草幼苗移入10 ℃的人工气候室进行20d的低温处理后,所有处理幼苗单株干重与低温处理前(0d)相比都有不同程度增加,且不同处理效果不同。同时,与同期CK 相比,各个化学调控剂预处理幼苗单株干重均显著增加,其中的S1处理(1.0mmol/L SA)使单株干重增加了97.2%,其作用效果最显著。以上结果表明,4种化学调控剂预处理都能促进烟草幼苗在低温处理后单株干重的积累,提高烟草幼苗的耐冷性,并以1.0mmol/L SA 处理作用效果最好。
2.1.2 相对生长速率和干物质积累速率 相对生长速率即单位时间内烟草幼苗干物质增加量占原有数量的比值,可从一侧面体现出烟株在低温环境下单位时间内的生长状况[22]。图2,A 结果显示,在10 ℃低温下处理20d后,各浓度药剂预处理都能够显著提高烟草幼苗在低温下的相对生长速率,C1、C2、G1、G2、S1、S2、P1、P2处 理 分 别 比 对 照 增 加 了115.5%、84.5%、115.6%、72.9%、136.8%、105.7%、101.8%、68.0%。表明这4种化学调控剂预处理都能够促进烟草幼苗在低温胁迫下的生长和发育,增强其抵抗低温的能力,并以C1(3.0mmol/L CaCl2)、G1(100mg/L GA3)、S1(1.0mmol/L SA)处理作用效果较明显。
干物质积累速率体现了植物在特定环境条件下有机物积累的快慢程度[23]。如图2,B所示,各浓度药剂预处理都能显著提高烟草幼苗在10 ℃低温下20d的干物质积累速率,各处理分别比对照增加了359.5%、156.8%、701.8%、228.8%、764.9%、544.1%、359.5%、355%,表明这4种化学调控剂预处理都能有效提高烟草幼苗在低温胁迫下的干物质积累速率,其中的S1(1.0 mmol/L SA)处理作用效果最明显。
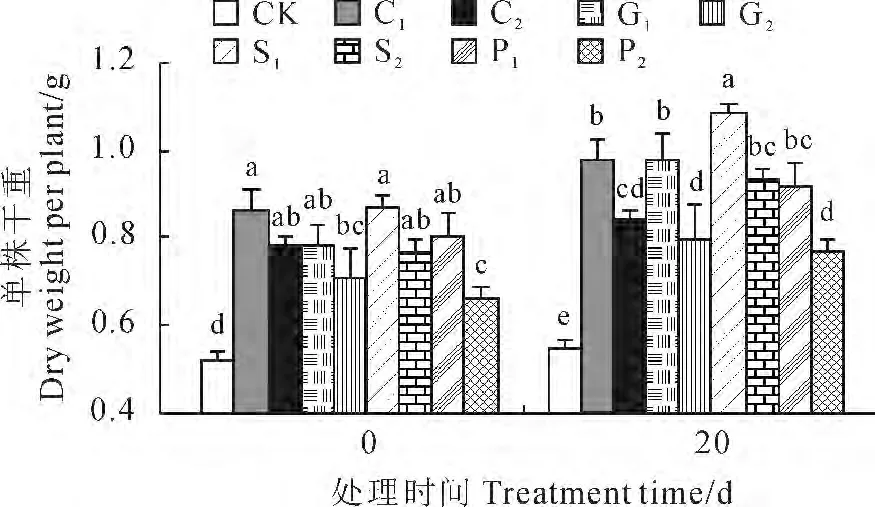
图1 4种化学调控剂处理对10 ℃低温下烟草幼苗单株干重的影响CK.蒸馏水(对照);C1.3.0mmol/L CaCl2;C2.6.0mmol/L CaCl2;G1.100mg/L GA3;G2.200mg/L GA3;S1.1.0 mmol/L SA;S2.2.0mmol/L SA;P1.100mg/L PP333;P2.200mg/L PP333;不同小写字母表示同期处理间在0.05水平存在显著性差异;下同Fig.1 Effects of pretreatments with four chemical regulators(CaCl2,GA3,SA and PP333)on dry weight of tobacco seedlings at 10 ℃CK.Distilled water(control);C1.3.0mmol/L CaCl2;C2.6.0mmol/L CaCl2;G1.100mg/L GA3;G2.200mg/L GA3;S1.1.0mmol/L SA;S2.2.0mmol/L SA;P1.100 mg/L PPP333;P2.200mg/LPPP333;The different normal letters indicate significant difference among treatments at 0.05level;The same as below
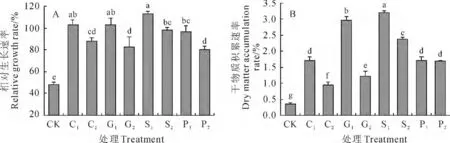
图2 4种化学调控剂预处理对10 ℃低温下20d内烟草幼苗相对生长速率(A)和干物质积累速率(B)的影响Fig.2 Effects of pretreatments with four chemical regulators on relative growth rate(A)and dry matter accumulation rate(B)of tobacco seedling at 10 ℃for 20days
2.1.3 根系活力 根系活力直接影响水分与养分的吸收,进而影响物质同化、转化或合成,也影响植物对低温的耐性[24]。由图3可看出,烟苗经过不同浓度的CaCl2、SA 和PP333预处理10d后,在进入低温处理前,处理烟草幼苗均比CK 具有相对较高的根系活力,C1、C2、G1、G2、S1、S2、P1、P2处理同比增幅分别为66%、27.7%、73.9%、30.2%、68.1%和75.7%,但GA3处理组与对照相比差异不显著。当烟草幼苗转入10℃、20d的低温处理过程中,根系活力总体而言显著下降,但CaCl2、SA 和PP333预处理组根系活力始终显著高于对照。其中,低温下10 d时,各处理烟苗的根系活力均不同程度高于CK,且除G1外均达到显著水平;低温下20d时,C1、C2、G1、S1、S2、P1、P2处理根系活力与对照相比分别显著增加了35.5%、74.4%、44.2%、131.5%、62.6%、95.2%、53.5%,而G2与对照无显著差异。表明这些化学调控剂处理能有效提高低温胁迫下烟草幼苗的根系活力(图3)。
2.2 化学调控剂预处理对低温下烟草幼苗脯氨酸和丙二醛含量的影响
2.2.1 脯氨酸含量 植物在低温下积累脯氨酸可提高其抗冷性[24]。由图4可看出,烟苗经过不同浓度CaCl2、GA3、SA 和PP333预处理10d后,在进入低温处理前,处理过的烟草幼苗已有比对照组相对较高的脯氨酸含量,如G1、S1、S2、P2处理组脯氨酸含量分别比CK 显著增加了67.2%、100.7%、77.6%和76.4%。在预处理烟草幼苗转入10 ℃、20d的低温处理过程中,脯氨酸含量总体而言有一个先上升后下降的过程。其中,在低温胁迫下10d时,各个处理的脯氨酸含量均比对照显著大幅提高;在低温下20d时,各个处理下脯氨酸含量与10d时相比有所下降,但是与低温处理前(0d时)相比仍然提高,且除C1外,C2、G1、G2、S1、S2、P1、P2处理脯氨酸含量比同期CK 分别显著增加了25.6%、86.1%、80.0%、138.0%、121.2%、46.5%、49.6%,并以SA 处理组的作用效果较好(图4,A)。
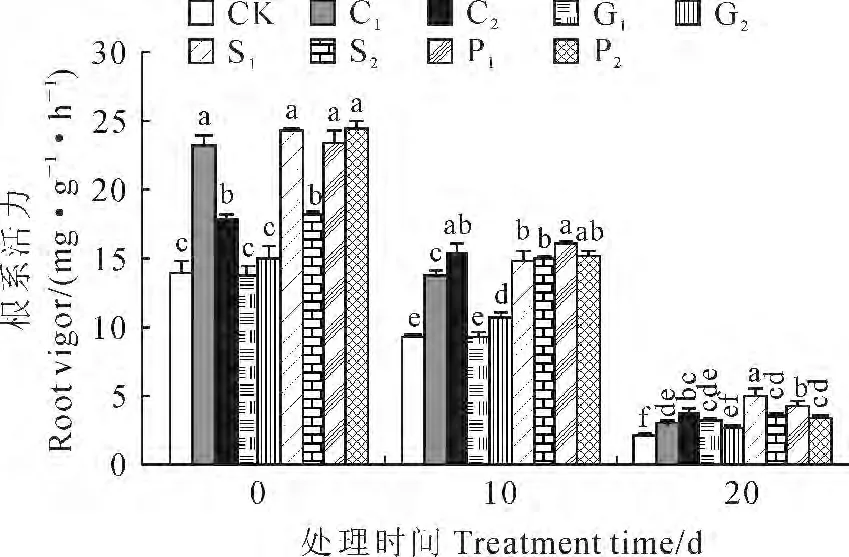
图3 4种化学调控剂预处理对10 ℃低温下烟草幼苗根系活力的影响Fig.3 Effects of pretreatments with four chemical regulators on root vigor of tobacco seedlings at 10 ℃
2.2.2 丙二醛含量 MDA 是膜脂过氧化的最终分解产物,其含量可以反映植物遭受逆境伤害的程度,MDA 的积累可能对膜和细胞造成一定的伤害,是衡量植物在低温胁迫下细胞膜受伤害的重要指标[24]。图4,B 显示,烟苗经过不同浓度的CaCl2、GA3、SA 和PP333预处理10d后,在进入低温处理前,处理过的烟草幼苗已比同期CK 有相对较低的MDA 含量。当烟草幼苗转入10 ℃、20d的低温处理过程中,MDA 含量总体上有一个先上升后下降的过程,但预处理烟苗MDA 含量始终显著低于未处理的对照,这种差异在低温下10d时表现最为显著,此时C1、C2、G1、G2、S1、S2、P1、P2处理MDA 的含量分别比同期对照显著降低了35.5%、49.0%、38.9%、33.4%、59.5%、51.2%、51.6%、45.2%,并以S1(1.0mmol/L SA)处理效果较好。可见,4种化学调控剂预处理能有效提高低温胁迫下烟苗的脯氨酸含量,而显著降低其MDA 含量,从而增强幼苗低温抗性。
2.3 化学调控剂预处理对低温下烟草幼苗光合指标的影响
2.3.1 总叶绿素含量 在低温胁迫下,植物叶片的叶绿素降解是一个普遍现象[25]。当烟苗经过不同浓度的CaCl2、GA3、SA 和PP333预处理10d后,烟草幼苗叶片普遍有相对较高总叶绿素含量;与对照组相比,C1、G1、G2、S1、S2、P1、P2处理总叶绿素含量分别显著增加了30.8%、20.8%、12.8%、50.8%、34.9%、18.3%、44.8%,并以S1、P2处理的效果较好(图5,A)。当烟草幼苗转入10℃、20d的低温处理过程中,叶片总叶绿素含量逐步下降,但4种化学调控剂预处理组总体始终维持比对照更高的叶绿素含量。其中,低温处理10d时,各预处理烟苗的总叶绿素含量均比对照不同程度地提高;低温处理20 d时,与对照相比,G1、S1、S2、P1、P2处理总叶绿素含量分别比对照显著高出28.4%、32.4%、28.0%、31.5%、37.5%、29.0%,并以G2、S2、P1处理的效果较好。
2.3.2 净光合速率 低温胁迫下植物的光合作用快速下降是冷害产生的重要原因之一[25]。由图5,B可看出,烟苗经各浓度药剂预处理10d后,其净光合速率均显著大于对照,C1、C2、G1、G2、S1、S2、P1、P2处理增幅分别为135.2%、112.7%、73.2%、106.8%、138.4%、108%、63.7%、23.6%,并以C1、S1处理效果较好。当烟草幼苗转入10 ℃、20d的低温处理过程中,其净光合速率呈现先快速大幅下降、后缓慢回升的趋势。其中,低温处理10d时,各处理烟苗的净光合速率均不同程度高于对照;低温处理20d时,烟草幼苗的净光合速率比10d时有所回升,C1、C2、G1、G2、S1、S2、P1、P2处理比对照分别显著高出55.0%、103.0%、50.7%、126.7%、137.6%、56.0%、134.8%、59.8%,其中S1、P1处理的作用效果较好。
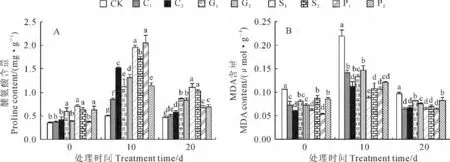
图4 4种化学调控剂预处理对10 ℃低温下烟草幼苗脯氨酸(A)和丙二醛(B)含量的影响Fig.4 Effects of pretreatments with four chemical regulators on proline(A)and MDA(B)contents of tobacco seedlings at 10 ℃
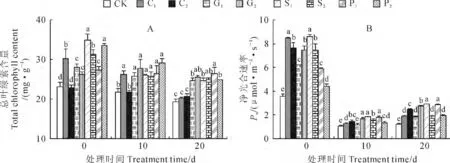
图5 4种化学调控剂预处理对10 ℃低温下烟草幼苗叶片总叶绿素含量(A)和净光合速率(B)的影响Fig.5 Effects of pretreatments with four chemical regulators on the total chlorophyll content(A)and net photosynthetic rate(B)of tobacco seedling leaves at 10 ℃
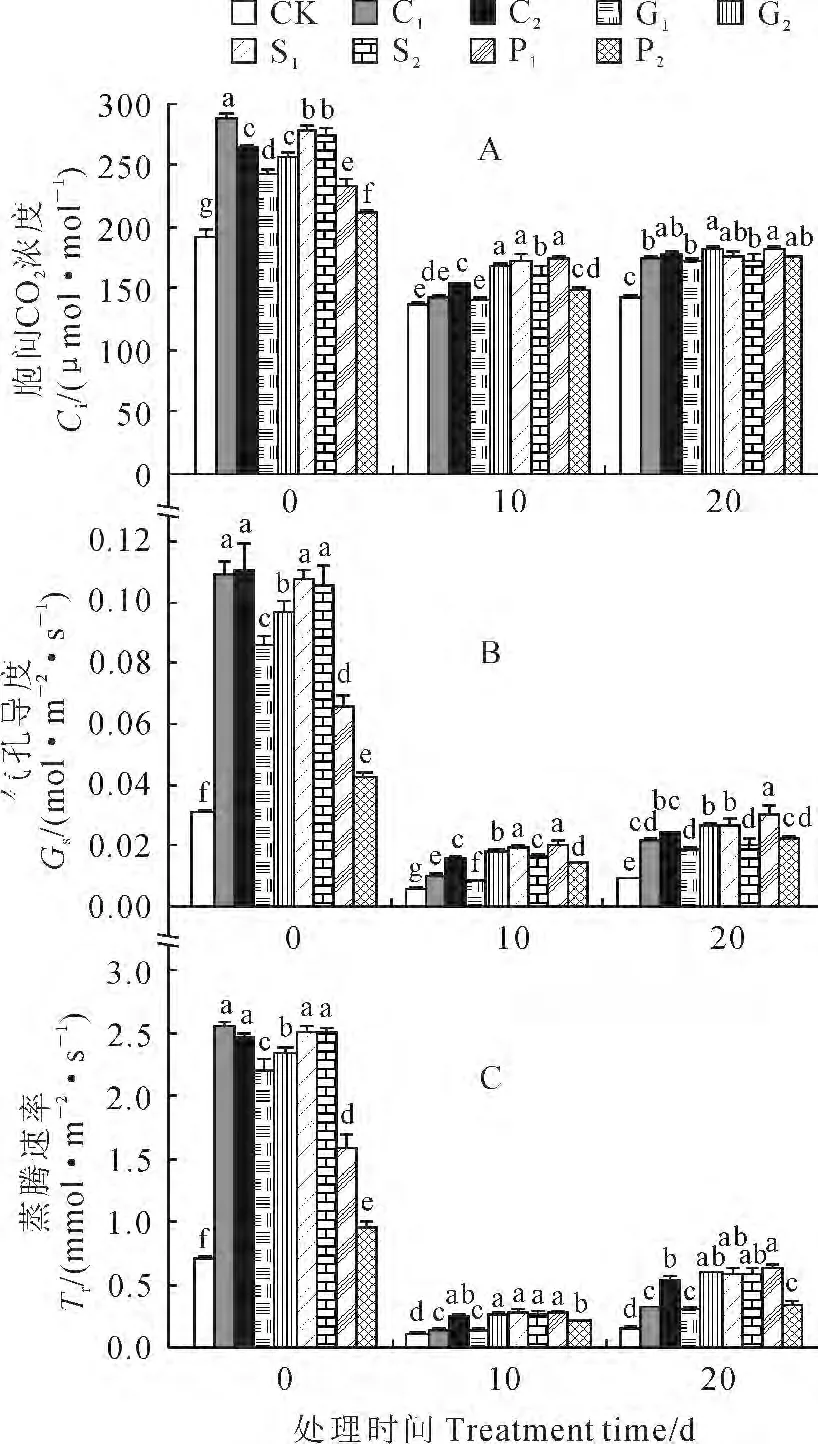
图6 4种化学调控剂预处理对10 ℃低温下烟草幼苗叶片胞间CO2 浓度(A)、气孔导度(B)和蒸腾速率(C)的影响Fig.6 Effects of pretratments with four chemical regulators on intercellular CO2concentration(A),stomatal conductance(B)and transpiration rate(C)of tobacco seedling leaves at 10 ℃
2.3.3 胞间CO2浓度、气孔导度和蒸腾速率 当烟苗经各浓度药剂预处理10d后,其胞间CO2浓度(图6,A)、气孔导度(图6,B)和蒸腾速率(图6,C)均显著高于对照,且其中的CaCl2处理组(C1、C2)和SA 处理组(S1、S2)的作用效果较好。当烟草幼苗转入10 ℃、20d的低温处理过程中,其胞间CO2浓度、气孔导度和蒸腾速率均呈现先快速大幅下降、后缓慢回升的趋势,但预处理烟草幼苗胞间CO2浓度、气孔导度和蒸腾速率普遍高于同期对照。如在10℃下处理20d条件下,所有经预处理的烟草幼苗叶片胞间CO2浓度、气孔导度和蒸腾速率均显著高于同期对照,它们的增幅分别为20.7%~27.1%(图6,A)、111.5%~233.7%(图6,B)、116.5%~357.2%(图6,C),并以S1(1.0 mmol/L SA)和P1(100mg/L PP333)处理的作用效果最好。可见,4种化学调控剂预处理能有效提高低温胁迫下烟苗的总叶绿素含量、净光合速率、胞间CO2浓度、气孔导度及蒸腾速率,从而提高烟苗在低温胁迫下的光合性能,增强烟苗在低温下的抗性。
3 讨 论
起源于热带和亚热带的冷敏植物如水稻、玉米、黄瓜、烟草等在零上低温胁迫下,常经历光合作用受抑、生长减缓至停滞、氧化胁迫引发的生物大分子损伤、细胞代谢紊乱直至植株死亡,易导致农作物减产和品质的下降。通过各种化学调控剂预处理来提高冷敏植物耐冷性的研究已有许多报道,但这些研究往往集中于某一种特定的化学调控剂,Ca2+最显著的效应是作为细胞内第二信使参与植物的抗逆性应答[2-3,8]。GA3可参与植物体内的信号转导,促进植物抗逆性的提高[4]。SA 是普遍存在于高等植物体内可自身合成的一种类似植物激素的酚类化合物,在抗环境胁迫方面具有重 要作用[5-9,15]。PP333是一种高效低毒的植物生长延缓剂,能抑制植物茎秆伸长,促进分蘖,增强抗逆性[10-11]。不同化学调控剂对植物耐冷性的比较研究尚不多见。本试验以农业生产了应用较广泛的4 种化学调控剂(CaCl2、GA3、SA 和PP333)比较研究了它们对烟草幼苗耐冷性的影响,各处理低温胁迫下的干物质积累量、根系活力、脯氨酸和MDA 含量、光合作用相关参数表现都表明这4种化学调控剂能不同程度地提高烟草幼苗的耐冷性。
在低温胁迫下,植物地上部和地下部的生长首先 会 受 到 抑 制[20-21]。在 本 研 究 中,4 种 化 学 调 控 剂(CaCl2、GA3、SA 和PP333)预处理都能不同程度提高烟苗单株干重、相对生长速率、干物质积累速率和根系活力;当预处理过的烟草幼苗转入10℃的低温胁迫20d后,它们比对照能保持显著更高的单株干重、相对生长速率、干物质积累速率和根系活力,即4种化学调控剂预处理改善了烟草幼苗地上部和地下部在低温胁迫下的生长状况,且以1.0 mmol/L SA 预处理的综合表现最好。
植物在低温胁迫下,对冷害最敏感的细胞膜系统首先受到影响,膜脂过氧化作用发生伴随着MDA 含量的增加,植物细胞遭受到伤害。脯氨酸是植物体内主要渗透调节物质之一,能稳定生物大分子结构,清除活性氧,保障膜结构的完整性[26-28]。在本 研 究 中,4 种 化 学 调 控 剂(CaCl2、GA3、SA 和PP333)预处理都能显著提高烟草幼苗的脯氨酸含量和降低MDA 含量,这种差异在低温胁迫下的烟草幼苗中表现得尤为明显,表明这4种化学调控剂预处理可能通过提高烟草幼苗体内的脯氨酸积累量来减轻低温胁迫下的氧化胁迫和膜脂过氧化作用,减轻细胞损伤,最终来提高烟草幼苗的耐冷性。综合来看,1.0mmol/L SA 和100mg/L PP333的作用效果较好。
光合作用是植物对低温胁迫响应最快的生理生化过程之一。低温能抑制植物光合作用,影响光合器官的结构和活性,改变光合色素组成及抑制叶绿体发育[24,29]。本实验结果表明,低温胁迫导致烟草幼苗叶绿素含量、净光合速率、胞间CO2浓度、气孔导度、蒸腾速率下降,而4种化学调控剂预处理可显著缓解低温对上述光合作用参数的抑制。而光合作用是所有植物生物量积累的基础,化学调控剂预处理缓解了低温对烟草幼苗光合作用的抑制,最终又促进烟草幼苗合成的干物质积累增加,其单株干重、干物质积累速率、相对生长速率和根系活力提高,进而提高烟草幼苗的耐冷性。综合来看,200 mg/L GA3、1.0 和2.0 mmol/L SA、100 和200 mg/L PP333的作用效果较好。
综上所述,4种化学调控剂(CaCl2、GA3、SA 和PP333)预处理可提高烟草幼苗的干物质积累量、根系活力、脯氨酸含量及光合效率,降低MDA 含量,总体上提高了烟草幼苗素质。在低温胁迫下,经4种化学调控剂预处理的幼苗比对照可保持更高的单株干重、相对生长速率、干物质积累速率、根系活力、脯氨酸含量、叶绿素含量、净光合速率、胞间CO2浓度、气孔导度和蒸腾速率,减缓低温诱导的MDA 积累和相应的膜脂过氧化作用,最终提高烟草幼苗的耐冷性。4种化学调控剂处理提高烟草幼苗耐冷性的程度不同,在本研究中以SA 综合作用效果最好。由于SA 可以诱发植物对生物胁迫和非生物胁迫的多 种抗性[16,24-25,30],因 此 进 一 步 弄 清SA 提 高 植 物抗逆性的生化和分子机制将会有重要的理论和实际意义。
[1] LIU Y(刘 影),ZHAO Y(赵 玉),ZHANG W(张 维).Effects of exogenous Ca2+on physiological and biochemical characteristics of cotton seedlings under low temperature stress[J].Journal of Anhui Agricultural Sciences(安徽农业科学),2010,38(8):3 955-3 956,3 959(in Chinese).
[2] LIU Y F(刘玉凤),GAO X Q(高晓倩),QI M F(齐明芳),et al.Effect of calcium on production and accumulation of photosythate in tomato under low night temperature stress[J].Jiangsu Journal of Agricultural Sciences(江苏农业学报),2012,28(4):828-834(in Chinese).
[3] 谭 伟.外源CaCl2提高烟草耐热性的研究[D].山东泰安:山东农业大学,2009.
[4] LI B ZH(李保珠),ZHAO X(赵 翔),AN G Y(安国勇).Recent advances in research of gibberellin[J].Chinese Agricultural Science Bulletin(中国农学通报),2011,27(1):1-5(in Chinese).
[5] LIU X J(刘晓静),GUO L F(郭凌飞),LI M(李 鸣).Effect of salicylic acid on sugarcane seeding stage under low temperature stress[J].Chinese Agricultural Science Bulletin(中国农学通报),2011,27(05):265-268(in Chinese).
[6] DAW B D,ZHANG L H,WANG Z Z.Salicylic acid enhances antifungal resistance to Magnaporthe griseain rice plants[J].Australasian Plant Pathology,2008,37:637-644.
[7] 王 丽.外源氯化钙、水杨酸对不同葡萄品种抗旱性的影响[D].乌鲁木齐:新疆农业大学,2005.
[8] WANG Y,YANG Z M,ZHANG Q F,et al.Enhanced chilling tolerance in Zoysia matrella by pre-treatment with salicylic acid,calcium chloride,hydrogen peroxide or 6-benzylaminopurine[J].Biologia Plant Arum.,2009,53(1):179-182.
[9] CONRATH U,KLEDDIG D F,BACHMAIR A.Tobacco plants perturbed in the ubiquitin-dependent protein degradation system accumulate callose,saliylic acid,and pathogenesis-related protein 1[J].Plant Cell Reports,1998,17:876-880.
[10] 胡龙兴.漂浮育苗技术改良对烤烟生长发育及生理特性影响的研究[D].长沙:湖南农业大学,2006.
[11] PU K(普 匡),MA J B(马家斌),TIAN W H(田旺海).Effects of paclobutrazol with different concentration on the quality of tobacco seedlings[J].Ningxia Journal of Agriculture and Forestry Science and Technology(宁夏农林科技),2011,52(12):20-21,23(in Chinese).
[12] ZHOU R(邹 焱),SU Y R(苏以荣).Effects of plant growth regulators on tobacco growing and metabolizing[J].Soil and Fertilizer Sciences in China(中国土壤与肥料),2006,5:1673-6257(in Chinese).
[13] CUI C(崔 翠),LI J K(李君可),ZHOU Q Y(周清元),et al.Study on physiological ecological response of flue-cured tobacco seedlings in temperature stress[J].Journal of Agricultural Mechanization Research(农机化研究),2012,1(1):185-189(in Chinese).
[14] ZHENG Y张 燕FANG L方 力LI T F李天飞et al.Effect of Caon activities of some enzymes in tobacco sccdlings under cold stress[J].Chinese Bulletin of Botany(植物学通报),2002,19(3):342-347(in Chinese).
[15]YANG X J(杨筱静).The role of salicylic acid in plant adversity stress were reviewe.Review of the role of salicylic acid in plant abiotic stress[J].Auhui Agricultural Science Bulletin(安徽农学通报),2009,15(17):47-51(in Chinese).
[16] YING Q Y(殷全玉),ZHANG L J(张利军),KE Y S(柯油松),et al.Effects on salicylic acid soaking germination rate and seedling cold resistance and some physiological biochemical index related in tobacco seeds at low temperature[J].Plant Physiology Communications(植物生理学通讯),2007,2(43):189-190(in Chinese).
[17] 赵世杰,李德全.现代生理学实验指南[M].北京:科学出版社,2004:305-306.
[18] 王学奎.植物生理生化实验原理和技术(第2版)[M].北京:高等教育出版社,2006,5:134-136.
[19] KE X(柯 学),LI J Y(李军营),LI X Y(李向阳),et al.Effects of different light quality on growth and photosynthesis of tobaccco(Nicotiana tabacum L.)leaves[J].Plant Physiology Journal(植物生理学报),2011,47(5):512-520(in Chinese).
[20] XU J(徐 娟),HUANG J(黄 洁).Investigation and evaluation of seedling rate and plant height on cassava germplasm atlow environmental temperature[J].Guangdong Agricultural Sciences(广东农业科学),2013,1:16-18,10(in Chinese).
[21] LIANG Y(梁 颖),LI J N(李加纳).The varietal difference of tolerance to low light intensity in rape(Brassica napus L.)plants[J].Acta Agronomica Sinica(作物学报),2004,4(4):360-364(in Chinese).
[22] XU S C,LI Y P,HU J,et al.Responses of antioxidant enzymes to chilling stress in tobacco seedlings[J].Agricultural Sciences in China,2010,9(11):1 594-1 601.
[23] MOU F CH(牟凤臣),YAN P(闫 平),CHANG Q SH(常全生).Preliminary study on the high-yield property of straight-spike rice Songgeng 3[J].Heilongjiang Agricultural Sciences(黑龙江农业科学),2000,1:21-22(in Chinese).
[24] ZHANG R(张 蕊),GONG SH F(龚守富),LI K F(李 可凡),et al.Effects of salicylic acid on photosynthesis of rice seedlings under chilling stress[J].Hubei Agricultural Sciences(湖北农业科学),2012,51(5):883-886,876(in Chinese).
[25] DENG SH Y(邓世媛),CHEN J J(陈建军),LUO F M(罗福命),et al.Effects of exogenous salicylic acid on antioxidant metabolism of flue-cured tobacco under low temperature stress[J].Tobacco Science &Technology(烟草科技),2012,(2):71-74(in Chinese).
[26] DIAO Y(刁 艳),YU X H(于锡宏),JIANG X M(蒋欣梅).Effects of exogenous substance on membrane lipid peroxidation in tomato seedlings under chilling stress[J].Journal of Northeast Agricultural University(东 北 农 业 大 学 学 报),2008,39(5):44-47(in Chinese).
[27] CAI H(蔡 汉),LI W D(李卫东),CHEN Y(陈 颖),et al.Effects of salicylic acid pretreatment on photosynthesis and its related physiological parameters in jasmine(Jasminun sambac)seedlings under cold stress[J].Journal of China Agricultural University(中 国 农 业大学学报),2007,12(5):29-33(in Chinese).
[28] SONG G SH(宋广树),SUN L(孙 蕾),YANG CH(杨 春).The effect of low temperature treatment on root activity in rice seedling period in Jilin Province[J].Chinese Agricultural Science Bulletin(中国农学通报),2012,28(3):33-37(in Chinese).
[29] RUAN SH J(阮淑洁),ZHU SH D(朱世东),SHAN G L(单国雷),et al.Effects of exogenous material on resistance of seedling of tomatoto chilling injury[J].Auhui Agricultural Science Bulletin(安徽农学通报),2011,17(11):46-47,54(in Chinese).
[30] JANE L,BINGRU H.Effects of abscisic acid,salicylic acid,ethylene and hydrogen peroxide in thermotolerance and recovery foa creeping bentgrass[J].Plant Growth Regulation,2005,47(17):17-28.
[31] TSONKO T,VIOLETA V,KATYA G,et al.Low temperature enhances photosynthetic down-regulation in French Bean(Phaseolus vulgaris L.)plants[J].Annals of Botany,2003,91:343-352.
[32] ZHANG S W,MIAO F,WANG C F.Low temperature wheat germplasm and its leaf photosynthetic traits and structure characteristics[J].Progress in Natural Science,2004,14(6):483-488.
[33] SHAO G.Q,HUANG H,HONG S.Q,et al.Surface XPS-investigations of tobacco leaves treated with low-temperature plasma[J].Nuclear Science and Tecchniques,2006,17(4):212-216.
[34] JEHAN B,ASGHARI B,PERER D.The role of abscisic acid and low temperature in chickpea(Cicer arietinum)cold tolerance.II.Effects on plasma membrane structure and function[J].Journal of Experimental Botany,2006,57(14):3 707-3 715.
