携病毒马铃薯茎尖分化成苗与脱毒率检测
2015-07-04冯光惠杜虎平李夏隆亢福仁
冯光惠,杜虎平,李夏隆,亢福仁
(榆林学院 生命科学学院,陕西榆林719000)
脱除马铃薯病毒和纺锤块茎类病毒(以下简称类病毒)主要采用茎尖组织培养法,并结合热处理[1]、低温疗法[2]和病毒唑法[3]等提高脱毒效果。其中,热处理结合茎尖组织培养法是一种应用较广的马铃薯脱毒方法,在葡萄、草莓和苹果等植物上也有报道。但是,由于不用植物或同一植物不同品种基因型和生理特性的差异,茎尖分化成苗的难易程度也不一样。笔者以盖琼辉等[4]、Iqbal H 等[5]研究的马铃薯茎尖分化成苗培养基作为参考,在同一培养基上对‘克新1号’、‘夏波蒂’、‘费乌瑞它’、‘陇薯3号’、‘布尔班克’、‘青薯9号’、‘早大白’、‘冀张薯8号’等不同品种的茎尖培养后发现,‘夏波蒂’马铃薯的茎尖分化成苗最难,成苗率仅为5%~10%,茎尖培养30d后仍以形成疏松的愈伤组织为主,成苗所需时间相对其他马铃薯品种也最长。近年来,王娟等[6]通过组织培养研究了不同茎尖大小、不同浓度和配比的细胞分裂素和生长素对脱毒效果的影响;于仙萍等[7]研究了采用不同处理方法对N88和D575马铃薯茎尖分化成苗率的影响;蒋瑜等[8]筛选了B13-6马铃薯茎尖脱毒的最佳培养基及影响因素;Aleksandar等[9]、Mutasim 等[10]分别研究了马铃薯茎尖分化成苗的培养基筛选及脱毒过程。但是,国内外关于‘夏波蒂’马铃薯离体再生成苗的文献报道较少[11-13],未见‘夏波蒂’马铃薯茎尖分化成苗及病毒检测的报道。本研究针对‘夏波蒂’马铃薯茎尖分化成苗率低,以热处理结合茎尖剥离脱除病毒和类病毒为目标,筛选茎尖分化成苗最适宜的培养基,并通过RT-PCR 方法检测再生苗病毒和类病毒的脱毒率,为脱毒苗扩繁和种薯繁育奠定基础。
1 材料和方法
1.1 材 料
采集田间疑似带毒马铃薯植株的块茎,低温休眠后,室温暗处催芽,消毒后接种在MS固体培养基上培养,筛选成活苗扩繁,从而建立马铃薯无菌苗体系。用RT-PCR 方法检测并筛选分别含有3 种病毒(PVX、PVY、PLRV)和纺锤块茎类病毒(PSTVd)的2种材料,由本实验室保存。
根据GenBank数据库上PVX、PVY、PLRV 的CP基因序列和PSTVd 全基因组序列,利用软件Primer 5设计4对特异引物(表1)。
1.2 方 法
1.2.1 热处理 取生长至高约1~2cm 的马铃薯无菌苗,在植物培养箱内升温1℃/d驯化20d左右,然后38℃/4h、22℃/12h光照培养,光照强度为3 000lx,18℃/8h暗培养,变温热处理4周以钝化病毒。
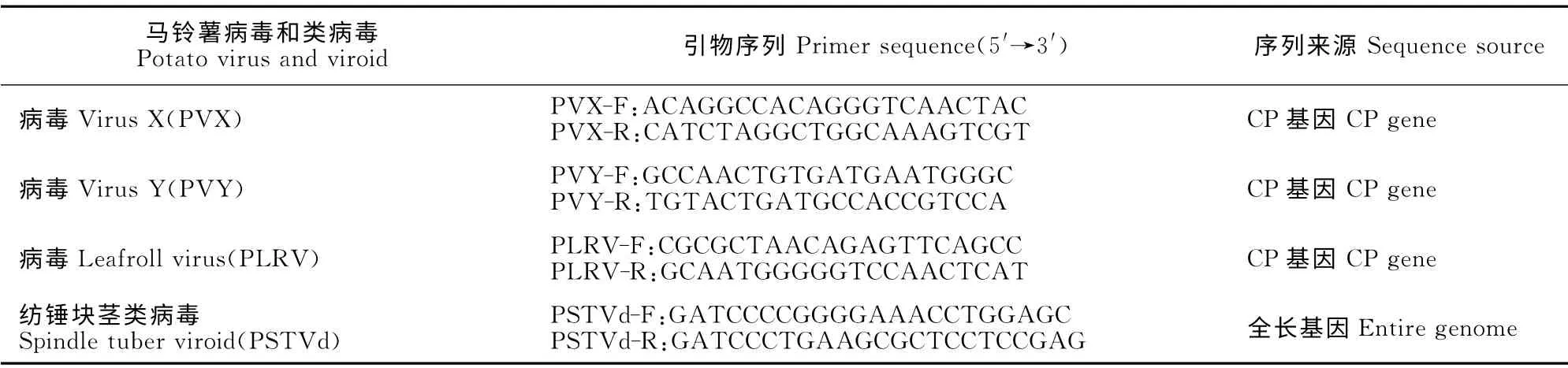
表1 RT-PCR检测所用引物Table 1 The primer pairs for detection
1.2.2 培养基组成 以MS为基本培养基,添加不同质量浓度配比的植物生长调节剂,组成24种培养基(表2),蔗糖30g/L,卡拉胶5g/L,pH 5.8。培养基及不同植物生长调节剂所含药品,均购自北京康贝斯生物科技有限公司。
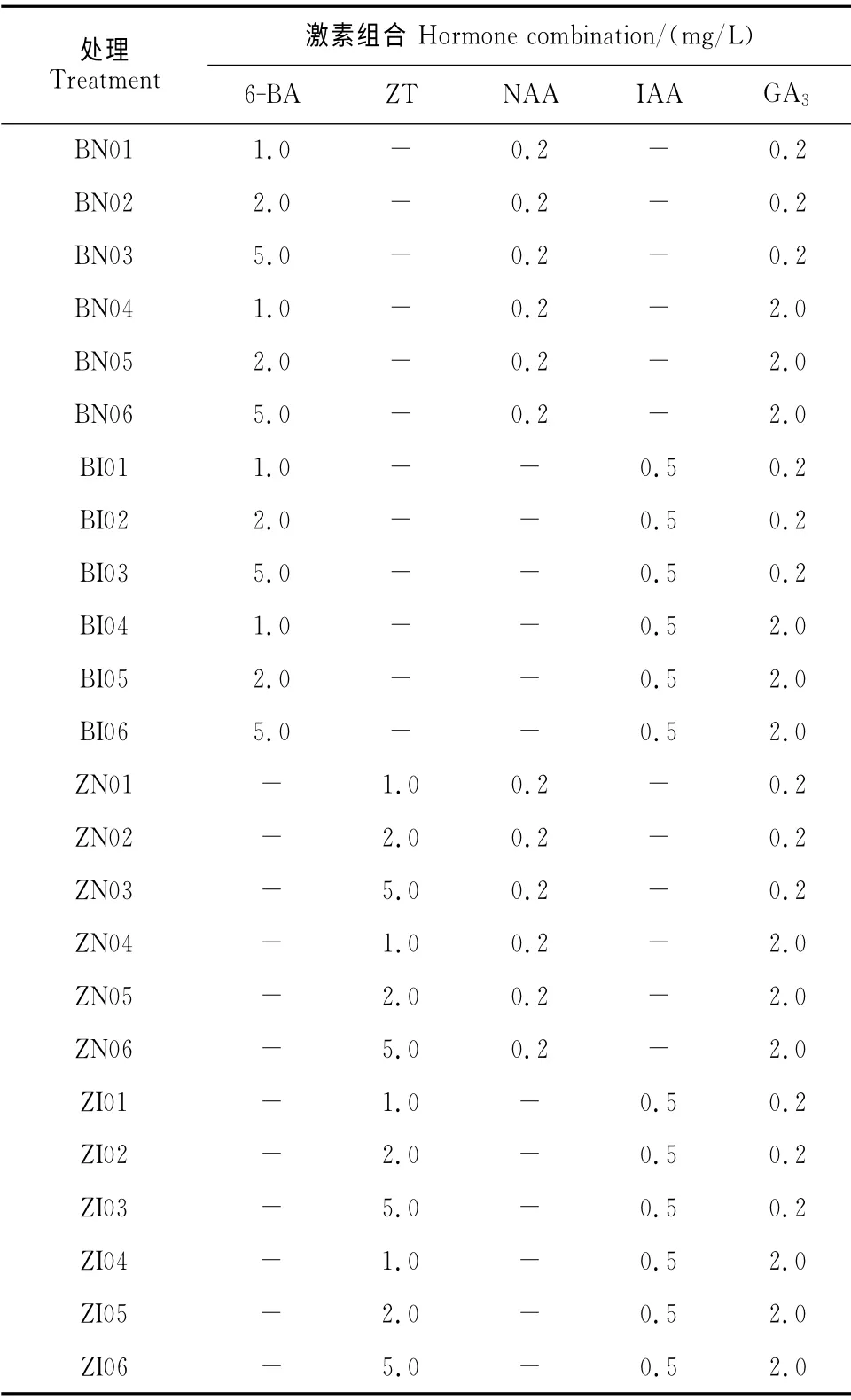
表2 不同激素组合的培养基Table 2 The culture media with different hormone combinations
1.2.3 茎尖剥离与接种 剪取热处理后长势较好的无菌苗(部分扩繁无菌苗因耐热差而长势弱或死亡),以注射器针代替解剖针,在40倍体视显微镜下进行茎尖剥离。因剥离茎尖越大,成活率越高,但脱毒率低,为提高再生苗的脱毒率,试验全部剥离带1个叶原基的茎尖,茎尖大小约0.1~0.2 mm,壮苗茎尖稍大,弱细苗茎尖稍小。培养温度为22℃,光照时间为16h/d,光照强度为3 000lx。
为降低污染率,每试管只接种1个茎尖,每处理培养基接种80个茎尖。10d后观察并记录茎尖生长情况,30d后统计茎尖愈伤组织诱导率和分化成苗率。
愈伤组织诱导率(%)=形成愈伤组织数/接种茎尖个数×100%
分化成苗率(%)=分化成苗数/接种茎尖个数×100%
1.2.4 RT-PCR 检测 为检测马铃薯茎尖剥离再生苗病毒和类病毒的脱除情况,随机挑选热处理前携带3种病毒(PVX、PVY、PLRV)且茎尖剥离分化后长势良好的再生苗36株,同时挑选热处理前携带类病毒(PSTVd)且茎尖剥离分化后长势良好的再生苗24株,扩繁2 代后分别以RT-PCR 法进行病毒检测。
Trizol法提取马铃薯再生苗叶片总RNA,反转录合成cDNA,PCR 分别扩增不同病毒和类病毒的目的基因片段,PCR 产物经1.5%琼脂糖凝胶电泳检测。病毒检测的Trizol试剂购自invitrigen 公司,cDNA 合成试剂盒、TaqDNA聚合 酶、dNTP、琼脂糖等购自北京全式金生物科技有限公司。
PCR 反应体系包含模板DNA 3μL,正向(F)引物1μL,反向(R)引物1μL,10×PCR buffer 5 μL,2.5mmol/L dNTPs 4μL,TaqDNA 聚合酶1 μL,加ddH2O 至50μL。
PCR 反应程序为94℃预变性5 min;94℃变性30s,PVX、PSTVd 50℃(PVY、PLRV 59℃)退火30s,72℃延伸30s,35个循环;最后72℃延伸10min。
预期PVX、PVY、PLRV 的CP基因序列和PSTVd全基因组序列的扩增片段大小分别为620、400、336和251bp。引物由南京金斯瑞生物科技有限公司合成,用灭菌TE(pH 8.0)稀释至浓度为10 μmol/L。
2 结果与分析
2.1 6-BA 与NAA 及IAA 激素组合对马铃薯茎尖分化成苗的影响
在细胞分裂素6-BA 和生长素NAA 的组合中(图1),处理BN06的茎尖愈伤组织诱导率最低,为78.75%,分化成苗率最高,为11.25%;BN01 茎尖愈伤组织诱导率最高,达92.5%,但分化成苗率最低,仅6.25%。当NAA 和GA3浓度一定时,6-BA浓度(1.0~5.0 mg/L)与茎尖分化成苗成正相关,而与愈伤组织诱导成负相关;当6-BA 和NAA 浓度一定时,低浓度(0.2mg/L)、较高浓度(2.0mg/L)GA3能提高愈伤组织诱导率,而分化成苗率则降低。
在6-BA 与IAA 组合的培养基中(图2),处理BI06茎尖愈伤组织诱导率最低,为71.25%,而分化成苗率最高,为15%;BI01茎尖愈伤组织诱导率最高,为80.0%,而分化成苗率则较低,仅7.5%。从图1、2中发现,在NAA/IAA和GA3浓度一定时,6-BA 浓度(1.0~5.0mg/L)与茎尖分化成苗成正相关,而与愈伤组织的诱导成负相关;在6-BA 和GA3浓度一定时,IAA(0.5 mg/L)较NAA(0.2 mg/L)组合的培养基,茎尖的愈伤组织诱导率降低,分化成苗率则提高。
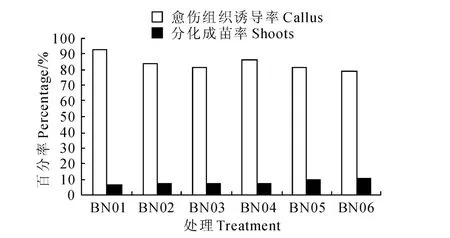
图1 6-BA 与NAA 激素组合对马铃薯茎尖分化成苗的影响Fig.1 The influence of potato meristem differentiation seedling by 6-BA and NAA hormone combinations

图2 6-BA 与IAA 激素组合对马铃薯茎尖分化成苗的影响Fig.2 The influence of potato meristem differentiation seedling by 6-BA and IAA hormone combinations
2.2 ZT与NAA 及IAA激素组合对马铃薯茎尖分化成苗的影响
在ZT 与NAA 组合的培养基中(图3),茎尖愈伤组织诱导率最高是ZN01处理,最低是ZN06,分别为77.5%和70.0%,二者差异不明显;ZN04培养基的茎尖分化成苗率最高,为26.25%,ZN03分化成苗率最低,为12.5%。从图3可以看出,当NAA和GA3浓度一定时,ZT 浓度(1.0~5.0 mg/L)与愈伤组织的诱导、茎尖分化成苗均成负相关,这与图1、2中6-BA 浓度(1.0~5.0mg/L)的作用明显不同。表明ZT 浓度太高会影响茎尖愈伤组织的诱导和茎尖分化成苗。在ZT 和NAA 浓度一定时,高浓度(2.0mg/L)、较低浓度(0.2 mg/L)GA3的作用明显,能显著提高茎尖分化成苗率。

图3 ZT 与NAA 激素组合对马铃薯茎尖分化成苗的影响Fig.3 The influence of potato meristem differentiation seedling by ZT and NAA hormone combinations
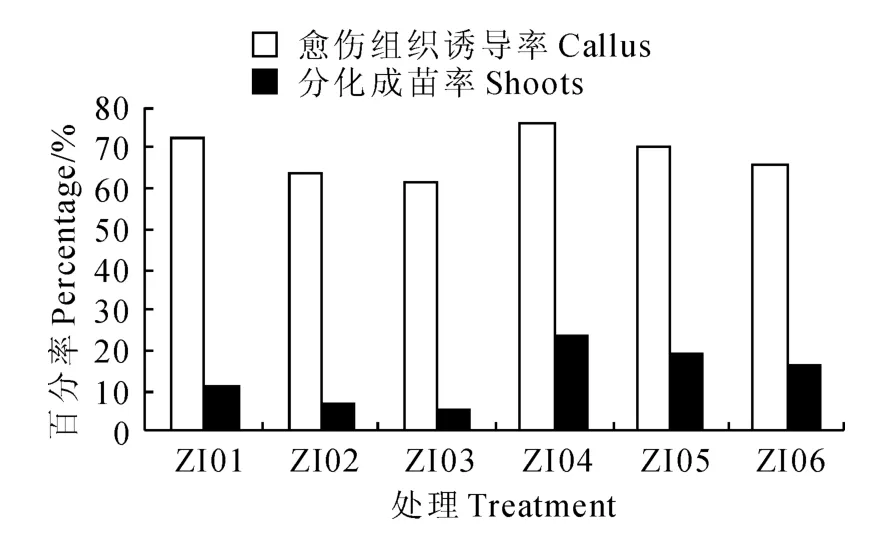
图4 ZT 与IAA 激素组合对马铃薯茎尖分化成苗的影响Fig.4 The influence of potato meristem differentiation seedling by ZT and IAA hormone combinations
在ZT 与IAA 组合的培养基中(图4),处 理ZI 03茎尖的愈伤组织诱导率和分化成苗率均最低,分别为61.25%、5%;处理ZI04的茎尖愈伤组织诱导率和分化成苗率均最高,分别为76.25%、23.75%。在IAA 和GA3浓度一定时,ZT 浓度(1.0~5.0mg/L)表现出与图3中类似的作用,即与愈伤组织的诱导、茎尖分化成苗均成负相关。高浓度(2.0mg/L)GA3与前3种组合(图1~3)的作用相同,均能促进茎尖分化成苗率,表明GA3(2.0 mg/L)是促进‘夏波蒂’马铃薯茎尖分化成苗较为合适的浓度。由图3 和图4 比较后发现,在ZT 和GA3的浓度一定时,虽然IAA(0.5mg/L)较NAA(0.2mg/L)能抑制愈伤组织的诱导,但并没有提高茎尖分化成苗率,反而略有下降,表明ZT 与NAA组合比ZT 与IAA 组合的茎尖分化成苗效果好。
由图1~3中6-BA 与ZT 对‘夏波蒂’马铃薯茎尖分化成苗率的比较后发现,ZT 较6-BA 对愈伤组织的诱导不利,但更有利于茎尖分化成苗。ZN04培养基的分化成苗率是26.25%(图3),ZI04 培养基的分化成苗率是23.75%(图4),而BN04培养基的分化成苗率是7.5%(图1),BI04 培养基的分化成苗率是10%(图2),6-BA 与ZT 的作用差异明显。所以,在本试验4类组合的24种培养基中,最适合‘夏波蒂’马铃薯茎尖分化成苗的培养基是处理ZN04,即MS+ZT1.0 mg/L+NAA 0.2 mg/L+GA32.0mg/L。
2.3 马铃薯茎尖分化成苗过程
在4类组合24种培养基中,从茎尖分化成苗过程来看,10d后即能诱导形成浅绿色、米粒大小的愈伤组织,随着培养时间的延长,愈伤组织逐渐增大,30~40d达到稳定状态,以后逐渐开始分化芽和根,55~70d时可生长为完整的马铃薯再生苗,但不同培养基上生长的再生苗的生长势不同,其中,ZN04(图5,a)和ZI04(图5,b)培养基上生长的再生苗叶色浓绿,根系发达,茎干生长健壮,二者均为正常组培苗;而BN03(图5,c)培养基上生长的再生苗尽管叶色正常,但叶片肿胀下垂,形成根系也少,BI03再生苗(图5,d)没有形成根系,叶色失绿,愈伤组织偏大,二者均为弱化组培苗。与其他马铃薯品种相比,‘夏波蒂’马铃薯开始分化成苗和形成完整再生苗的时间均晚15~20d。
2.4 马铃薯再生苗病毒和类病毒的RT-PCR检测
凝胶成像检测发现,马铃薯茎尖剥离脱毒前后RT-PCR 电泳条带差异明显(图6),其中,2、4、6、8泳道为脱毒前的检测结果,均扩增出不同病毒和类病毒的目的条带;3、5、7泳道和9泳道没有扩增出目的条带,表明被检测再生苗分别不含病毒PVX、PVY、PLRV 和类病毒PSTVd;部分再生苗的RTPCR 产物检测出目的条带,表明未脱除相应的病毒或类病毒。

图5 不同激素组合培养基中的茎尖分化再生苗Fig.5 The differentiation seedling of potato by different hormone combinations
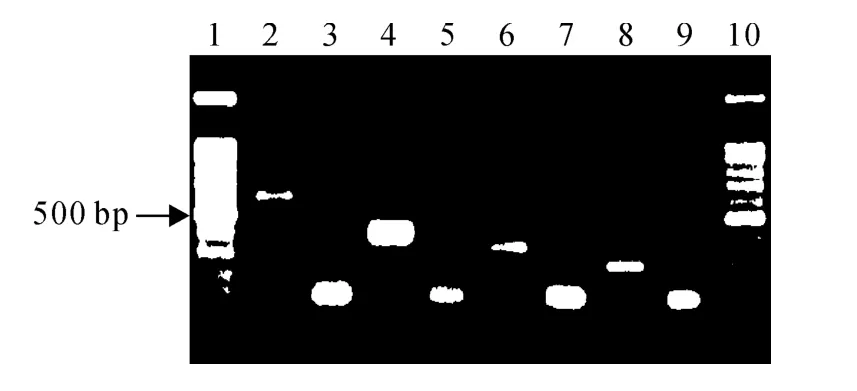
图6 马铃薯病毒和类病毒的RT-PCR检测Fig.6 The RT-PCR detection of potato virus and viroid

表3 再生苗病毒和类病毒的检测结果Table 3 The detecting result of viruses and viroid of regenerated plantlets
再生苗3种病毒PVX、PVY 和PLRV 的检测结果(表3)发现:36 株全部不携带PLRV,33株不携带PVY,25株不携带PVX。3株携带PVY 的再生苗同时携带PVX,表明X病毒较难脱除,Y 病毒次之,卷叶病毒容易脱除,且3 种病毒PVX、PVY 和PLRV 的脱毒率分别为69.4%、91.7%和100%。
再生苗类病毒PSTVd的检测结果(表3)发现:茎尖剥离脱毒后,24株再生苗中仅有2株脱除了类病毒,脱毒率仅为8.3%,表明热处理结合茎尖剥离脱毒法也很难脱除PSTVd。对再生苗中未脱除PSTVd的22株再生苗进行二次茎尖剥离,成苗后经过RT-PCR检测,又有3株脱除了PSTVd,二次脱毒率升高为20.8%,表明通过二次茎尖剥离可以提高PSTVd的脱毒率。
3 讨 论
热处理结合茎尖组织培养法是国内外普遍应用的马铃薯脱毒技术,能有效脱除危害马铃薯生长的常见病毒和类病毒,如PVX、PVY、PLRV、PVS、PVA、PVM 和PSTVd等。但是,不同病毒脱除难易差别较大,对一般马铃薯品种而言,通常PVS、PVX 较难脱除,PLRV 容易脱除,本研究的试验结果和国外一些学者[14-16]研究的结论是一致的。对于PVS、PVX 等较难脱除的病毒,主要采用是热处理、低温疗法和病毒唑法等结合茎尖组织培养法。而脱除PSTVd目前仍没有理想的方法,主要以筛选田间抗类病毒植株的块茎为主。本试验以二次茎尖剥离法脱除类病毒,提高了类病毒的脱毒率。并在检测无体细胞变异的情况下,尝试以多次茎尖剥离法来提高类病毒的脱毒效果。在试验中还发现,在脱除病毒或类病毒的过程中,提高无菌试管苗扩繁时的环境温度到25~27℃,有利于提高试管苗的生长速度,快速剥取生长旺盛的茎尖分生组织,能一定程度提高脱毒率。
茎尖组织培养法是剥离茎尖生长点的分生组织,剥离茎尖大小与脱毒有直接关系,剥离茎尖大,不易脱毒,剥离茎尖小,病毒易脱除但不易成活。本试验为获得脱毒效果更好的再生苗,以带1个叶原基的茎尖为剥离对象,同时相对降低了茎尖分化成苗率,与国内多数学者剥离带1~2或2~3个叶原基的试验区别较大。
不同品种的马铃薯由于基因型和生理特性的不同,需要不同的培养基环境。不同浓度激素的筛选及浓度配比尤为重要,按一定浓度激素配比来促进马铃薯茎尖分生组织愈伤组织的诱导和分化成苗。本试验中的ZT 与6-BA 相比,能明显提高‘夏波蒂’马铃薯的茎尖分化成苗率;高浓度的GA3也能提高茎尖分化成苗率。试验同时发现,当ZT 的浓度为1.0mg/L,NAA 的浓度为0.2mg/L 与IAA 的浓度为0.5 mg/L 时,茎尖分化成苗率差异不大,所以,在ZT 和GA3浓度一定时,有待进一步试验降低NAA 或者提高IAA 的浓度,可能会筛选出茎尖分化成苗率更高的培养基。
[1]MACDONALD D M.Heat treatment and meristem culture as a means of freeing potato varieties from viruses X and S[J].PotatoResearch,1973,16(4):263-269.
[2]WANG Q C,LIU Y,XIE Y.Cryotherapy of potato shoot tips for efficient elimination of potato leaf roll virus(PLRV)and potato virus Y(PVY)[J].PotatoResearch,2006,49(2):116-129.
[3]DANCI O,ERDE L,VIDACS LIVID.Influence of ribavirin on potato plants regeneration and virus eradication[J].JournalofHorticulture,ForestryandBiotechnology,2009,12:421-425.
[4]GAI Q H(盖琼辉),WANG J CH(王季春).Study on optimization of themedium for meristem tip differerntiating into potato[J].Journal ofSouthwestAgriculturalUniversity(Nat.Sci.Edi.)(西南农业大学学报·自然科学版),2005,27(3):370-373(in Chinese).
[5]IQBAL H,AISH M,ZUBEDA C.Morphogenic potential of three potato(Solanumtuberosum)cultivars from diverse explants,aprerequisite in genetic manipulation[J].PakingJournalBotany,2005,37(4):889-898.
[6]WANG J(王 娟),WANG ZH M(汪仲敏),WANG R Y(王瑞英),etal.Influencing factors of potato meristem culture for virus elimination[J].ChinaPotato(中国马铃薯),2010,24(3):172-175(in Chinese).
[7]YU X P(于仙萍),CHEN W(陈 炜),JIN L P(金黎 平),etal.Influence of various treatments on plantlet regeneration percentage of shoot tip culture[J].ChinaPotato(中国马铃薯),2010,24(4):196-198(in Chinese).
[8]JIANG Y(蒋 瑜),ZHANG L F(张丽芳),ZHU W X(朱维贤),etal.Analysis of selection and influencing factors of medium culture in potato stem apex detoxication[J].JournalofChangjiangVegetable(长江蔬菜),2010,(4):11-13(in Chinese).
[9]ALEKSANDAR C,BRANKA V,DRAGAN V,etal.Agrobacterium-mediated transformation of two Serbian potato cultivars[J].African JournalofBiotechnology,2010,9(30):4 644-4 650.
[10]MUTASIM M K,KHADIGA G A,RASHEID S M.Callus formation and organogenesis of potato(SolanumtuberosumL.)cultivar Almera[J].JournalofPhytology,2010,2(5):40-46.
[11]LI J(李 娟),CHENG ZH H(程智慧),ZHANG G Y(张国裕).Establishment of efficient regeneration system from leaf explants of potato[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2004,24(4):610-614(in Chinese).
[12]LI J(李 娟),CHENG ZH H(程智慧),ZHANG G Y(张国裕).Study on vitro regeneration technology from stem explants of four potato cultivars[J].JournalofNorthwestSci-TechUniv.ofAgri.andFor.(Nat.Sci.Edi.)(西北农林科技大学学报·自然科学版),2006,34(3):122-126(in Chinese).
[13]GUSTAFSON V,MALLUBHOTLA S,MACDONNELL J.Transformation and plant regeneration from leaf explants ofSolanumtuberosumL.cv.‘Shepody’[J].PlantCell,TissueandOrganCulture,2006,(85):361-366.
[14]BIPASHA CHAKRAVARTY,GEFU WANG-PRUSKI.Rapid regeneration of stable transformants in cultures of potato by improving factors influenceingAgrobacterium-mediated transformation[J].AdvancesinBioscienceandBiotechnology,2010,(1):409-416.
[15]HALTERMAN D,CHARKOWSKI A,VERCHOT J.Potato,viruses,and seed certification in the USA to provide healthy propagated tubers[J].PestTechnology,2012,(S1):1-14.
[16]MAMIDALA P,SWAMY NANNA R.Efficientinvitroplant regeneration,flowering and fruiting of drawf tomato cv.Micro-Msk[J].PlantOmicsJournal,2009,2(3):98-102.
