野生烟草花粉活力与柱头可授性及繁育特性研究
2015-07-04姚志敏刘艳华戴培刚向德虎张兴伟赵韬智王志德
姚志敏,刘艳华,戴培刚,向德虎,张兴伟,赵韬智,王志德
(中国农业科学院烟草研究所/烟草遗传改良与生物技术重点开放实验室,山东青岛266001)
烟草(Nicotianatabacum)为茄科(Solanaceae)烟属植物,多为草本,少数为灌木或乔木,多为一年生,也有多年生。栽培烟草包括普通烟草和黄花烟草,起源于南美洲,而野生烟主要分布于美洲和大洋洲[1]。烟草是重要的模式植物,其染色体上有许多标记基因,是进行遗传学研究的重要材料,而且可作为生物反应器将其他作物的抗癌、抗艾滋病及其它有益人类健康的基因导入烟草,从转基因烟草中提取抗癌、抗艾滋病及其它有益物质。烟草还是重要的叶用经济作物,此外在食品和药物资源开发方面有着巨大的潜在用途。
烟草野生资源中存在着许多优异基因,如抗病抗虫和有益活性成份基因,是进行种属间远缘杂交,开展烟草种质创新、拓宽遗传背景的重要基础材料。在烟草种质资源繁殖更新过程中,我们发现大多烟草野生种结实率、发芽率等都低于栽培品种,而目前对野生烟的繁育特性研究较少,其繁殖更新主要参照栽培种的更新方法,致使有些野生种质繁殖更新困难,影响了野生种质优异基因的开发与利用,研究野生种的繁育特性对其繁殖更新、烟草种质创新以及遗传研究具有十分重要的意义[2]。
植物有性生殖过程中,有效传粉是生殖成功的基础。花粉必须在具有活力时通过有效的传粉媒介到达适宜的接受柱头才能完成传粉过程。对花粉活力及柱头可授性的研究已引起不少学者的关注,花卉、树木及药用植物等[3-6]已有大量该方面的研究报道。目前国外已有不少学者对烟草花粉管萌发伸长、花粉与柱头超微结构及亲和机制等[7-11]进行了大量研究,国内学者也已对烟草栽培种的花粉活力、授粉时期及结实性等[12-15]进行了相关研究,但对野生种花粉活力、柱头可授性及结实性的研究较少。本研究以具有代表性的繁种困难种质花烟草(N.alata)和哥西氏烟草(N.gossei)为研究对象,以栽培种K326为对照,利用TTC、联苯胺-过氧化氢法、显微观察以及人工授粉等方法,对烟草野生种的花粉活力与柱头可授性及繁育方式进行了研究,探讨烟草野生种的繁育特性,旨在为野生种的繁殖更新及开发利用提供物质基础和理论依据。
1 材料和方法
1.1 材 料
2013年10月将来源于国家烟草中期库的野生烟草种质花烟草(N.alata)、哥西氏烟草(N.gossei)以及栽培品种K326播种于中国农业科学院烟草研究所温室内,经育苗、假植、移栽管理,于烟草花期进行实验。
1.2 方 法
1.2.1 花粉活力检测 采用TTC(2,3,5-triphenyl tetrazolium chloride)法[16-17]测定花粉活力。于盛花期采集花粉,并记录当时温度,将采集的花粉撒在干洁的载玻片上,滴加1~2滴0.5% TTC溶液,搅匀后迅速盖上盖片,放入内有湿润滤纸的培养皿中,置于37℃黑暗条件下,30 min 后观察染色结果。被染成红色的为有活力的花粉,不染色或染色浅的为无活力的花粉。一个视野下的花粉活力百分比按如下公式计算:
花粉活力百分比=变红花粉数/花粉总数×100%
每个材料取10朵花,观察9个视野,花粉活力取平均值,重复6次。
1.2.2 柱头可授性检测 采用联苯胺-过氧化氢法[18-19]检测3个烟草材料的柱头可授性。于盛花期每天9:00~11:00采集20朵花,共采集4d,将柱头浸入含有联苯胺-过氧化氢反应液(1%的联苯胺∶3%的过氧化氢∶水=4∶11∶22)的凹面载玻片的凹陷处。根据联苯胺溶液呈色情况以及是否有气泡产生确定柱头可授性等级,分级标准为[19]:0级,不变色,无气泡产生,无可授性;1 级,轻微变色,有几个气泡,具有轻微可授性;2级,呈浅蓝色,有较少气泡,具有低可授性;3级,呈浅蓝色,有较多气泡,具有较低可授性;4级,呈蓝色,有大量连续小气泡,具有高可授性;5级,呈深蓝色,有连续大气泡,具有更高可授性。每个材料检测80个柱头,统计不同可授性级别的柱头数量,采用卡方检验,比较各个材料柱头可授性的差异。
1.2.3 花粉胚珠比及杂交指数 (1)花粉胚珠比P/O参考Cruden[20]的方法,取一枚刚刚开裂的花药,将花粉全部转移到装有1 mL 蒸馏水的离心管中,振荡2min后形成均匀花粉液,用移液枪吸取1 μL滴加于载玻片上,在显微镜10倍视野下观察花粉数,重复10次计数,取平均值记为m。每朵花的花粉量P=m×1000×5(烟草花朵为5 枚雄蕊)。同时取下子房置于载玻片上解剖,在显微镜10倍视野下观察并统计胚珠数O。花粉胚珠比(P/O)=每朵花的花粉量/胚珠数。每个材料重复5 次,P/O取均值。P/O<5.4时,其繁育系统为闭花受精;P/O为5.4~31.9 时,繁育系统为专性自交;P/O为31.9~244.7 时,繁育系统为兼性自交;P/O为244.7~2 588.0时,繁育系统为兼性异交;P/O为>2 588.0时,繁育系统为专性异交。
(2)杂交指数(OCI) 参考Dafni[17]的方法,测量烟草花冠直径、花朵大小,并观测开花行为。每个烟草材料测量5朵花,重复5次测量。根据花径大小、花药散粉与柱头可授期之间的时间间隔及花药与柱头的空间位置情况,分别赋值,进而估算出杂交指数OCI值并评判其繁育系统,具体为:花径<1 mm,赋值为0;1~2mm,赋值为1;2~6mm,赋值为2;>6mm,赋值为3。花药开裂散粉与柱头可授期无时间间隔,赋值为0;有时间间隔,赋值为1。花药与柱头同一高度或柱头略低于花药,可自然散粉于柱头,赋值为0;花药与柱头空间位置发生明显分离,赋值为1。杂交指数OCI值为三者累计值,OCI=0时,繁育系统为闭花受精;OCI=1时,繁育系统为专性自交;OCI=2时,繁育系统为兼性自交;OCI=3 时,繁育系统为自交亲和,有时需要传粉者;OCI=4时,繁育系统为异交为主,部分自交亲和,需要传粉者。
1.2.4 人工授粉试验 (1)不同开花天数柱头可授性检测 采用授粉套袋并统计结籽率的方法检测不同开花天数的柱头可授性,选择开花前2d的花蕾,去雄并套袋,并采集盛花期的花粉,分别在开花前2 d、1d及花后0d、1d、2d、3d、4d对已去雄的柱头授粉套袋,授粉时以柱头表层布满花粉为宜。种子成熟后及时采收并统计单果结籽率,单果结籽率=平均单果结籽数/单果胚珠数,文中简称结籽率。试验重复3 次,取均值。人工授粉在每天9:00~11:00进行,子房明显膨大时,去掉纸袋保证果实正常发育。
(2)不同烟草材料繁育方式检测 选择整齐一致的开花前2d的花蕾,做以下授粉处理,每处理设3次重复:①不做任何处理,检测自然授粉情况;②不去雄,直接单花套袋,检测自然条件下单花自交结实情况;③去雄后,不套袋,检测自然条件下异花授粉情况;④去雄后人工辅助授异株异花花粉,并套袋,检测杂交亲和性;⑤去雄后人工辅助授同株异花花粉,并套袋,检测自交亲和性;⑥去雄后不授粉,直接套袋,检测是否存在无融合生殖现象。记录结实情况,并统计出座果数与座果率。座果数即为结有种子的果实数目,座果率=座果数/试验花数。
1.3 统计方法
使用SAS 9.2 统计分析软件进行数据方差分析及卡方检验,用Excel 2007分析结果并作图。
2 结果与分析
2.1 不同烟草材料间花粉活力分析
由图1可以看出,哥西氏烟草花粉活力最高,K326略高于花烟草。对3种材料的花粉活力做方差分析,结果表明哥西氏烟草与K326、花烟草间的花粉活力差异均达显著水平,而K326与花烟草间花粉活力无显著差异。哥西氏烟草、K326与花烟草的花粉活力分别为74.9%、52.2%、45.3%。
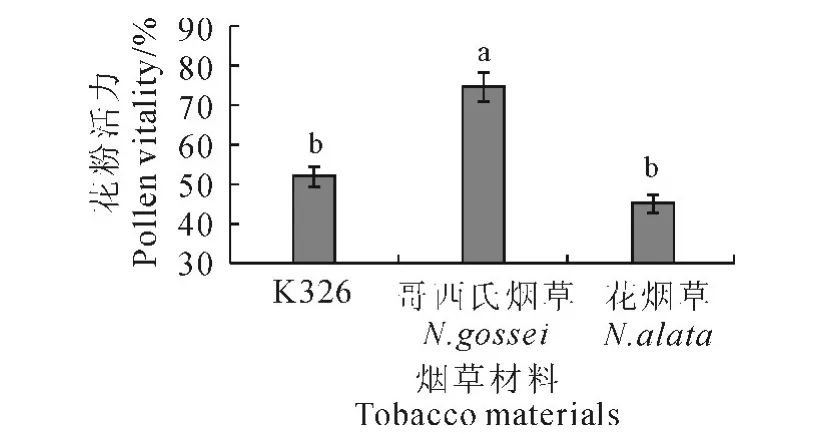
图1 不同烟草材料间花粉活力差异Fig.1 Differences of pollen viability between different tobacco resources

表1 各级柱头可授性的频率分布Table 1 Frequency distribution for grades of stigma receptivity
2.2 不同烟草材料花粉活力日变化分析
由图2可知,9:00~16:00哥西氏烟草花粉活力均高于K326和花烟草,13:00前花烟草的花粉活力高于K326,13:00~16:00K326高于花烟草。一天内3 种烟草花粉活力均出现2 个峰值,分别在13:00与15:00左右,而2种野生烟活力最高值出现在13:00 左 右,K326 最高值则在15:00左右。9:00哥西氏烟草与花烟草花粉活力达到40%以上,且上午一直保持在较高水平。12:00之前K326花粉活力一直处于较低水平,至13:00达到44.50%。温度是影响花粉活力的一个重要因素[21],气温日变化对烟草花粉活力日变化情况有一定影响。上午哥西氏烟草与K326 花粉活力随温度升高呈上升趋势,花烟草变化趋势平缓。由于午后13:00~14:00温度过高,达到40℃左右,3种烟草花粉活力均急剧下降;14:00后温度不断降低,花粉活力于14:00~15:00间有所回升,15:00~16:00再次呈现出下降的趋势。
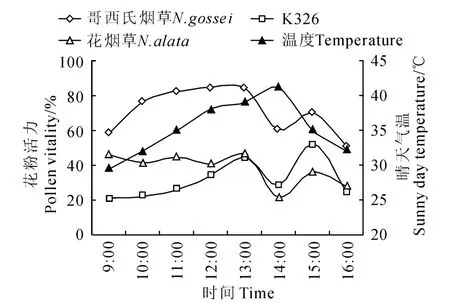
图2 不同烟草材料花粉活力及气温日变化Fig.2 The pollen viability of different tobacco resources and temperature daily change
2.3 不同烟草材料间柱头可授性分析
从表1中可知,3个烟草材料的柱头均具有可授性,且不同材料间柱头可授性有明显差异,K326柱头在低可授性3级以下有较少分布,集中分布于高可授性4和5级。花烟草柱头可授性主要分布在低可授性1、2、3级,哥西氏烟草可授性多分布在2、3级,二者均较少表现高可授性4和5 级。这说明栽培品种K326柱头可授性高,而花烟草和哥西氏烟草这2个野生种柱头可授性偏低。
运用卡方法分析不同烟草材料间的柱头可授性差异,结果如表2所示。哥西氏烟草、K326、花烟草柱头可授性的卡方检验达显著水平(P<0.01),说明3种烟草材料间的柱头可授性差异有统计学意义。K326分别与花烟草、哥西氏烟草做卡方检验,均达到显著水平,K326柱头可授性显著高于花烟草和哥西氏烟草。对2种野生烟的柱头可授性做卡方检验,P=0.585 8,未达显著水平,表明这2种野生烟的柱头可授性强弱差异不显著。
2.4 不同开花天数柱头可授性变化分析
柱头可授性在开花过程中是不断变化的,在不同开花时间分别给3种烟草授各自盛花期的花粉,结籽率随开花时间的变化可以反映柱头可授性的变化情况。开花前2d的柱头还未完全发育成熟,柱头可授性处于较低水平,3种烟草的结籽率也较低(图3)。K326开花后1d的结籽率达到最高93.94%,柱头可授性最高,随后K326 柱头可授性迅速降低。K326开花前1d至开花后1d,柱头可授性强,结籽率高,是杂交授粉的最佳时期。哥西氏烟草柱头在开花前1d已具有较高可授性,开花当天达到最高后下降,但下降趋势平缓,至开花后4d仍具有较高的柱头可授性,其柱头高出花药近5 mm,很难完成自花授粉,这样保持较长时间的柱头高可授性可以提高借助外部传粉媒介完成授粉的几率。花烟草柱头成熟较为缓慢,自开花前2d至花后1d结籽率一直较低,至开花后2d才达到较高水平,花后3d达到最高,随后迅速下降,因此花烟草的最佳授粉时间宜选在花后2~3d。

表2 不同烟草材料间柱头可授性的卡方检验Table 2 Chi-square test of stigma receptivity among different tobacco resources
2.5 花粉胚珠比P /O 与杂交指数OCI 的估算
2.5.1 花粉胚珠比P/O由表3可知,栽培品种K326单花花粉量(P)约为237 520,每朵花的胚珠数(O)约为1 440,K326 的花粉胚珠比(P/O)估算为164.85,依据Cruden[20]的标准,P/O为31.9~244.7时,繁育系统为兼性自交,故判断K326的繁育系统为兼性自交类型;野生烟花烟草花粉胚珠比P/O的估算值为821.09,其繁育系统判断为兼性异交;哥西氏烟草的花粉胚珠比P/O约为281.09,其繁育系统为兼性异交。
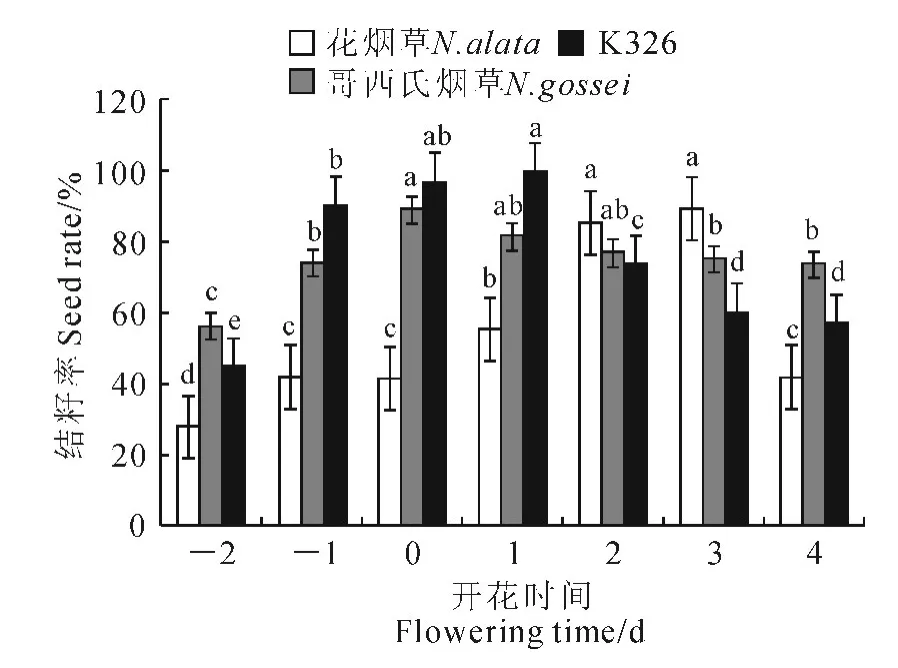
图3 开花前后不同时间授粉对烟草结籽率的影响Fig.3 Different pollination times before and after flowering influence on tobacco seed setting rate
2.5.2 杂交指数OCI试验调查可知,K326花冠直径约为3cm,大于6mm,赋值为3;在柱头可授期内花药开裂散粉,无时间间隔,赋值为0;花后雄蕊略高于雌蕊柱头,花粉可散落于柱头,开花前部分花药有散粉现象,柱头已有授粉的可能,其赋值为0。依据Dafni[17]的评判标准,K326 的OCI值累计为3,判断其繁育习性为自交亲和,但存在一定的异交现象。花烟草花径为4.5cm 左右,赋值为3;柱头可授期内有花药开裂散粉,无时间间隔,赋值为0;开花后雌蕊柱头高于花药1mm 以上,雌雄器官在空间位置上发生分离,赋值为1。花烟草的杂交指数OCI累计为4,其繁育系统评判为以异交为主,部分自交亲和,需要传粉者。哥西氏烟草花冠直径约为2.5cm,赋值为3;雌蕊柱头先于花药成熟,在柱头可授期内花药散粉,赋值为0;开花后雌蕊与雄蕊在空间位置上发生明显分离,柱头高出花药近5 mm,赋值为1。哥西氏烟草杂交指数OCI累计值为4,繁育习性以异交为主,但自交亲和。
2.6 不同烟草材料繁育特性分析
表4结果显示,花烟草、哥西氏烟草不去雄不套袋自然授粉的座果率很低,只有16.7%和13.3%,远低于栽培品种K326,去雄、套袋、同株或异株异花授粉时2种野生烟的座果率均明显提高,说明人工辅助授粉可以提高两种野生烟的座果率。花烟草、哥西氏烟草及K326在去雄不套袋的条件下有一定的结果率,说明3种烟草自然条件下均存在异花授粉现象。不去雄直接套袋时2种野生烟单花自交结实率极低甚至不结果,可能是由于自交不亲和或缺乏有效的传粉媒介造成的。哥西氏烟草人工辅助同株异花授粉即自交时座果率达到96.7%,且单果结籽率高达98.18%,说明哥西氏烟草自交亲和,单花自交不结实现象是由于其柱头与花药空间位置分离,存在传粉障碍且缺乏有效的传粉媒介而导致无法完成授粉造成的。花烟草人工辅助下的自交座果率仅有45.0%,相对于自然授粉时虽有提高,但明显低于人工辅助异株异花授粉即异交时的座果率81.5%,而且花烟草自交时的结籽率为78.74%,比自然授粉时明显提高,但低于异交时的结籽率,异交结籽率高达96.55%,说明花烟草以异交为主,自交亲和性较差,存在部分自交不亲和的现象,同时花烟草的柱头与花药存在空间传粉障碍且自然条件下缺少有效的传粉机制,致使花烟草结实性较差。栽培品种K326自然条件下的自花授粉座果率77.8%,远高于自然异花授粉座果率25.0%,说明K326以自花授粉为主,但存在自然异交现象。
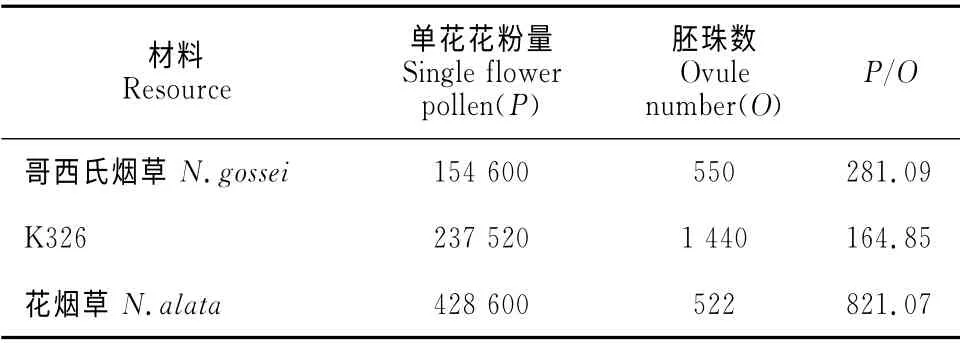
表3 花粉胚珠比胚P/OTable 3 Pollen ovule ratio P/O
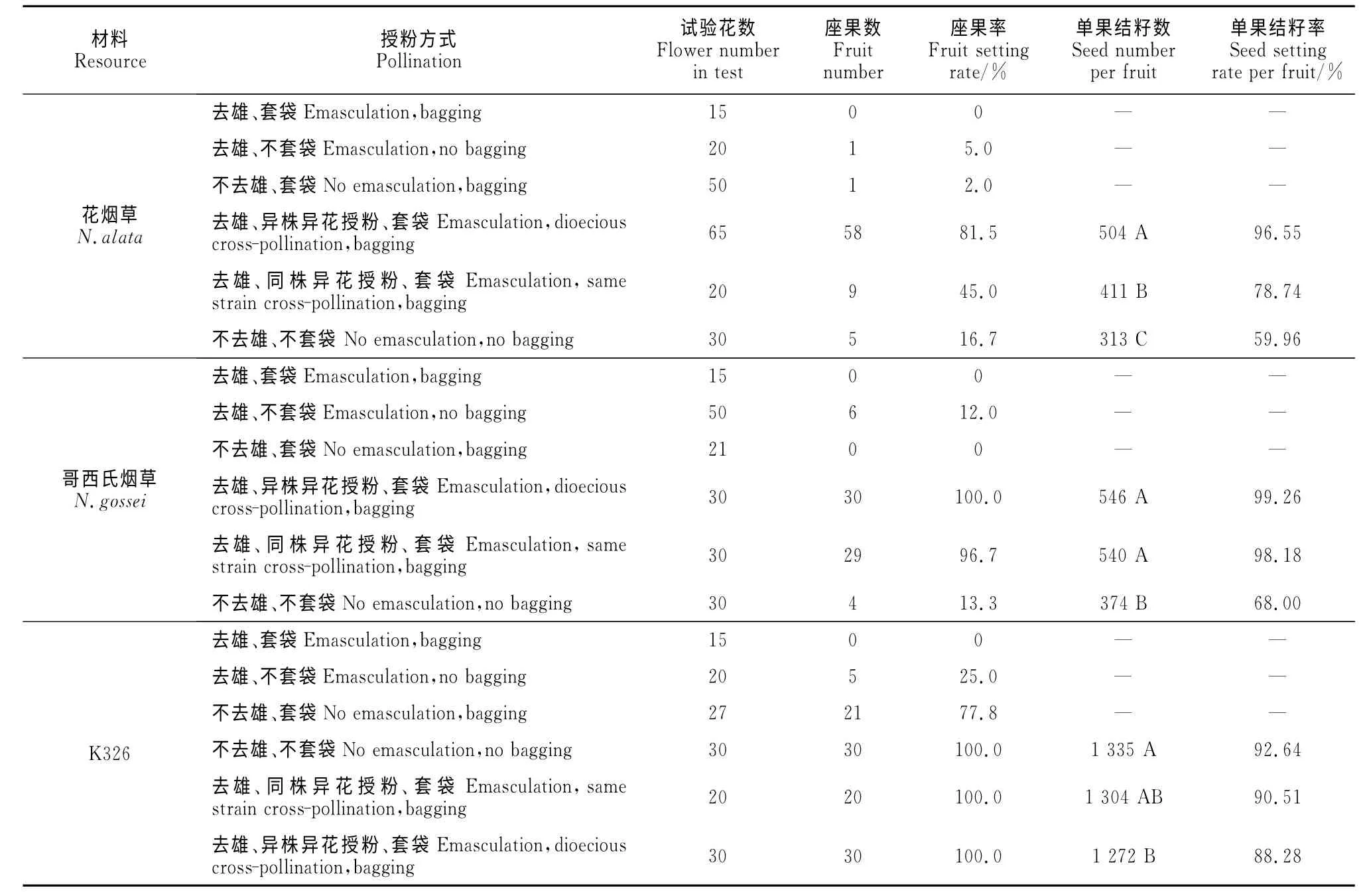
表4 3种烟草不同繁育方式下的结实率Table 4 Seed setting rate of 3tobacco resources under different breeding methods
3 讨 论
3.1 烟草花粉生活力及柱头可授性
花粉活力一方面受遗传因素的影响,表现在不同类型间、品种间的花粉活力不尽相同[12,22]。不同类型烟草间花粉活力存在差异,但结实率高的K326花粉活力没有显著高于2个野生种,所以花粉活力不是造成这两种野生烟结实性差的关键因素。花粉活力还会受到环境因素的影响,由于午后温度过高导致该时间段内烟草花粉活力下降,与汤日圣等[23]报道的高温导致水稻花粉活力降低的研究结果相符。栽培烟杂交育种时,应在13:00及15:00左右进行杂交授粉,此时花粉量充足且花粉活力较高,可以更高效地进行授粉工作。而野生烟哥西氏烟草与花烟草的花粉在上午已有较高活力,对其人工授粉可选在上午进行。
柱头具有可授性是植物生殖成功的前提保证[24],而不同植物的柱头可授性不同,不同品种间可授性[25]也存在一定的差异。烟草柱头为湿柱头,表面分泌物可以粘住花粉,与柱头可授性相关[26-27],野生烟及栽培烟亲缘关系较远,柱头分泌物差异较大,造成可授性存在差异。繁育力除了与花粉活力有关外,还明显受到柱头可授性的影响,K326柱头可授性高于花烟草、哥西氏烟草,可能是K326相较于两种野生烟结实性好的一个原因。此外,柱头可授性与开花时间有关[28],开花时间影响柱头的成熟度,所以对可授性具有明显影响,烟草柱头可授性即随开花时间呈先升后降的变化趋势。柱头可授期及最佳授粉时期在植物生殖过程中十分重要,很大程度上影响着传粉率[29],而且确定最佳授粉时期有助于建立高效的杂交或自交技术。花烟草、哥西氏烟草及K326在开花前2d至花后4d均具有柱头可授性,但可授性强弱发生着变化,选择最佳授粉时期进行授粉可以提高结实率。野生烟花烟草在花后2~3d才有较强的柱头可授性,最佳授粉时间宜选在花后2~3d,哥西氏烟草自开花前1d至花后4d保持着较高的可授性,是其授粉的适宜时期,而栽培品种K326宜选在开花前1d至花后1d进行授粉。
3.2 烟草繁育习性
花粉胚珠比P/O和杂交指数OCI及授粉试验均表明K326繁育系统为兼性自交,以自花授粉为主,有一定的异交率,这与颜洪合[15]通过套袋自交与自然授粉的方法对红花烟草的研究结果一致。烟草栽培种繁殖更新时应采用套袋自交以防止由于昆虫或风力传粉造成的品种混杂。P/O与OCI表明花烟草、哥西氏烟草以异交为主,部分自交亲和,但需要传粉者。在自然授粉条件下,花烟草、哥西氏烟草开花后自然脱落,座果率极低,从授粉试验结果来看造成这两种野生烟结实性差的原因有所差别:花烟草的柱头略高于花药,倾向于异交,但部分花朵的花药散粉后可接触到柱头下沿,可以完成自花授粉,所以花烟草结实性差不仅因为柱头与花药的空间分离,主要由其部分自交不亲和造成。而哥西氏烟草的柱头明显高于花药,存在自花授粉的空间障碍,在外界传粉媒介效率极低的自然条件下无法完成授粉受精,就会导致自然授粉结实率低的现象。所以野生烟花烟草、哥西氏烟草繁殖更新时需要建立有效的传粉机制如增加传粉昆虫及人工辅助授粉等提高异交率,且针对花烟草的自交不亲和可以采取蕾期授粉、混合授粉及施用生长调节物质或其它化学物质等方法[30-32]以提高其结实率。另外,两种野生烟胚珠数仅约为K326的1/3,对繁殖更新中采收足够量种子增加困难,故种子成熟后应及时采收。
[1]蒋予恩.中国烟草品种资源[M].北京:中国农业出版社,1997:12-13.
[2]LIU Y H(刘艳华),WANG ZH D(王志德),MU J M(牟建民),etal.Theories and techniques of propagating and regeneration for tobacco germplasm resource[J].JournalofPlantGeneticResources(植物遗传资源学报),2009,10(4):618-622(in Chinese).
[3]ZHONG G CH(钟国成),ZHANG L(张 利),YANG R W(杨瑞武),etal.Pollen viability and stigma receptivity ofSalviamiltiorrhizaand its relative[J].ChinaJournalofChineseMateriaMedica(中国中药杂志),2010,35(6):686-689(in Chinese).
[4]YANG X L(杨秀莲),XIANG Q B(向其柏).Pollen vitality and stigma receptivity ofOsmanthusfragrans[J].ForestryScienceandTechnology(林业科技开发),2007,21(3):22-25(in Chinese).
[5]LIU L D(刘林德),ZHANG P(张 萍),ZHANG L(张 丽),etal.Pollen viability,stigma receptivity and pollinators ofWeigelaflorida[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2004,24(8):1 431-1 434(in Chinese).
[6]XU R(徐 荣),ZHU W CH(朱维成),CHEN J(陈 君),etal.Pollen viability and stigma receptivity ofCistanchedeserticola[J].China JournalofChineseMateriaMedica(中国中药杂志),2011,36(3):307-310(in Chinese).
[7]LUSH W,GRISER F,WOLTERS M.Directional guidance ofNicotianaalatapollen tubesinvitroand on the stigma[J].PlantPhysiol.,1998,118(3):733-741.
[8]KANDASAMY M,KRISTEN U.Developmental aspects of ultrastructure,histochemistry and receptivity of the stigma ofNicotianasylvestris[J].Ann.Bot.,1987,60:427-437.
[9]CAI G,OVIDI E,ROMAGNOLI S,etal.Identification and characterization of plasma membrane proteins that bind to microtubules in pollen tubes and generative cells of tobacco[J].PlantCellPhysiol.,2005,46:563-578.
[10]LUSH W,CLARKE A.Observations of pollen tube growth inNicotianaalataand their implications for the mechanism of self-incompatibility[J].SexPlantReprod,1997,10:27-35.
[11]GOLDMAN M,GOLDBERG R,MARIANI C.Female sterile tobacco plants are produced by stigma-specific cell ablation[J].EMBOJ.,1994,13:2 976-2 984.
[12]LIAO X F(廖雪芳),ZHU L SH(朱列书),YUE L Y(岳伦勇).Study on pollen viability of different tobacco varieties[J].ModernAgriculturalScienceandTechnology(现代农业科技),2013,14:14-18(in Chinese).
[13]ZHENG Y Y(郑昀晔),SUO W L(索文龙),MA W G(马文广),elal.Effects of pollination at different flowering stages on the tobacco pollination and seed quality[J].JournalofAnhuiAgri.Sci.(安徽农业科学),2012,40(26):12 795-12 796,12 902(in Chinese).
[14]ZHONG Y D(钟玉德),PENG Y D(彭耀东),SHAN D D(单丹丹),elal.Study on seed fructification characteristics of flue-cured tobacco[J].JournalofAnhuiAgri.Sci.(安徽农业科学),2014,42(13):3 839-3 841(in Chinese).
[15]YAN H H(颜合洪),CHEN C(陈 灿),JIN X M(金小马),elal.Observations on the cross and selfcross fruit rate of tobacco[J].JournalofHunanAgriculturalUniversity(湖南农业大学学报),1998,24(6):442-444(in Chinese).
[16]WANG N(汪 妮),ZHANG ZH X(张志轩),DONG Z M(董自梅).Studies on testing methods of the pollen vigour of Chinese chive[J].JournalofChangjiangVegetables(长江蔬菜),2009,(2):53-55(in Chinese).
[17]DAFNI A.Pollination Ecology[M].New York:Oxford Univ.Press,1992:59-89.
[18]LIU L D(刘德林),ZHANG H J(张洪军),ZHU N(祝 宁),elal.Pollen viability and stigma receptivity ofEleutherococcussenticosus(araliaceae)[J].BulletinofBotanicalResearch(植物研究),2001,3:375-379(in Chinese).
[19]马玉心.兴安鹿蹄草的传粉生态学研究[D].哈尔滨:东北农业大学,2007.
[20]CRUDEN R W.Pollen ovule ratios:A conservative indicator of breeding systems in flowering plants[J].Evolution,1977,31(1):32246.
[21]LI N(李 宁),SU SH CH(苏淑钗),JIN L J(靳利军),elal.Study the fit temperature and humidity in the growth of the hazel pollen[J].ChineseAgriculturalScienceBulletin(中国农学通报),2008,24(3):116-120(in Chinese).
[22]HAO R J(郝瑞娟),WANG ZH F(王周锋),MU D(穆 鼎).Study on different methods of the pollen vitality ofLilium[J].Northern Horticulture(北方园艺),2008,(11):95-97(in Chinese).
[23]TANG R SH(汤日圣),ZHENG J CH(郑建初),ZHANG D D(张大栋),etal.Effects of high temperatures on pollen vitality and seed setting of different rice varieties[J].JiangsuJ.ofAgr.Sci.(江苏农业学报),2006,22(4):369-373(in Chinese).
[24]LUO CH W(罗长维),LI K(李 昆),CHEN Y(陈 友),elal.Pollen viability,stigma receptivity and reproductive features ofJatropha curcasL.(Euphorbiaceae)[J].Acta.Bot.Boreal.-Occident.Sin.(西北植物学报),2007,27(10):1 994-2 001(in Chinese).
[25]HONG Y(红 雨),LIU Q(刘 强),HAN L(韩 岚).Pollen vitality and stigma receptivity ofPaeonialactifloraPall[J].Guihaia(广西植物),2003,23(1):90-92(in Chinese).
[26]KONAR R,LINSKENS H.Physiology and biochemistry of the stigmatic fluid ofPetuniahybrid[J].Planta,1966,71:372-387.
[27]QUIAPIM A C,BRITO M S,BERNARDES L A,etal.Analysis of theNicotianatabacumstigma/style transcriptome reveals gene expression differences between wet and dry stigma species[J].PlantPhysiol.,2009,149:1 211-1 230.
[28]RODRíGUEZ-RIAÑO T,DAFNi A.Pollen-stigma interference in two gynodioecious species of lamiaceae with intermediate individuals[J].Ann.Bot.,2007,100(2):423-431.
[29]李秀凤.甘草开花特性及传粉生物学研究[D].河北保定:河北农业大学,2010.
[30]PANDEY K K.Overcoming incompatibility and promoting genetic recombination in flowering plants[J].NewZealandBot.,1979,17:645-663.
[31]高 巍.君子兰生殖生物学基础及种质资源分子标记研究[D].长春:吉林农业大学,2013.
[32]LI F SH(李凤淑),ZHANG W W(张巍巍),WANG W M(王卫民),elal.Research about the overcome of self-incompatibility inBrasssica[J].TianjinAgricultureSciences(天津农业科学),2011,17(2):112-115(in Chinese).
