EST-SSR标记在水曲柳雌雄鉴定中的应用
2015-07-04齐凤慧孙宏冉詹亚光
齐凤慧,孙宏冉,詹亚光,2*
(1 东北林业大学 生命科学学院,哈尔滨150040;2 东北林业大学 林木遗传育种国家重点实验室,哈尔滨150040)
随着DNA 测序技术的快速发展和公共数据库开放,为SSR(simple sequence repeat,SSR)标记开发提供了新途径。在公共数据库中可快速获得各种动植物、不同组织、不同发育阶段的基因表达序列标签(expressed sequence tags,EST),这些EST 序列不仅在新基因挖掘中发挥了重要作用,而且为SSR标记的开发提供了一个巨大、有价值的来源[1-2]。
SSR 是微卫星标记,又称简单重复序列,是由1~6个核苷酸为重复单位组成串联重复序列,SSR含量丰富且遍布整个基因组。而EST-SSR 标记是建立在表达序列标签上的一种新型的分子标记技术,并与功能基因直接相关[3]。EST-SSR 除了具有基因组SSR 的优点外,它反映的是转录区的差异,其多态性可能与基因功能直接相关[4]。而且由于EST-SSR 来源于表达的基因组区域[5],可直接反映相关基因的多样性,同时它在不同物种间有良好的通用性[6],从一种物种开发的SSR 标记可用于其他物种的研究。目前,EST-SSR 除了在农作物小麦(Triticumaestivum)[7]、苜蓿(Medicagosativa)[8]、葡萄(Vitisvinifera)[9]、水 稻(Oryzasativa)[10]等中应用外,在树木中也得到广泛应用,如杏(Prunus armeniaca)[11]、猕猴桃(Actinidiachinensis)[12]、云杉(Piceaasperata)[13]、火 炬 松(Pinustaeda)[14]、白桦(Betulaplatyphylla)[15]、杨 树(Populus)[16]、茶树(Camelliasinensis)[17]、桉树(Eucalyptus)[18]、橡胶树(Heveabrasiliensis)[19]等物种。
水曲柳(FraxinusmandshuricaRupr.)以材质优良而著称,是珍贵的用材树种,可制各种家具、乐器、体育器具、车船、机械及特种建筑材料。其稀有珍贵的特性不仅在物种多样性、生态多样性的研究上具有重要意义,而且在维持生态功能上以及生产实践中所表现的经济价值也是不可替代的。国务院于1999年8月4日批准的《国家重点保护野生植物名录》(第一批)将水曲柳列为二级保护植物[20-21]。
水曲柳雌雄异株,幼苗期无法辨别雌雄,只有生长到10~12年开花后才能辨别雌雄[22],这给育苗、造林以及种子园的建立带来极大不便。目前对于水曲柳雌雄差异的研究比较少,而在其它植物中的研究表明雌雄株之间的基因表达存在一定差异,因此,为从基因方面揭示水曲柳雌雄差异,我们利用ESTSSR 技术对水曲柳雌雄株进行分析,初步建立水曲柳雌雄株的鉴别方法,为水曲柳育种及种子园的建立提供技术支持。
1 材料和方法
1.1 材 料
1.1.1 实验材料 研究材料主要来自黑龙江省尚志市苇河林业局青山林木种子园(1989建成),选择雌雄株各100棵,取其叶片,-80℃保存。
1.1.2 EST序列来源 实验中水曲柳EST 序列来源:(1)来自NCBI(http://www.ncbi.nlm.nih.gov/)dbEST 数 据 库(http://www.ncbi.nih.gov/bdEST/index.heml)中白腊属(Fraxinus)的EST 序列;(2)本实验室在华大基因测得的水曲柳转录组。
1.2 方 法
1.2.1 水曲柳SSRs位点的搜索 将获得的EST序列进行冗余性查找(http://www.ncbi.nlm.nih.gov/vecScreen),去除EST序列中的载体序列。然后对于NCBI数据库中的EST 序列利用在线软件SSRIT(Simple Sequence Repeat Identification Tool)(http://www.gram ene.org/db/markers/ssrtool)进行搜索,搜索条件为3次重复以上,选取二、三、四、五、六核苷酸5种类型的SSRs;对于转录组序列,搜索条件是5次重复以上,选取二、三、四、五、六核苷酸5种类型的SSRs进行分析。根据公式:SSR 频率=SSR 数量÷序列总数计算SSR 频率。
1.2.2 SSRs引物的设计 利用primer 5.0软件设计引物。来自NCBI数据库中的EST 序列,共得到105对EST-SSR 引物;来自水曲柳转录组中的序列,共设计1 678对引物,随机合成127对。引物由上海生工生物工程有限公司合成,共合成232对。
1.2.3 水曲柳DNA的提取、检测及DNA样品池建立 用改良的CTAB 法分别提取成年水曲柳雌雄各100株叶片DNA。分别用琼脂糖凝胶电泳和紫外分光光度计检测DNA 质量及浓度,根据检测结果,用ddH2O 将DNA 浓度调整为同一浓度。随机选择雌雄DNA 各50个,各取1μL 分别混合成水曲柳雌雄DNA 样品池。
1.2.4 水曲柳SSR扩增及引物筛选 以水曲柳雌雄DNA 样品池为模板,对合成的232对SSR 引物进行筛选。参考不同引物的Tm 值,采用梯度PCR仪进行扩增,退火温度筛选时在(Tm-5℃)~(Tm-3℃)之间设置3个温度梯度,SSR 扩增体系(20 μL)为:10×buffer 2.0μL;dNTPs 1.6μL;DNA 模板(20μg/μL)2.0μL;rTaq0.2μL;引 物1(10 μmol/L)1μL;引物2(10μmol/L)1μL;ddH2O 12.2μL[23]。扩增产物用12%的聚丙烯酰胺凝胶检测,参照韩永亮[24]的电泳和银染方法。
2 结果与分析
2.1 水曲柳SSRs出现频率、类型及分布比例
从来自白蜡属EST 和水曲柳转录组中的5 423条和179 502条序列中,分别查找到9 488个和3557个SSR 位点,共13 045个。SSR 出现的频率分别是174.96%和1.98%,平均0.32kb和13.87 kb出现一个SSR,长度≥10bp的SSR 出现频率分别是3.41%和1.98%。白蜡属EST 中SSR 出现频率比水曲柳转录组序列中出现的频率高(表1)。
表2显示,全部的EST-SSR 包括2~6个核苷酸重复单元,其中二核苷酸重复所占比例最大约68.83%(8 979 次);其次是三核苷酸占总SSR 的28.69%(3 743次);五核苷酸的重复出现的比较少只有46个,占总SSR 的0.35%;通过对两个数据库SSR 位点的比较发现白蜡属EST 数据库SSR 中二核苷酸和四核苷酸所占的比例比水曲柳转录组的高,分别多14.82%和0.25%;而水曲柳转录组SSR的三、五和六核苷酸所占的比例比白蜡属EST 数据库的高,分别多13.7%、0.29%和1.07%(表2)。
2.2 水曲柳EST-SSR中重复基元的分布特征
2.2.1 白蜡属中EST-SSR 的特性 在来源于白蜡属EST-SSR序列中,共观察到131种重复基元(考虑碱基互补的前提下)。其中二核苷酸重复基元有4种,三、四、五和六核苷酸重复基元分别有18、44、20和45种。二核苷酸基元(AG/CT)n出现的最多(3 458次),占二核苷酸重复的50.01%,其次分别是(AC/GT)n(24.47%)和(AT/AT)n(24.23%),(CG/CG)n出现的较少(89次)(1.29%)。三核苷酸基元中(AAG/TTC)n出现最多(491次),占三核苷酸重复的20.73%,(ACC/GGT)n 和(AGG/CCT)n出现的频率也较高,分别占三核苷酸重复的9.29%(220次)和6.46%(153次)。四核苷酸基元中(AAAT/TTTA)n出现的最多,占四核苷酸基元的16.15%(21 次),其次是(AAAG/TTTC)n 和(AATA/TATT)n,分别占四核苷酸重复的12.31%(16次)和7.69%(10次)。五核苷酸重复基元出现的频率比较低只有26个。搜索结果得到50个六核苷酸基元,出现最多的是(AAAAAT/ATTTTT)n(4次)。

表1 SSR 出现频率Table 1 Frequency of SSR
总之,白蜡属EST-SSR 以二核苷酸为主导,(AG/CT)n出现的最多,占总SSR 的36.45%;其次分别是(AC/GT)n(17.83%)和(AT/AT)n(17.65%),而三、四、五和六核苷酸在总SSR 中所占比例都很小。
2.2.2 水曲柳转录组中EST-SSR 的特性 在来源于水曲柳转录组的SSR 序列中,共观察到102种重复基元(考虑碱基互补的前提下)(图1)。其中二核苷酸重复基元有4种,三、四、五和六核苷酸重复基元分别有10、13、18和57种。二核苷酸基元(AG/CT)n出现最多(1 554 次),占二核苷酸重复的75.25%,其次分别是(AC/GT)n(16.71%)和(AT/AT)n(7.51%),(CG/CG)n出现较少(11 次)(0.53%)。三核苷酸基元中(AAG/CTT)n出现最多(412 次),占三核苷 酸 重 复 的29.96%,(ACC/GGT)n和(AGC/CTG)n出现的频率也较高,分别占三核苷酸重复的19.71%(271 次)和11.64%(160次)。四、五和六核苷酸出现的都比较少,但是六核苷酸类型丰富。
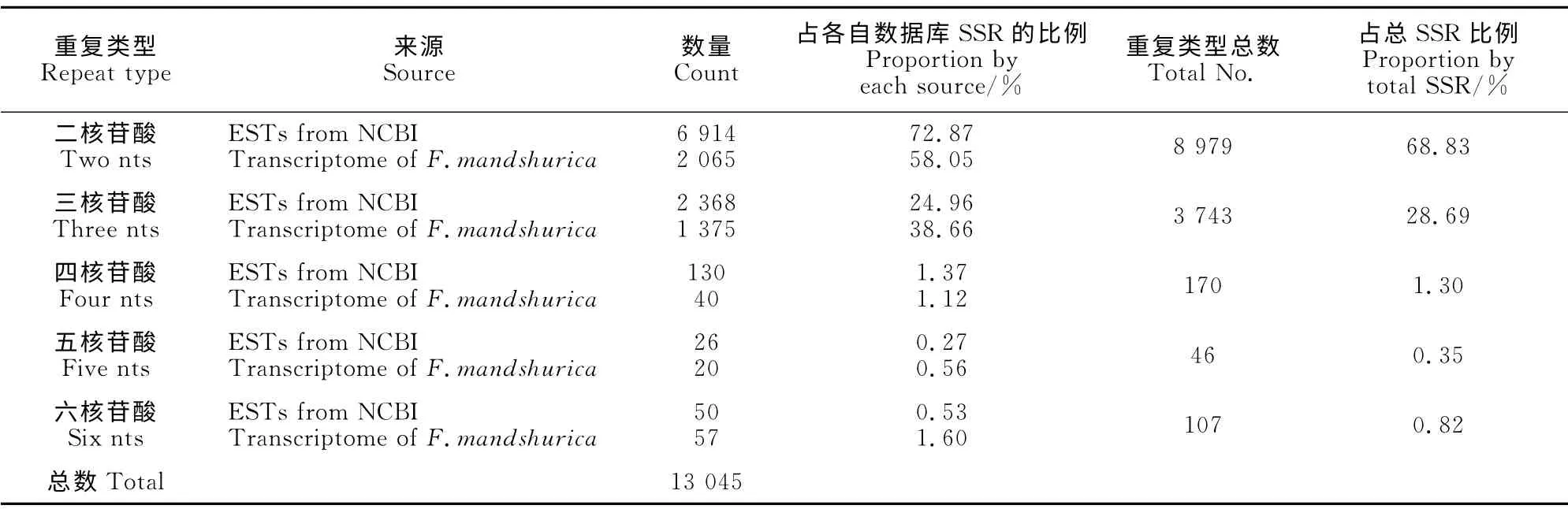
表2 水曲柳SSRs类型及分布比例Table 2 Repeat types and percentage of SSRs of F.mandshurica
通过以上分析可知,两种序列来源中EST-SSR的特性相同,出现的SSR 位点较多、类型丰富,都是以二核苷酸为主导,三、四、五和六核苷酸在总SSR中所占比例都很小。二核苷酸基元(AG/CT)n 出现的最多(5 012次),占总SSR 的38.42%,其次分别是(AC/GT)n(2 037 次)和(AT/AT)n(1 830次)。三核苷酸基元中,(AAG/CTT)n 出现最多(903 次),占 总SSR 的6.92%。四核苷酸中(AAAT/ATTT)n出现的最多,占总SSR的0.23%。五核苷酸(AAAAG/TTTTC)n 出现的最多,占总SSR 的0.09%。六核苷酸出现的次数不多,但类型丰富(图1)。
2.3 水曲柳EST-SSR引物筛选及应用
2.3.1 水曲柳DNA 提取与检测 采用CTAB 法提取水曲柳叶片中的DNA,用RnaseA 消化后在1.0%琼脂糖凝胶中电泳检测其完整性,从图2中可看出DNA 条带清晰,点样孔也较干净,没有大分子物质的干扰。之后用紫外分光光度计检测其浓度,各样品A260/A280均约等于1.8,符合实验要求。
2.3.2 EST-SSR 引物第一轮筛选 分别以水曲柳雌、雄DNA 样品池为模板,对设计的232对SSR 引物进行PCR 扩增,结果显示208(89.66%)对引物获得有效扩增,其中158 对(68.10%)引物在雌雄DNA 中无差异,有20对引物扩增的片段不在目的片段范围内;74对(31.90%)引物在雌雄DNA 中有差异,有27对引物扩增的片段符合预定大小的目的条带。在2种来源的引物中,来自白蜡属的引物有47对在水曲柳雌雄DNA 中有差异,其中有23对的雌雄差异片段符合预定大小的目的条带,有20对雌雄差异片段小于目的片段长度(表3);来自水曲柳转录组的127 对引物中,有27 对在水曲柳雌雄DNA 中有差异,其中有4对引物的雌雄差异片段符合预定大小的目的条带,有7对引物的雌雄差异条带小于目的片段,有16对引物的雌雄差异片段大于目的条带(表4)。在雌雄有差异片段的74对引物中有30对引物能在雌树的DNA 中扩增出片段,不能在雄树DNA 中扩增出段;有44对引物在雌树的DNA 中不能扩增出片段,在雄树DNA 中能扩增出片段。在图3,A 中箭头所示,21号引物(3、4泳道)和20号引物(9、10泳道)在雌雄DNA中均能扩增出预定大小的目的条带,23号引物(7、8泳道)在雌雄中扩增出条带小于目的片段。在图3,B中箭头所示,73号引物(1、2、3、4泳道)和74号引物(7、8泳道)在雌树DNA 中扩增出符合预定大小的目的条带,而在雄树DNA 中没有扩增出条带;75号引物(9、10、11、12泳道)在雌树DNA 中扩增出比目的片段长度小的条带,而在雄树中没有扩增出条带。

图1 水曲柳SSR 分布特性图1 Distribution characteristics of SSR in F.mandshurica
图2 DNA 提取结果Fig.2 DNA electrophosis

表3 白蜡属EST-SSRs引物筛选结果Table 3 Results of EST-SSRs primer screening in Fraxinus
2.3.3 EST-SSR 引物第二轮筛选 将第一轮筛选中雌雄有差异的所有引物都用于第二轮筛选,每个引物分别以雌雄各15个单株DNA 为模板,扩增结果显示来自水曲柳转录组中的19和56号引物在水曲柳雌雄各15个单株中均有差异。图4,A 是来自白蜡属EST 的44和26号引物,可以看出在雌雄间没有明显差异,图4,B 是来自转录组56号引物部分结果,在40~80bp处雄树DNA 中均扩增出小于目的条带的多态性片段,而雌树DNA 中均没有这样的多态性条带。图4,C 是19号引物部分扩增结果,如箭头所示,在雌树DNA 中扩增出符合预定大小的目的条带,而雄树DNA 中没有扩增出同样大小的条带。
2.3.4 EST-SSR 在水曲柳中的应用 将第二轮筛选得到的19号和56号引物应用于200棵成年水曲柳的雌雄差异分析中,56号引物在100株雌树中有18株在80bp处扩增出片段,82株没有扩增出片段(图5,A),差异率是82.00%;在100株雄树中有3株在80bp处没有片段,97 株有片段,而且均出现多态性扩增片段(图5,B),差异率是97.00%。因此,56号引物在200株水曲柳成年雌雄树中雌雄差异率是89.50%。
19号引物在100株雌树中有38株在300~500 bp之间扩增出片段,如图6箭头所示,62株没有扩增出片段,差异率是38.00%;在100株雄树中有91株在300~400bp之间没有扩增出片段,9株扩增出片段,差异率是91.00%,19号引物在200株水曲柳成年树中雌雄差异率是64.50%。
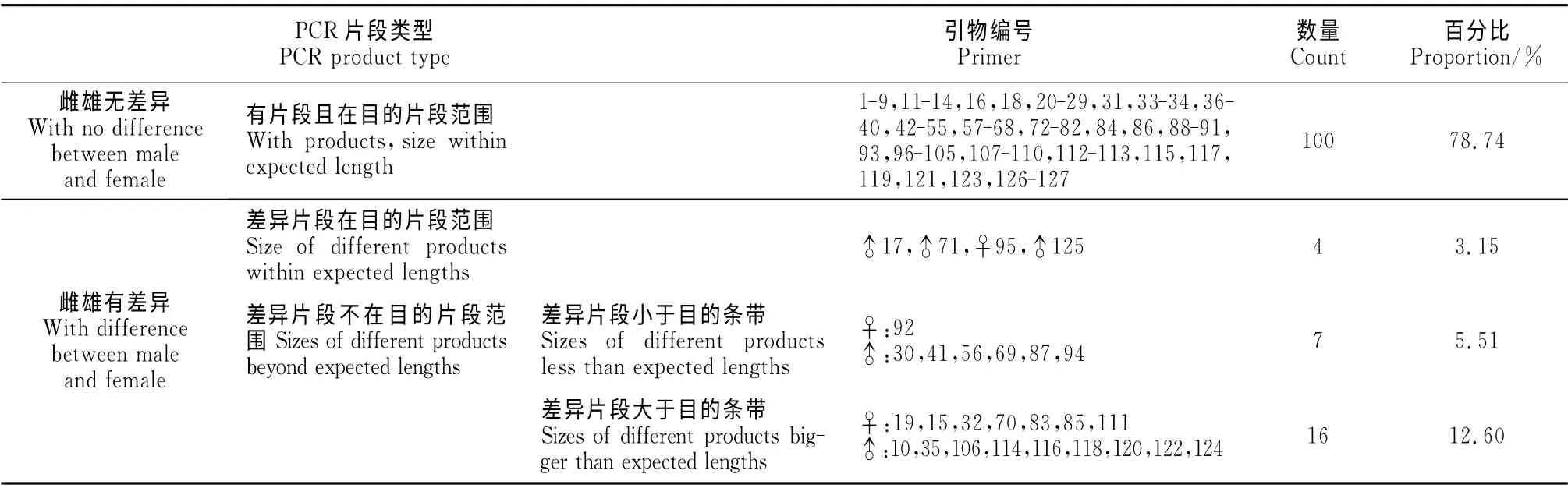
表4 转录组EST-SSRs引物筛选结果Table 4 Results of EST-SSRs primer screening in transcriptome
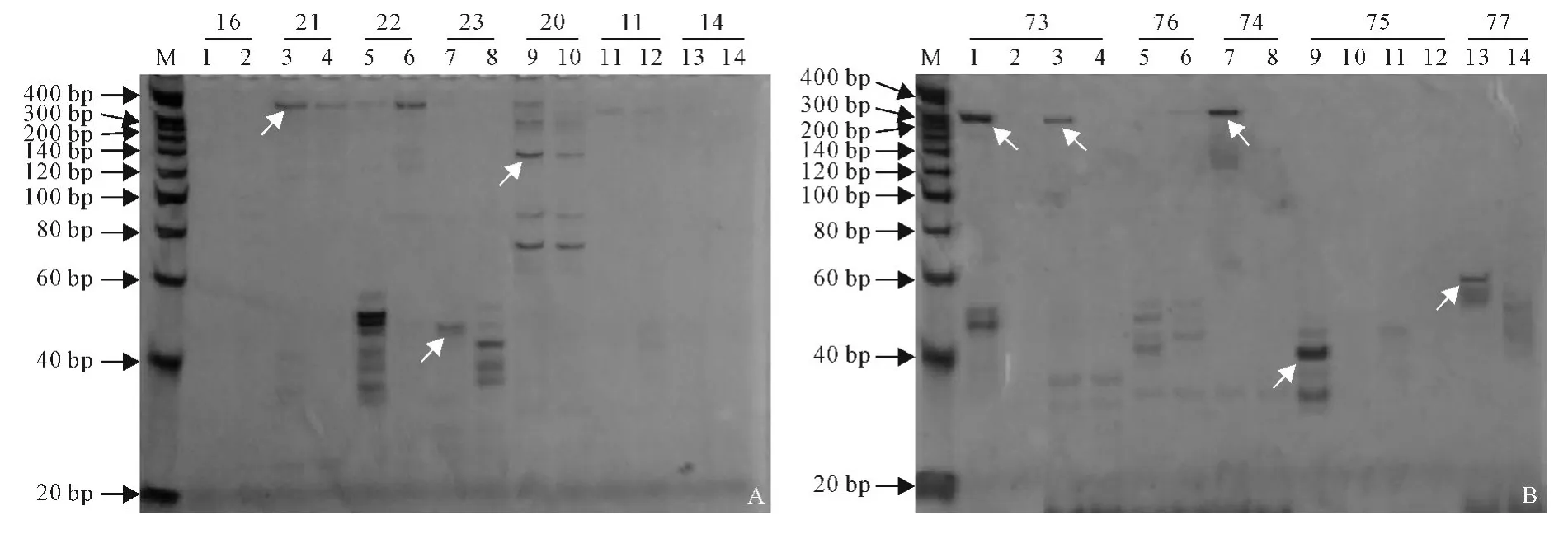
图3 部分引物筛选结果Fig.3 Primers screening for EST-SSR analysis

图4 第二轮部分引物筛选结果Fig.4 Results of primer screening in the second round
3 讨 论

图5 56号引物雌雄鉴别部分图Fig.5 Results of primer 56

图6 19号引物雌雄鉴别部分图Fig.6 Results of primer 19
SSR 不仅分布于整个基因组中,包括编码区和非编码区,也广泛存在于EST 序列中。EST 序列开发的EST-SSR标记与传统的基因组SSR 标记相比有很多优点,如:EST-SSR 标记在物种间具有高通用性,通常都代表着某种基因功能,还可反映出转录区的差异,而且开发过程简单、成本低[25]。目前,EST-SSR 已在农作物和木本植物中广泛应用。Silfverberg-Dilworth等[26]利用148个苹 果SSR 引物(包含31个EST-SSR)和8个已知的苹果、梨和欧洲花楸SSR 标记构建了复合遗传图谱,这些SSR标记给原参考图谱新增了168个位点。通常ESTSSR 侧翼序列在物种之间高度保守,因此可以在一个物种中开发EST-SSR 应用于与它亲缘的物种中。Vendramin等[27]从桃(P.persica)的中果皮中开发了21对EST-SSR 引物,用22个桃DNA 筛选出18对引物均能有效扩增出条带,同时用这18对引物在李属(Prunus)的6 个其它植物中均扩增出了预期条带,说明EST-SSR 在李属近缘种植物之间具有高效的通用性。本研究在105 对白蜡属EST-SSR引物和127对水曲柳转录组SSR 引 物中,分别有81和127对引物能有效扩增,说明EST-SSR 在近缘或远缘物种之间均有较好的通用性。
要将EST-SSR 应用于植物中,关键的第一步就是要进行对EST 序列中SSR 位点的分析及引物设计。刘泽涛等[28]用SSRSCAN 软件对小麦穗部的3264条EST 序列进行SSR 位点查找,得到108条含有SSR 标记的序列,设计64对引物筛选得到41对能在小麦品种中扩增出条带,36对引物能扩增出多态性条带。Chabane等[29]设计了48对大麦的EST-SSR 引物,并从中筛选出15 对引物在大麦中能有效扩增。在EST-SSR 研究中,李响等[30]对腊梅转录组进行SSR 位点分析并设计了100对ESTSSR 引物,筛选出17对引物在腊梅中能有效扩增。本研究共合成了232对引物,筛选到208对引物在水曲柳中能有效扩增,其中有74对引物在水曲柳雌雄DNA 中存在差异,占所有引物的31.90%。
随着植物基因组学与功能基因组学的不断发展和研究的深入,大规模植物基因的测序产生了大量的EST 序列,并上传到核酸公共数据库中,因此,要进一步利用EST 序列信息,其中之一就是要对EST-SSR 的引物进行开发。李德军等[31]对来自NCBI和马来西亚橡胶树EST 数据库的EST 序列进行分析,共鉴定到566个SSR 位点,平均3.96kb出现一个SSR 位点。在火炬松和云杉EST 序列中平均49.8kb出现1个SSR 位点,在杨树EST 序列中平均每3.88kb出现1个SSR 位点[16]。在一些物种中,二核苷酸和三核苷酸重复序列占主要类型,如橡胶树中二核苷酸重复占主要类型,其次是三核苷酸、四核苷酸、五核苷酸和六核苷酸重复,二核苷酸中GA/CT 的数目最多,其次是TC/AG、AT/TA、CTT/GAA、TTC/AAG 和TCT/AGA[31]。甘蔗EST 中三核苷酸重复占90%[32];蝴蝶兰EST 中二核苷酸重复占67.10%[33];白桦EST 中二核苷酸重复占81.12%[15]。本研究中水曲柳转录组中的SSR 出现的频率较低为1.98%,在白蜡属EST 中每0.32kb出现一个SSR 位点,出现的频率较高。水曲柳中也是二核苷酸重复序列占主导,最高为72.87%,二核苷酸(AG/CT)n出现的频率最多为38.42%。水曲柳中的三核苷酸(AAG/CTT)n 与杨树(9.3%)、杏(28.76%)[34]、油菜(35.71)[35]等报道一致。
水曲柳雌雄叶片的EST-SSR 标记的开发及应用对水曲柳育种及种子园建立具有重要的现实意义,一方面,对两种来源的标记均具有较高的有效扩增效率,表明利用近缘植物的分子标记对水曲柳进行研究是一种有效可行的方法;另一方面,导致水曲柳有性繁殖和种子园建立的难点关键是幼年水曲柳很难分辨雌雄,而目前关于水曲柳雌雄鉴别的研究基本空白。构建更加全面的水曲柳雌雄ESR-SSR标记并利用其来进行雌雄差异基因的定位,将是下一步的工作重点。
[1]BERUBE Y,ZHUANG J,RUNGIS D,etal.Characterization of EST-SSR in loblolly pine and spruce[J].TreeGenetics&Genomes,2007,3(3):251-259.
[2]PONCET V,RONDEAU M,TRANCHANT C.SSR mining in coffee tree EST databases:potential use of EST-SSRs as markers for the coffea genus[J].Mol.Gen.Genomics,2006,276:436-449.
[3]ZHANG Y D(张亚东),PENG CH(彭 婵),LI ZH F(李振芳),etal.Genetic diversity of genomic-SSR and EST-SSR markers in interspecies of poplar[J].JournalofNortheastForestryUniversity(东北林业大学学报),2011,29(12):8-11(in Chinese).
[4]ZHANG L D(张利达),TANG K X(唐克轩).Development of plant EST-SSR markers and its application[J].GenomicsandAppliedBiology(基因组学与应用生物学),2010,29(3):534-541(in Chinese).
[5]VARSHNEY R K,GRANER A,SORRELLS M E.Genic microsatellite markers in plants[J].TrendsinBiotechnology,2005,23(1):48-55.
[6]KANTETY R V,L ROTA M,MATTHEWS D E,etal.Data mining for simple sequence repeat in expressed sequence tags from barley,maize,rice,sorghum,and wheat[J].PlantMolecularBiology,2002,48(5):501-510.
[7]YU J K,DAKE T M,SINGH S,etal.Development and mapping of EST-derived simple sequence repeat markers for hexaploid wheat[J].Genome,2004,47(5):805-818.
[8]BARRETT B,GRIFFITHS A,SCHREIBER M,etal.A microsat ellite map of white clover[J].Theor.Appl.Genet,2004,109(3):596-608.
[9]DECROOCQ V,FAVE M G,HAGEN L,etal.Development and transferability of apricot and grape EST microsatellite markers across taxa[J].Theor.Appl.Genet,2003,106(5):912-922.
[10]CHO Y G,ISHII T,TEMNYKH S,etal.Diversity of microsatellites derived from genomic libraries and GenBank sequences in rice(OryzasativaL)[J].Theor.Appl.Genet,2000,100(5):713-722.
[11]XU YONG,MA RONGCAI,XIE HUA,etal.Development of SSR markers for the phylogenet ic analysis of almond trees from China and the Mediterranean region[J].Genome,2004,47(6):1 091-1 104.
[12]FRASER L G,HARVEY C F,CROWHURST R N,etal.EST-derived microsatellites from Actinidia species and their pot ential for mapping[J].Theor.Appl.Genet,2004,108(6):1 010-1 016.
[13]RUNGIS D,BERUBE Y,ZHANG J,etal.Robust simple sequence repeat markers for spruce(Piceaspp.)from expressed sequence tags[J].Theor.Appl.Genet,2004,109(6):1 283-1 294.
[14]CHERDSAK L,,CAROL E R,YOUSRY A E,etal.Single-copy,species-transferable microsat ellite markers developed from loblolly pine ESTs[J].Theor.Appl.Genet,2004,109(2):361-369.
[15]WANG Y M(王艳敏),WEI ZH G(魏志刚),YANG CH P(杨传平).Data mining for SSRs in ESTs and EST-SSR marker development inBetulaplatyphylla[J].ScientiaSilvaeSinicae(林业科学),2008,44(2):78-83(in Chinese).
[16]ZHANG X Y(张新叶),SONG C W(宋丛文),ZHANG Y D(张亚东),etal.Development of EST-SSR inPopulusdeltoidesandP.euramericana[J].ScientiaSilvaeSinicae(林业科学),2009,45(9):53-59(in Chinese).
[17]YAO M ZH(姚明哲),LIU ZH(刘 振),CHEN L(陈 亮),etal.Genetic diversity and structure of tea germplasm originated from region of North Yangtze River Based on EST-SSR markers[J].JournalofTeaScience(茶叶科学),2009,29(3):243-250(in Chinese).
[18]LIU G(刘 果),ZHANG D Q(张党权),XIE Y J(谢耀坚),etal.Rapid screening and transferability analysis of genomic-SSR and ESTSSR primers in eucalypt[J].ScientiaSilvaeSinicae(林业科学),2013,49(2):127-133(in Chinese).
[19]AN Z W(安泽伟),ZHAO Y H(赵彦宏),CHENG H(程 汉),etal.Development and application of EST-SSR markers inHeveabrasiliensisMuell.Arg[J].Hereditas(遗传),2009,31(3):311-319(in Chinese).
[20]周以良.黑龙江树木志[M].哈尔滨:黑龙江科学技术出版社,1986:487-548.
[21]WANG H Y(王义弘),CHAN Y X(柴一新),MU CH L(慕长龙).Tudy on ecology ofFraxinusmandshurica[J].JournalofNortheast ForestryUniversity(东北林业大学学报),1994,22(1):1-6(in Chinese).
[22]JI L L(纪丽丽),SU P(苏 平).An exploration on morphological identification of the sex ofFraxinusmandshurica[J].ForestBy-ProductandSpecialityinChina(中国林副特产),2008,97(6):31-33(in Chinese).
[23]SHAO J P(邵俊培),LI ZH H(李志辉),YANG M H(杨模华),etal.Optimization of PCR system in EST-SSR analysis ofPinusmassonianaLamb[J].JournalofCentralSouthUniversityofForestry&Technology(中国林业科技大学学报),2012,4(32):159-163(in Chinese).
[24]HAN Y L(韩永亮),CHANG J H(常金华).Comparative analysis of two kinds of methods to detect SSRs on polyacrylamide gel elect rophoresis systems[J].RainFedCrops,2006,26(3):176-177(in Chinese).
[25]LIN Y ZH(林元震),GUO H(郭 海),LIU CH X(刘纯鑫),etal.Development and application of EST-SSR markers in woody plants[J].BulletinofPlantPhysiology(植物生理学通讯),2009,45(12):1 221-1 225(in Chinese).
[26]SILFVERBERG D E,MATASCI C L,VAN DE WEG WE,etal.Microsatellite markers spanning the apple(Malus×domesticaBorkh.)genome[J].TreeGen.Genom.,2006,2(4):202-224.
[27]VENDRAMIN E,DETTORI MT,GIOVINAZZI J,etal.A set of EST-SSRs isolated from peach fruit transcriptome and their transportability acrossPrunusspecies[J].Mol.Ecol.Notes,2007,7(2):307-310.
[28]LIU Z T(刘泽涛),YUAN SH H(苑少华),YANG D(杨 迪)etal.Development of SSR markers derived from EST of wheat spikes and their use in genetic diversity analysis of wheat[J].JournalofTriticeaeCrops(麦类作物学报),2013,33(6):1 093-1 099(in Chinese).
[29]CHABANE K,VARSHNEY RK,GRANER A,etal.Generation and exploitation of EST-derived SSR markers for assaying molecular diversity in durum wheat populations[J].GenetResour.CropEvol.,2008,55(6):869-881.
[30]LI X(李 响),YANG N(杨 楠),etal.Development and primer aelection of EST-SSR molecular markers based on transcriptome sequencing of chimonanthus praecox[J].JournalofBeijingForestryUniversity(北京林业大学学报),2013,35(1):25-32(in Chinese).
[31]DEJUN LI,ZHI DENG,HUINA GUO,etal.Development and characterizations of EST-SSR markers in rubber tree(Heveabrasiliensis)[J].AgriculturalScience&Technology,2014,15(5):733-737.
[32]CORDEIRO G M,CASU R,MCINTYRE C L,etal.Microsatellite markers from sugarcane(Saccharumspp.)ESTs cross transferable to helianthus and sorghum[J].PlantScience,2001,160(6):1 115-1 123.
[33]LI D M(李冬梅),LÜF B(吕复兵),ZHU G F(朱根发),etal.Analysis of SSR information in EST resource ofPhalaenopsisspp[J].GuangdongAgriculturalSciences(广东农业科学),2011,3:117-120(in Chinese).
[34]LI X B(李小白),ZHANG M L(张明龙),CUI H R(崔海瑞).Analysis of SSR inform ation in EST resource of o ilseed rape[J].Chinese JournalofOilCropSciences(中国油料作物学报),2007,29(1):20-22(in Chinese).
[35]YU L(余 利),HUANG SH Y(黄少勇),ZHANG ZH J(张智俊),etal.Genetic diversity analysis of 13kinds of ornamental bamboo based on EST-SSR markers[J].NonwoodForestResearch(经济林研究),2012,30(3):6-10(in Chinese).
