揭秘“躺着也中枪”的化学题
2015-06-24王凤英
王凤英

现代社会有句俗话:“躺着也中枪。”高考试题中的陷阱花样百出,一不小心,就可能中招。下面的这些陷阱,你遭遇过吗?
一、漏读题干信息
【例1】(2015·湖北七市州三月联考)下列分子式表示的有机物中,含单官能团的同分异构体数目最多的是( )
A.C4H10O B.C4H10 C.C3H6O D.C4H7Cl
易错揭秘:审题时只注意“同分异构体最多”而忽视“单官能团”,易错选D。含单官能团的“C4H7Cl”只能是氯代环烷烃不能是氯代烯,因为氯代烯的官能团有氯原子和碳碳双键。
正确思路:选项A中含单官能团的分别有4种醇(C4H9OH,羟基不变,丁基有4种异构)和3种醚(甲基丙基醚、甲基异丙基醚、乙醚)共7种。选项B只有2种(正丁烷和异丁烷)。选项C不能包含烯醇和烯醚,含单官能团的异构体分别为:CH3CH2CHO(丙醛)、CH3COCH3(丙酮)、、、共5种。选项D含单官能团的异构体有1种氯代环丁烷和3种
氯代甲基环丙烷(、、
)。故答案选A。
二、忽视题给材料
【例2】(2013·上海卷)部分弱酸的电离平衡常数如下表:
弱酸 HCOOH HCN H2CO3
电离平衡常数(25℃) Ki=1.77×10-4 Ki=4.9×10-10 Ki1=4.3×10-7
Ki2=5.6×10-11
下列选项错误的是( )
A.2CN-+H2O+CO2→2HCN+CO32-
B.2HCOOH+CO3?2-→2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
易错揭秘:根据强酸制弱酸的原理,认为H2CO3可制取HCN,误认为A选项正确。
正确思路:给出电离平衡常数其实就是为设陷铺路,HCN电离平衡常数小于H2CO3一级电离平衡常数大于其二级电离平衡常数,酸性HCOOH>H2CO3>HCN>HCO3-,根据强酸制弱酸的原理,H2CO3可以制HCN,HCN可以制HCO3-,所以正确的离子方程式为:CN-+H2O+CO2→HCN+HCO3-,A错误,B 正确;等pH的HCOOH和HCN,c(HCOOH)<
c(HCN),等体积的两种酸前者的物质的量小于后者,C正确;等体积、等浓度的HCOONa和NaCN溶液中,分别有:n(Na+)+n(H+)=n(OH-)+n(HCOO-),n(Na+)+n(H+)= n(OH-)+n(CN-),离子总数分别为溶液中2〔n(Na+)+n(H+)〕,n(Na+)相同,但NaCN溶液的碱性比HCOONa溶液的强,因此NaCN溶液中的n(OH-)大于HCOONa溶液中的n(OH-),NaCN溶液中的n(H+)小于HCOONa溶液中的n(H+),因此等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者,D错误。故答案选A、D。
三、思维不够严密
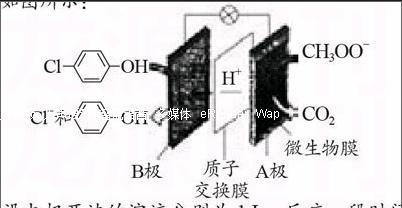
【例3】(2015·湖北七市州三月联考)含有乙酸钠和对氯苯酚的酸性废水,可利用微生物电池法除去,其原理如图所示:
设电极两边的溶液分别为1 L,反应一段时间后,B极区溶液的pH从4变1,此过程中处理的乙酸钠的质量为 。
易错揭秘:根据电极反应式,左边:C6H5ClO+2e-+
H+=Cl-+C6H6O,左边消耗H+,酸性会减弱,pH怎能从4变1呢?
正确思路:根据图示或正极反应式,B极附近会生成Cl-,负电荷增加,右边A极(负极)区的H+会透过质子交换膜定向移动到左边,负极(A极)的电极反应式为:CH3COO--8e-=2CO2↑+7H++2H2O。从负极(A极)区透过质子交换膜进行到B极区的H+,有两个作用,一是取代对氯苯酚中的氯原子,二是与生成的形成盐酸,如果我们灵活的把B极生成的盐酸写成“化学式”的样子:4Cl-C6H4OH+8e-+8H+= 4“HCl”+4C6H5OH,可以清楚看到B极每生成1 mol H+电池要转移2 mol e-。pH从4变1,即左边1 L溶液中有0.1 mol H+,转移的电子为0.2 mol,m(CH3COONa)=0.2 mol×82 g/mol÷8=2.05 g。
特别提示:对于有盐桥和离子交换膜的电化学反应,通过离子的扩散,溶液呈电中性。
四、思维定式
【例4】(2011·福建卷)25℃时,在含有Pb?2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+ Pb?2+(aq)=Sn2++Pb(aq),体系中c(Pb?2+)、c(Sn2+)变化关系如图所示。下列判断正确的是( )
A.往平衡体系中加入金属铅后,c(Pb?2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb?2+)变小
C.升高温度,平衡体系中c(Pb?2+)增大,说明该反应ΔH>0
D.25℃时,该反应的平衡常数K=2.2
易错揭秘:加入金属铅,即加入生成物后,认为平衡向逆反应方向移动,错选A。
正确思路:由于加入的反应物金属铅为固体物质,因此对平衡无影响,排除A;加入Sn(NO3)2固体后,c(Sn2+)增大,平衡向左移动,c(Pb?2+)变大,排除B;升高温度,c(Pb?2+)增大,说明该反应的逆反应的ΔH>0,则正反应的ΔH<0,排除C;因此正确答案为D,无须计算其平衡常数K。
五、经验主义
【例5】(2015·湖北八校联考)一定条件下存在反应:H2(g)+I2(g)2HI(g)ΔH<0,现有三个相同的1 L恒容绝热(与外界没有热量交换)密闭容器,在Ⅰ中充入1 mol H2和1 mol I2(g),在Ⅱ中充入2 mol HI、在Ⅲ中充入2 mol H2和2 mol I2(g),700℃条件下开始反应,达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅱ正反应速率相同
B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ中气体颜色比容器Ⅱ中的气体颜色深
D.容器Ⅰ中H2转化率与容器Ⅱ中HI的转化率之和为1
易错揭秘:由于是前后两气体物质的量不变的反应,因此很容易想当然地认为三个容器等效,误选B或D。
正确思路:恒容绝热容器,容器Ⅰ随着反应进行,温度升高,而容器Ⅱ的温度会降低,A错误;容器Ⅰ、Ⅲ起始浓度不同,Ⅲ的起始速率大于Ⅰ,那么放出的热量会不同,因此温度不同,平衡常数也不同,B错误;假若先让Ⅰ、Ⅱ等效,那么最后两容器颜色相同,但由于是绝热容器,容器Ⅰ随着反应进行,温度升高,相当于平衡逆向移动,I2(g)浓度会增大,容器Ⅱ随着反应进行,温度降低,相当在二者等效的基础上向生成HI的方向移动,因此容器Ⅰ中气体颜色比容器Ⅱ中的气体颜色深,C正确。
