产甘油三油酸酯的薏苡内生真菌Gibberellamoniliformis AH13发酵培养基的筛选
2015-06-24陈贵林秦路平
文 先, 程 诺, 韩 婷, 陈贵林, 贾 敏,①, 秦路平,①
(1. 内蒙古大学生命科学学院, 内蒙古 呼和浩特 010021; 2. 第二军医大学药学院生药学教研室, 上海 200433)
产甘油三油酸酯的薏苡内生真菌GibberellamoniliformisAH13发酵培养基的筛选
文 先1,2, 程 诺2, 韩 婷2, 陈贵林1,2, 贾 敏2,①, 秦路平2,①
(1. 内蒙古大学生命科学学院, 内蒙古 呼和浩特 010021; 2. 第二军医大学药学院生药学教研室, 上海 200433)
薏苡(Coixlacryma-jobiLinn.)为禾本科(Poaceae)薏苡属(CoixLinn.)1年生草本植物,其干燥成熟种仁为薏苡仁,药食兼用;薏苡仁中粗蛋白含量13%~14%,脂类含量2%~8%,且富含薏苡仁酯[1]。薏苡仁具有抗肿瘤[2-5]、提高机体免疫力[6]、降血糖[7-8]、抗炎镇痛[9]、调节血脂代谢[10]和抑制骨质疏松[11]等药理作用。薏苡仁油中的主要抗肿瘤活性成分是甘油三酯类成分,该成分也是评价薏苡仁药材质量的指标成分[5],以其为有效成分制成的注射用乳剂(即康莱特注射液)现已作为中国临床普遍应用的抗肿瘤药[5]。
1993年,Stierle等首次分离获得与宿主产生相同成分(即紫杉醇)的内生真菌[12],此后,国内外研究人员发现植物内生真菌产生与宿主相同或相似的生物活性成分并不是个别现象,不仅先后从红豆杉属(TaxusLinn.)的其他植物中再次分离得到产生紫杉醇的内生真菌[13],还分别从喜树(CamptothecaacuminataDecne.)、长春花〔Catharanthusroseus(Linn.) G. Don〕、蛇足石杉〔Huperziaserrata(Thunb. ex Murray) Trev.〕、贯叶连翘(HypericumperforatumLinn.)、足叶草(PodophyllumpeltatumLinn.)、平贝母(FritillariaussuriensisMaxim.)、杜仲(EucommiaulmoidesOliver)、秦艽(GentianamacrophyllaPall.)和甘肃棘豆(OxytropiskansuensisBunge)等药用植物中分离获得能产生宿主具有的喜树碱[14]、长春新碱[15]、石杉碱甲[16]、金丝桃素[17]、鬼臼毒素[18]、西贝母碱[19]、绿原酸[20]、龙胆苦苷[21]和苦马豆碱[22-23]等成分的内生真菌菌株[24]。此外,内生真菌还能够产生一些结构新颖的活性化合物。由于内生真菌生物多样性高,其次生代谢产物也是一个巨大的天然产物资源库,因此,内生真菌是许多重要药用成分的新来源。
为探索甘油三油酸酯(triolein)工厂化生产的新途径、扩大其资源基础,作者以分离自薏苡的内生真菌GibberellamoniliformisAH13为研究对象,对其适宜培养基进行筛选,以期为triolein的人工发酵生产提供研究基础。
1 材料和方法
1.1 材料
供试内生真菌GibberellamoniliformisAH13[5]分离自薏苡,该菌种的ITS序列已提交GenBank(登录号为KF775590),并保藏于中国典型培养物保藏中心(CCTCC),保藏号为AF2013030,4 ℃斜面保存。
主要仪器和试剂:HYG-A全温摇瓶柜(太仓市实验设备厂);LC-2010A-HT高效液相色谱仪(日本岛津公司);SEDEX 80 ELSD蒸发光散射器(法国Sedere公司);LCQ Deca XP MAX离子阱液质联用仪(美国Finnigan公司),配有标准电喷雾离子源(ESI)和大气压大气压力化学电离子源(APCI),分析软件为MassHunter在线工作站和Qualiative Analysis离线分析软件;KQ5200B型超声仪(昆山市超声仪器有限公司);XTP-7000型旋转蒸发仪(上海青浦沪西仪器厂);DFY-500型高速重要粉碎机(上海鼎广机械设备有限公司);AL104型电子天平〔梅特勒-托利多仪器(上海)有限公司〕;ZORBAX SB-C18色谱柱(美国Agilent公司)。Triolein标准品(纯度大于99%)购自美国Sigma公司;主要试剂均为分析纯。
1.2 方法
1.2.1 产triolein的液体发酵培养基筛选及培养体系优化参照Jia等[5]的方法、分别采用马铃薯葡萄糖液体培养基(PDB)、薏苡仁培养基(Adlay)、大米培养基(Rice)、MS培养基和B5培养基对G.moniliformisAH13菌株进行液体培养;采用下述方法分别测定不同培养基发酵产物中triolein的含量,据此筛选出triolein产量最高的液体发酵培养基。
以triolein产量最高的Rice培养基为基本培养基,对培养体系参数进行优化。用质量浓度0、5、10、15、20、25和30 g·L-1的Rice培养基对G.moniliformisAH13菌株进行发酵培养,并按照下述方法测定发酵产物中triolein含量,据此筛选出triolein产量最高的最佳发酵培养基。
1.2.2 质谱和色谱分析条件 高效液相色谱串联大气压化学电离源质谱(HPLC-APCI-MS)条件:正离子检测模式,喷雾电压3 000 V,毛细管温度250 ℃,大气压电离源温度400 ℃,corona电流4 μA,鞘气(高纯液氮)压力35 kPa。质谱扫描范围300~900 amu,扫描时间1 s,Q1宽度0.7。高效液相色谱(HPLC)条件: Discovery C18液相色谱柱(4.6 mm×250 mm, 5 μm);流动相为乙腈-二氯甲烷(体积比66∶34)混合溶液1 000 mL;流速0.7 mL·min-1;柱温30 ℃;蒸发光散射检测器;漂移管温度45 ℃;氮气流速1.5 L·min-1,进样量10 μL。
1.2.3 对照品溶液的配制和分析 精密称取0.035 6 g triolein标准品,用乙腈-二氯甲烷(体积比66∶34)混合溶液溶解并定容至25 mL,配成质量浓度1.424 mg·mL-1的trolein对照品溶液。按照上述质谱和色谱分析条件进行分析。
1.2.4 样品溶液的制备和分析 精密称定G.moniliformisAH13发酵产物的乙酸乙酯提取物粉末0.6 g(过100目筛),用乙腈-二氯甲烷(体积比66∶34)混合溶液溶解并定容至50 mL,称定质量;浸泡2 h后超声处理30 min,冷却后称定质量;用乙腈-二氯甲烷(体积比66∶34)混合溶液补足损失的质量,混匀后依次用滤纸和微孔滤膜(0.45 μm)过滤,滤液即为样品溶液。按照上述质谱和色谱分析条件进行分析。
1.3 数据处理
采用峰面积归一化法根据标准品的峰面积计算样品中的triolein含量。
2 结果和分析
2.1 培养基的筛选结果
分别用PDB、Adlay、Rice、MS和B5培养基对G.moniliformisAH13菌株进行液体发酵培养,结果显示:PDB、Adlay和Rice培养液的产物中均含有triolein,triolein含量分别为10.27、87.48和152.65 μg·mL-1;而MS和B5培养液中均未检测出triolein。因Rice培养液中triolein含量最高,故可初步确定Rice培养基对内生真菌G.moniliformisAH13产triolein的发酵培养较为适宜。
2.2 培养基的优化
采用不同质量浓度的Rice培养基对G.moniliformisAH13菌株进行液体发酵培养,产物中triolein含量的测定结果见表1。结果表明:随Rice培养基质量浓度的提高(5~30 g·L-1),triolein含量逐步提高。其中质量浓度30 g·L-1的Rice培养基中triolein含量最高,分别是5、10、15、20和25 g·L-1Rice培养基中triolein含量的2.21、1.58、1.44、1.30和1.14倍。表明质量浓度30 g·L-1Rice培养基是G.moniliformisAH13菌株产triolein发酵培养的适宜培养基。
表1 不同质量浓度大米培养基对薏苡内生真菌GibberellamoniliformisAH13发酵产物中triolein含量的影响
Table 1 Effect of Rice medium with different mass concentrations on triolein content in fermentation product of endophytic fungiGibberellamoniliformisAH13 inCoixlacryma-jobiLinn.
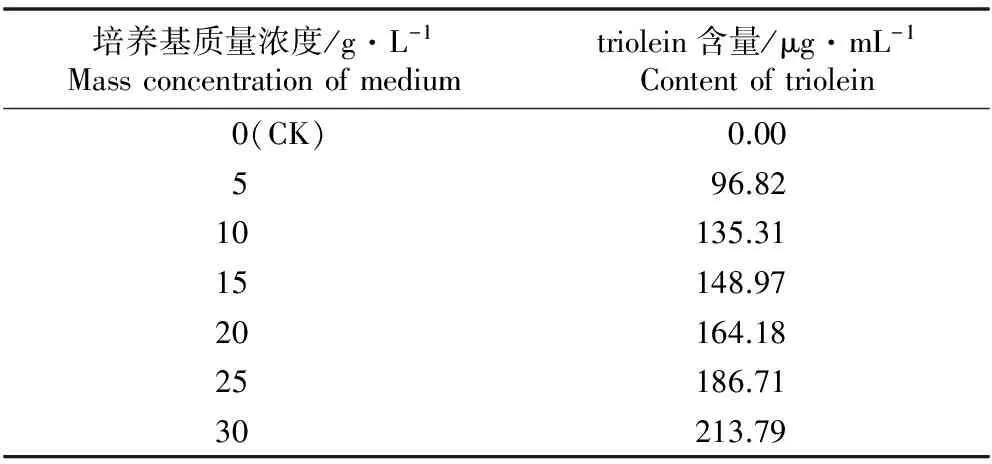
培养基质量浓度/g·L-1Massconcentrationofmediumtriolein含量/μg·mL-1Contentoftriolein 0(CK)0.005 96.8210 135.3115 148.9720 164.1825 186.7130 213.79
3 讨论和结论
本研究结果表明:在马铃薯葡萄糖液体培养基(PDB)、薏苡仁培养基(Adlay)和大米培养基(Rice)中,内生真菌G.moniliformisAH13均能产生triolein,其中在Rice培养基中triolein含量最高(为152.65 μg·mL-1),而在B5和MS培养基中G.moniliformisAH13不能产生triolein。这可能是由于B5和MS培养基不能为G.moniliformisAH13提供合成triolein所需的底物,而PDB、Adlay和Rice培养基则能满足G.moniliformisAH13合成triolein所需的底物和营养成分。综合研究结果表明:30 g·L-1Rice培养基适宜于薏苡内生真菌G.moniliformisAH13产triolein的发酵培养。
碳源是微生物合成油脂必需的关键营养成分,常用的碳源有糖类、油脂、有机酸和低碳醇,蛋白质和氨基酸也可用作碳源。Rice培养基的有机碳源为大米,具有含氮少、疏松、表面积大等特点,是较好的孢子培养基,可以供真菌孢子发芽、生长和大量繁殖菌丝体,并使菌丝体粗壮,从而提高发酵产物的产量;而PDB和Adlay培养基中的马铃薯和薏苡仁也均富含有机碳源及其他各种营养成分,因而对G.moniliformisAH13合成triolein也有一定的促进作用。但这些培养基中与triolein合成相关的关键成分还需进一步研究确定。
[1] 刘应泉, 谭供根. 油脂与健康[M]. 北京: 人民卫生出版社, 1989: 206.
[2] CHANG H C, HUANG Y C, HUANG W C. Antiproliferative and chemopreventive effects of adlay seed on lung cancerinvitroandinvivo[J]. Journal of Agricultural and Food Chemistry, 2003, 51: 3656-3660.
[3] WOO JH, LID, WILSBACHK, et al.Coixseedextract, a commonly used treatment for cancer in China, inhibits NFkappaB and protein kinase C signaling[J]. Cancer Biology Therapy, 2007, 6: 2005-2011.
[4] 史周印, 李天晓, 王秋萍, 等. 薏苡仁注射液在中晚期肝癌化疗栓塞中的应用研究[J]. 肿瘤, 2001, 21(3): 233-234.
[5] JIA M, MING Q L, ZHANG Q Y, et al.GibberellamoniliformisAH13 with antitumor activity, an endophytic fungus strain producing triolein isolated from adlay (Coixlacryma-jobi: Poaceae)[J]. Current Microbiology, 2014, 69: 381-387.
[6] 苗明三. 薏苡仁多糖对环磷酰胺致免疫抑制小鼠免疫功能的影响[J]. 中医药学报, 2002, 30(5): 49-50.
[7] 徐梓辉, 周世文, 黄林清. 薏苡仁多糖的分离提取及其降血糖作用的研究[J]. 第三军医大学学报, 2000, 22(6): 578-581.
[8] 张云霞, 张丽微, 孙晶波. 薏苡仁醇提物的降糖作用研究[J]. 中国中医药杂志, 2007, 5(8): 65-66.
[9] 高 岚, 张仲一, 张 莉, 等. 薏苡仁汤镇痛消炎作用的实验研究[J]. 天津中医学院学报, 2005, 24(1): 17-19.
[10] YEH P H, CHIANG W, CHIANG M T, et al. Effects of dehulled adlay on plasma glucose and lipid concentrations in streptozotocin-induced diabetic rats fed a diet enriched in cholesterol[J]. International Journal for Vitamin and Nutrition Research, 2006, 76: 299-305.
[11] YANG R S, CHIANG W, LU Y H, et al. Evaluation of osteo-porosis prevention by adlay using a tissue culture model[J]. Asia Pacific Journal of Clinical Nutrition, 2008, 17: 143-146.
[12] STIERLE A, STROBEL G, STIERLE D, et al. Taxol and taxane production byTaxomycesandreanae, an endophytic fungus of Pacific yew[J]. Science, 1993, 260: 214-216.
[13] ZHOU X W, ZHU H F, LIU L, et al. A review: recent advances and future prospects of taxol-producing endophytic fungi[J]. Applied Microbiology and Biotechnology, 2010, 86: 1707-1717.
[14] PU X, QU X X, CHEN F, et al. Camptothecin-producing endo-phytic fungusTrichodermaatrovirideLY357: isolation, identifica-tion, and fermentation conditions optimization for camptothecin production[J]. Applied Microbiology and Biotechnology, 2013, 97: 9365-9375.
[15] YIN H, SUN Y H. Vincamine-producing endophytic fungus isolated fromVincaminor[J]. Phytomedicine, 2011, 18: 802-805.
[16] WANG Y, ZENG Q G, ZHANG Z B, et al. Isolation and char-acterization of endophytic huperzine A-producing fungi fromHuperziaserrata[J]. Journal of Industrial Microbiology and Biotechnology, 2011, 38: 1267-1278.
[17] KUSARI S, LAMSHÖFT M, ZÜHLKE S, et al. An endophytic fungus fromHypericumperforatumthat produces hypericin[J]. Journal of Natural Products, 2008, 71: 159-162.
[18] EYBERGER A L, DONDAPATI R, PORTER J R, et al. Endo-phyte fungal isolates fromPodophyllumpeltatumproduce podophyllotoxin[J]. Journal of Natural Products, 2006, 69: 1121-1124.
[19] YIN H, CHEN J L. Sipeimine-producing endophytic fungus isolated fromFritillariaussuriensis[J]. Zeitschrift Für Naturforschung C, 2008, 63: 789-793.
[20] CHEN X M, SANG X X, LI S H, et al. Studies on a chlorogenic acid-producing endophytic fungi isolated fromEucommiaulmoidesOliver[J]. Journal of Industrial Microbiology and Biotechnology, 2010, 37: 447-454.
[21] YINH,ZHAOQ,SUNFM,etal. Gentiopicrin-producing endophytic fungus isolated fromGentianamacrophylla[J]. Phytomedicine, 2009, 16: 793-797.
[22] COOK D, GARDNER D R, RALPHS M H, et al. Swainsoninine concentrations and endophyte amounts ofUndifilumoxytropisin different plant parts ofOxytropissericea[J]. Journal of Chemical Ecology, 2009, 35: 1272-1278.
[23] YU Y, ZHAO Q, WANG J, et al. Swainsonine-producing fungal endophytes from major locoweed species in China[J]. Toxicon, 2010, 56: 330-338.
[24] ZHAOJ,SHANT,MOUY,etal.Plant-derivedbioactive compounds produced by endophytic fungi[J]. Mini-Reviews in Medicinal Chemistry, 2011, 11: 159-168.
(责任编辑: 张明霞)
Screening on fermentation medium of endophytic fungiGibberellamoniliformisAH13 producing triolein fromCoixlacryma-jobi
WEN Xian1,2, CHENG Nuo2, HAN Ting2, CHEN Guilin1,2, JIA Min2,①, QIN Luping2,①
(1. College of Life Sciences, Inner Mongolia University, Hohhot 010021, China; 2. Department of Pharmacognosy, School of Pharmacy, Second Military Medical University, Shanghai 200433, China),J.PlantResour. &Environ., 2015, 24(3): 118-120
Fermentation medium of endophytic fungiGibberellamoniliformisAH13 producing triolein fromCoixlacryma-jobiLinn. was screened. The results show that fermentation products ofG.moniliformisAH13 in potato dextrose liquid medium (PDB),C.lacryma-jobiseed medium (Adlay) and rice medium (Rice) all containtrioleinwithcontentsof 10.27, 87.48 and 152.65 μg·mL-1, respectively, while that in MS medium and B5medium does not contain triolein. It is indicated that Rice medium is suitable for fermentation culture ofG.moniliformisAH13 to produce triolein. With enhancing of mass concentration (5-30 g·L-1) of Rice medium, triolein content in fermentation product increases gradually and it is the highest (213.79 μg·mL-1) in 30 g·L-1Rice medium. It is suggested that 30 g·L-1Rice medium is the suitable medium for fermentation culture ofG.moniliformisAH13 inC.lacryma-jobito produce triolein.
薏苡; 内生真菌;GibberellamoniliformisAH13; 甘油三油酸酯; 培养基筛选
Coixlacryma-jobiLinn.; endophytic fungi;GibberellamoniliformisAH13; triolein; medium screening
2014-12-08
文 先(1990—),女,蒙古族,内蒙古通辽人,硕士研究生,主要从事药用植物化学方面的研究。
①通信作者E-mail: jm7.1@163.com; qinluping@126.com
Q939.9; Q948.12+2.3
A
1674-7895(2015)03-0118-03
10.3969/j.issn.1674-7895.2015.03.18
