全程与短程缺氧反硝化降解苯酚的动力学及菌群结构对比
2015-06-23张小妹岳秀萍王国英薄泓淼
张小妹,岳秀萍,王国英,米 静,薄泓淼
(太原理工大学 环境科学与工程学院,太原 030024)
全程与短程缺氧反硝化降解苯酚的动力学及菌群结构对比
张小妹,岳秀萍,王国英,米 静,薄泓淼
(太原理工大学 环境科学与工程学院,太原 030024)
在同一实验平台上建立起两个平行的全程与短程反硝化实验装置,均以苯酚为单一碳源进行缺氧反硝化降解。结果显示,两个反硝化体系的苯酚和硝态氮(亚硝态氮)去除率均在83%,99%左右,全程和短程反硝化体系的比反硝化速率(以N元素计)分别为4.98,6.45 mg/(g·h).通过PCR-DGGE及切胶测序对两个反硝化体系的菌群结构进行了分析,发现全程反硝化菌群的丰富度值和多样性指数要高于短程;全程与短程反硝化降解苯酚的细菌菌纲均以几类变形菌纲(Alphaproteobacteria,Betaproteobacteria,Gammaproteobacteria)和拟杆菌纲(Bacteroidetes)为主。 DGGE图谱主成分分析表明,全程与短程反硝化菌群之间具有一定联系性,菌群培养具有相互转化的可能性;短程反硝化体系的隶属于Simplicispirasp.的特有菌种与全程反硝化体系的隶属于Thermomonassp.的特有菌种在系统发育上存在较亲近的遗传关系。
苯酚降解;全程反硝化;短程反硝化;比反硝化速率;菌群结构
苯酚具有剧毒性、致突变性、致癌性,因此在含酚工业废水排放之前须将其中的酚类物质强制性去除[1]。高浓度含酚废水可以通过物理化学的方法进行处理,如臭氧氧化、芬顿试剂法、紫外线照射、过氧化氢氧化等,这些方法的成本过高,不适用于大量废水处理[2-4]。生物降解法是一种有效的水处理方法,因其较低的成本和更高的有机物降解率被广泛应用。许多微生物都具有降解芳香族化合物如芳香族氨基酸、酚类或醌类的能力[5-6]。目前常用于处理含酚废水的生物法主要为A/O及其改造工艺,其中缺氧反硝化段的微生物大都属于异养型,在酚类有机物的降解方面起了关键作用。
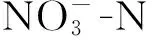
目前,人们针对反硝化降解苯酚的实验研究大都集中于全程反硝化,并未对短程反硝化应用于苯酚降解时的动力学特征及细菌菌群进行系统分析;另外在全程反硝化降解苯酚的菌群研究方面,较多集中于单一菌株的分离鉴定和功能分析,并未对菌群整体结构进行深入研究。为此,本文在同一实验平台上,建立起两个平行的全程与短程反硝化实验装置,分析对比两者在降解苯酚时的动力学特征;利用PCR-DGGE技术分析对比两个装置内的细菌菌群结构,以了解两者间菌群种类的差异性与相似性。本文旨在揭示两种反硝化作用降解苯酚时各自所表现出的行为特征,从而对含酚废水的缺氧反硝化过程进行工艺优化。
1 材料与方法
1.1 实验用水与接种污泥
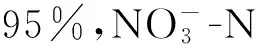
1.2 实验装置
如图1所示,实验装置采用两个相同的1 L反应瓶(A、B),底部磁力加热搅拌,控制反应温度为室温(25±1 ℃),并设置有pH和氧化还原电位(ORP)监测仪。取0.2 L接种污泥进行曝气约30 min,接着对其进行清洗,将污泥中残留的各种杂质清洗去除,然后向污泥中吹入氮气以置换出所含溶解氧。加入0.5 L人工配水。A瓶中氮源为NaNO3,B瓶中氮源为NaNO2,两个反应瓶中污泥浓度均为5.3 g/L .
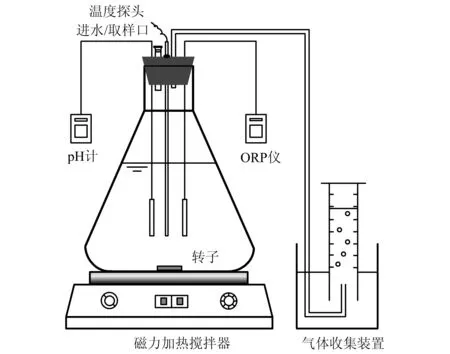
图1 实验装置图
1.3 水质分析项目和检测方法
1.4 反硝化细菌菌群的PCR-DGGE分析步骤
1.4.1 DNA提取与纯化
分别从A、B反应瓶中提取污泥样品,以12 000 r/min离心5 min,弃上清并于-20 ℃下冻存备用,取样量不少于0.5 g .DNA提纯采用改进的蛋白酶K-CTAB法[12]。
1.4.2 PCR(Polymerase Chain Reaction)
PCR扩增的目标基因是16S rDNA,扩增引物选用338F(5’-ACTCCTACGGGAGGCAGCAG-3’)[13-17]和534R(5’-ATTACCGCGGCTGCTGG-3’)[17-19],并在534R的5’端设有GC夹[15-17]。
PCR扩增预制混合液包括:TaqDNA聚合酶(5 U/μL)0.25 μL;反应缓冲液(×10)5 μL,其中Mg2+浓度15 mmol/L;dNTP(2.5 mmol/L)4 μL;引物338F,534R(20 μmol/L)各1 μL;模板DNA 2.5 ng;BSA溶液(10 mg/mL)0.5 μL;加入一定量灭菌Milli-Q水,使混合液体积增至50 μL .
PCR扩增反应过程如下:首先将混合液置于94 ℃下,变性反应10 min;然后开始30次循环反应过程,即于94 ℃下变性1 min,于55 ℃下退火1 min(每个循环降低0.1 ℃),于72 ℃下延伸1.5 min(最后一次延伸10 min);反应完成后置于4 ℃下保存。吸取部分反应液,采用琼脂糖凝胶(1%)电泳检测。整个扩增过程均在MyCycler(Bio-Rad,USA)设备上进行。
1.4.3 DGGE(Denaturing Gradient Gel Electrophoresis)
PCR扩增反应液在采用琼脂糖凝胶(1%)电泳检测后,使用QIAquik Gel Extraction Kit(Qiagen,Germany)对目标片段进行回收,回收后将其溶解于灭菌的Milli-Q水中,以待DGGE分析。DGGE分析于DCode System(Bio-Rad,USA)设备上进行,其参数如下:电压150 V,温度55 ℃,聚丙烯酰胺浓度8%,变性梯度30%~60%,电泳时间7 h.在DGGE完成后,使用硝酸银溶液(0.1%)对凝胶染色,并于GelDoc 2000(Bio-Rad,USA)设备上成像检测。
1.4.4 切胶测序及系统发育树分析
将DGGE条带于紫外灯下进行切割,切下后洗净并溶解于灭菌的Milli-Q水中(60 μL)满24 h,然后吸取20 μL以完成PCR扩增,扩增反应液送交生物公司(Biogenro,北京)进行DNA测序。拟对每条条带实施三次测序,以确保测序的精确度。测序完成后,利用BLAST软件将序列结果与GenBank所含基因序列进行比对及同源性分析,并进一步利用MEGA 6.06软件建立菌群系统发育树。
2 结果与分析
2.1 全程与短程反硝化降解苯酚的动力学特征
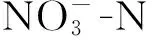

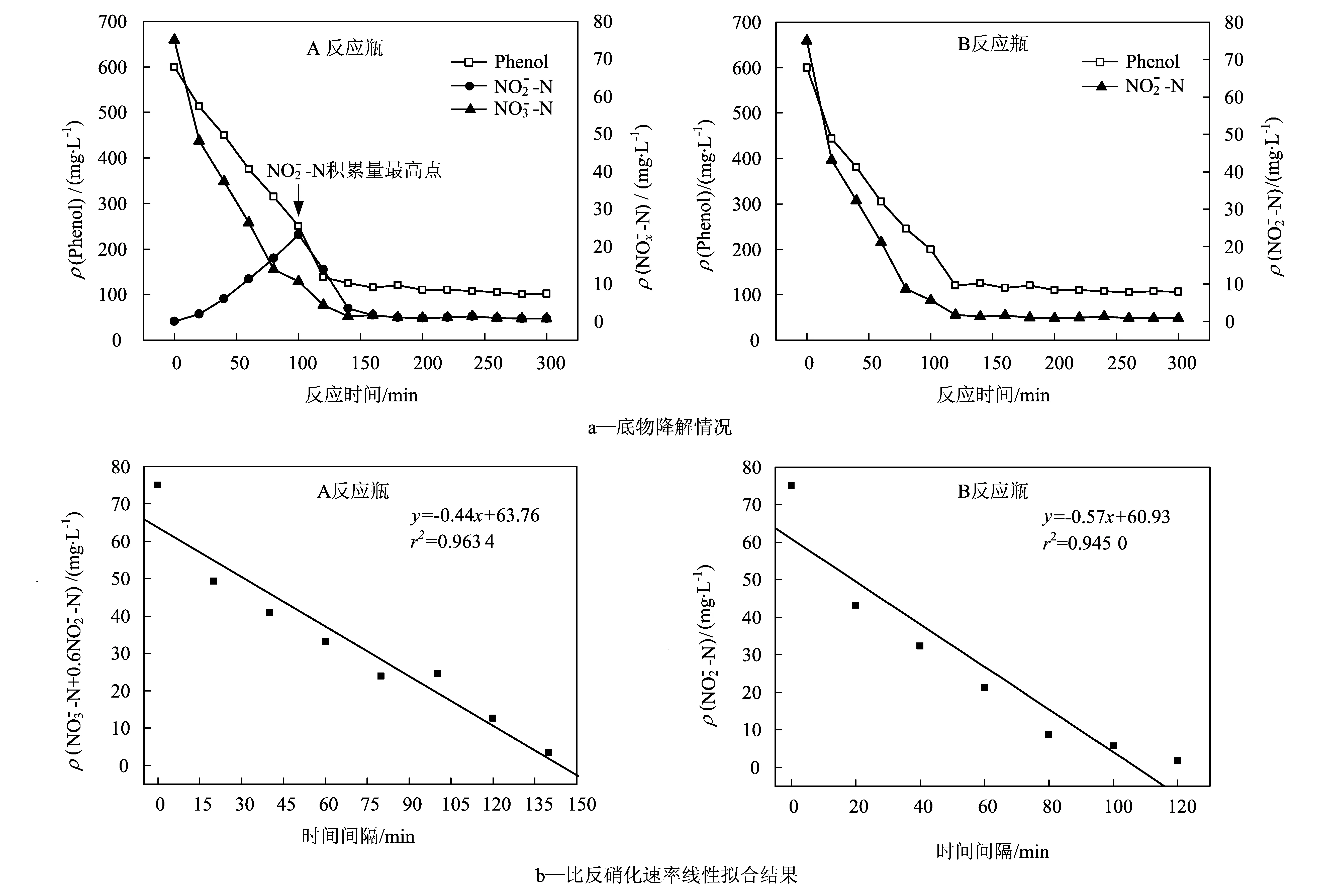
A反应瓶-全程反硝化过程;B反应瓶-短程反硝化过程
2.2 全程与短程反硝化降解苯酚的细菌菌群差异性
如图3-a所示,在DGGE凝胶图谱上一共观察到20条明显的条带,图中N1代表短程反硝化菌群,N2代表全程反硝化菌群,条带基因序列比对结果见表1。
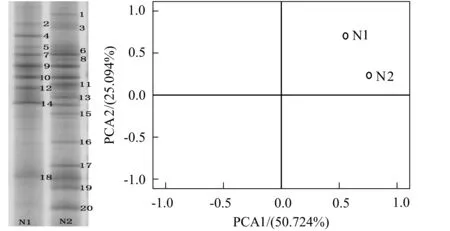
a-DGGE凝胶图谱;b-主成分分析
短程反硝化菌群(N1)条带编号包括2,4,5,7,9,10,12,14,18,共计9条。根据条带亮度及其序列比对结果,优势菌种编号为9和10,它们分别与Pseudomonasbaetica和Stenotrophomonassp.具有100%,99%的同源性。而特有菌种编号为4,它与Simplicispirasp.具有97%的同源性。胡金星等[21]从活性污泥中分离出一株反硝化细菌ADH1,鉴别出它属于Pseudomonassp.,并检测出该菌株具有反硝化功能基因nirS和nosZ;杨浩锋等[22]从移动床生物膜反应器中分离出一株反硝化细菌D3,鉴别出它属于Stenotrophomonassp.;刘树娟等[23]指出硝酸钙能够引起底泥中微生物群落多样性增加,优势菌属包括反硝化细菌Simplicispirasp.和Rhodanobactersp.等。据此推测,短程反硝化体系的优势菌种和特有菌种均具有反硝化功能。
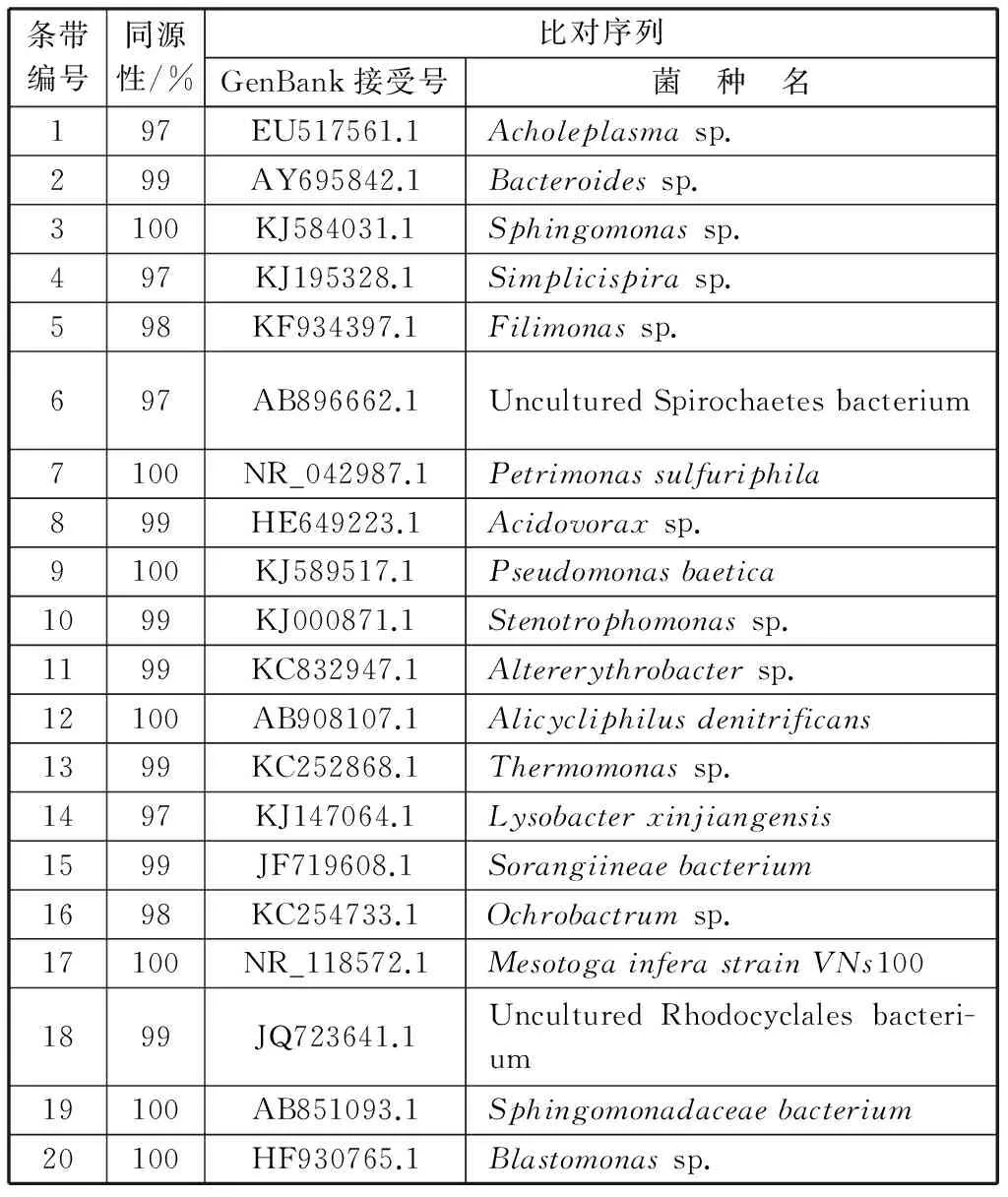
表1 20条序列的NCBI GenBank比对结果
全程反硝化菌群(N2)条带编号包括1,2,3,5,6~20,共计19条。根据条带亮度及其序列比对结果,优势菌种编号为9和10,这与N1相同,表明它们既可以利用亚硝态氮也可以利用硝态氮作为电子受体。而特有菌种的条带数共计11条,其中亮度较为显著的菌种编号为11,它与Altererythrobactersp.具有99%的同源性。丁鹏元等[24]研究了A/O工艺处理石化废水的污泥微生物群落,结果表明在属的水平鉴定出的Altererythrobactersp.具有降解多环芳烃的功能。

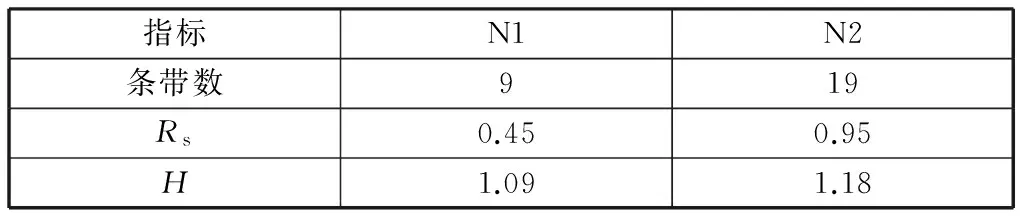
表2 菌群丰富度值(Rs)和Shannon-Weiner指数(H)
2.3 全程与短程反硝化降解苯酚的细菌菌群相似性
两组菌群的DGGE图谱主成分分析见图3-b,代表全程与短程反硝化菌群的坐标点均处于第二象限,表明二者之间具有一定联系,菌群培养具有相互转化的可能性。全程与短程反硝化降解苯酚的共有菌种编号为2,5,7,9,10,12,14和18,它们分别隶属于几类变形菌纲和拟杆菌纲。如图4所示,全程和短程反硝化体系的细菌菌纲均以Alphaproteobacteria,Betaproteobacteria,Gammaproteobacteria和Bacteroidetes为主,前三个菌纲归为变形菌门(Phaproteobacteria),最后一个菌纲归为拟杆菌门(Bacteroidetes)。变形菌门是缺氧和厌氧反应器中常见的细菌类群,尤其是β-变形菌纲。另外在市政污水和工业污水处理厂的污泥中,占有优势的细菌菌群均被发现是变形菌[26-27],该类细菌在降解污染物的过程中发挥着十分重要的代谢功能。拟杆菌门包括三大类细菌,即拟杆菌纲、黄杆菌纲、鞘脂杆菌纲,许多研究者发现在各种降解有机污染物的活性污泥中都存在拟杆菌门的细菌,该菌门是污水生物处理细菌菌群的重要组成部分[28-29]。
两组菌群的系统发育树如图5所示,树图显示短程反硝化体系的隶属于Simplicispirasp.的特有菌种(No.4)与全程反硝化体系的隶属于Thermomonassp.的特有菌种(No.13)在系统发育上存在较亲近的遗传关系。常玉梅等[30]进行了城市污水厂活性污泥强化自养反硝化菌的研究,结果显示反应器中起反硝化作用的细菌菌属包括Thermomonassp.,Thiobacillusdenitrificans等。此外,根据韩钰洁[31]的研究结论,Simplicispirasp.和Thermomonassp.这两种菌属在厌氧环境下都具有降解苯酚的功能。
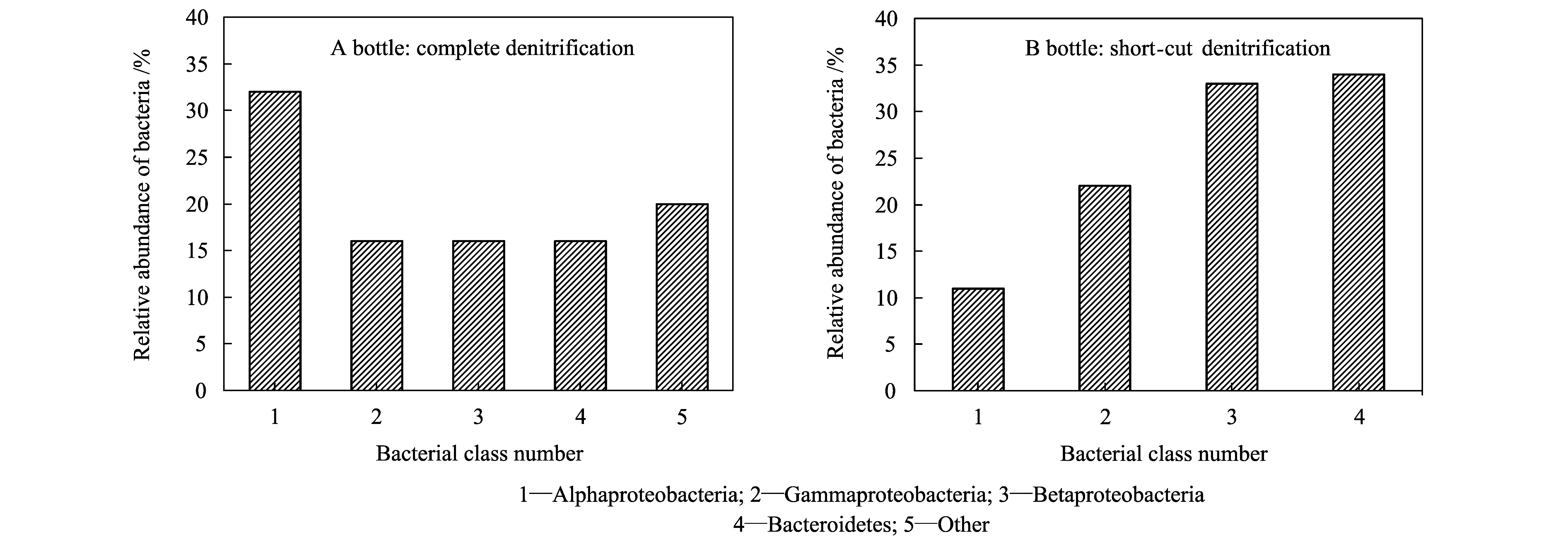
图4 全程与短程反硝化降解苯酚的细菌菌纲相对丰度
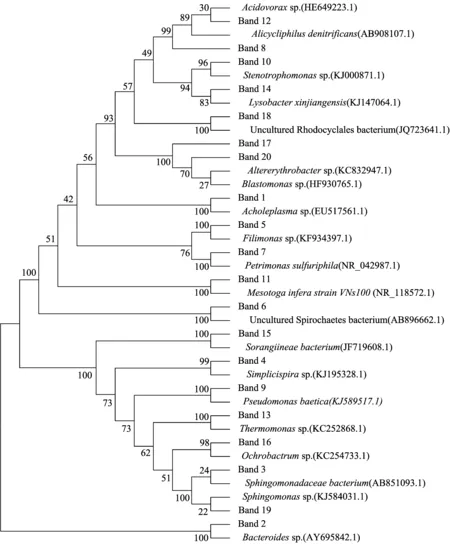
图5 全程与短程反硝化降解苯酚的菌群系统发育树
3 结论
1) 全程和短程反硝化降解苯酚的过程分为底物降解和稳定两个阶段,在底物浓度达到稳定时,苯酚和硝态氮(亚硝态氮)的去除率均在83%,99%左右;全程和短程反硝化降解苯酚的比反硝化速率(以N元素计)分别为4.98,6.45 mg/(g·h) .
2) 全程反硝化菌群的丰富度值和多样性指数要高于短程;全程反硝化体系的特有菌种较多,其中与Altererythrobactersp.同源性较高的菌种在数量上占有优势,而短程反硝化体系的特有菌种与Simplicispirasp.同源性较高。
3) 全程与短程反硝化降解苯酚的细菌菌纲均以几类变形菌纲(Alphaproteobacteria,Betaproteobacteria,Gammaproteobacteria)和拟杆菌纲(Bacteroidetes)为主;根据DGGE图谱主成分分析,代表全程与短程反硝化菌群的坐标点均处于第二象限;根据系统发育树分析,短程反硝化体系的隶属于Simplicispirasp.的特有菌种与全程反硝化体系的隶属于Thermomonassp.的特有菌种在系统发育上存在较亲近的遗传关系。
[1] 徐玉泉,张维,陈明,等.一株苯酚降解菌的分离和鉴定[J].环境科学学报,2000,20(4):450-455.
[2] 徐夫元,李星,陈英文,等.无机阴离子对CuO-H2O2氧化苯酚废水的影响[J].环境科学,2009,30(2):451-456.
[3] 张芳,李光明,盛怡,等.三维电解法处理苯酚废水的粒子电极研究[J].环境科学,2007,28(8):1715-1719.
[4] Li Xiaoyan,Cui Yuhong,Feng Yujie,et al.Reaction pathways and mechanisms of the electrochemical degradation of phenol on different electrodes[J].Water Res,2005,39(10):1972-1981.
[5] 陈春,李文英,吴静文,等.焦化废水中苯酚降解菌筛选及其降解性能[J].环境科学,2012,33(5):1652-1656.
[6] 时孝磊,丁丽丽,任洪强,等.厌氧-缺氧-预曝气-移动床生物膜系统对焦化废水特征有机污染物降解研究[J].环境科学学报,2010,30(6):1149-1157.
[7] Ma Y,Chen L Q,Peng Y Z,et al.Short-cut/complete nitrification and denitrification in a pilot-scale plant treating actual domestic wastewater[J].Journal of Environmental Science,2006,27(12):2477-2482.
[8] 马召坤,严喜鸾,刘国金,等.SBR反应器中反硝化条件下去除苯酚工艺[J].工业水处理,2007,27(3):34-37.
[9] 黄丹,王竞,李培良,等.Shewanellasp.XB缺氧反硝化降解苯酚[J].环境工程学报,2014,8(4):1345-1349.
[10] 刘圣昔,李斌.麝香草酚分光光度法的应用[J].中国现代医药杂志,2006,8(4):57-59.
[11] 李亚新,赵晨红.紫外分光光度法测定焦化废水的主要污染物[J].中国给水排水,2001,17(1):54-56.
[12] Yang P C,Smith P A,Krupka J,et al.The losses of microwave ferrites at communication frequencies[J].Journal of the European Ceramic Society,2006,27(8):2765-2770.
[13] Nobuyuki yoshida,Kazuhiro Yagi,Daisuke Sato,et al.Bacterial communities in petroleum oil in stockpiles[J].J Biosci Bioeng,2005,99(2):143-149.
[14] Ishii K,Fukui M.Optimization of annealing temperature to reduce bias caused by a primer mismatch in multitemplate PCR[J].Appl Environ Microbiol,2001,67(8):3753-3755.
[15] Kjellerup B V,Veeh R H,Sumithraratne P,etal.Monitoring of microbial souring in chemically treated,produced-water biofilm systems using molecular techniques[J].Journal of Industrial Microbiology and Biotechnology,2005,32(4):163-170.
[16] Teske A,Sigalevich P,Cohen Y,et al.Molecular identification of bacteria from a coculture by denaturing gradient gel electrophoresis of 16s ribosomal DNA fragments as a tool for isolation in pure cultures[J].Appl Environ Microbiol,1996,62(11):4210-4215.
[17] Muyzer G,Brinkhoff T,Ulrich N,et al.Denaturing gradient gel electrophoresis (DGGE) in microbial ecology[J].Molecular Microbial Ecology Manual,1998,3.4.4:1-27.
[18] Suzuki K,Koyanagi M,Yamashita H.Genetic characterization and specific detection of beer-spoilagelactobacillussp.la2 and related strains[J].J Appl Microbiol,2004,96(4):677-683.
[19] Takeaki Hashizume,Chikako Takai,Manami Naito,et al.Characteristics of the mucus layer on the surface of the bluegill (lepomis macrochirus) and the bacterial flora in the mucus[J].Microbes and Environments,2005,20(1):69-80.
[20] Katarzyna Kujawa,Bram Klapwijk.A method to estimate denitrification potential for predenitrification systems using NUR batch test[J].Water Res,1999,33(10):2291-2300.
[21] 胡金星,汤江武,王新,等.一株反硝化细菌的鉴定、功能基因检测及其反硝化特性[J].环境科学与技术,2012,35(12):27-32.
[22] 杨浩锋,唐佳玙,胡安辉,等.一株反硝化细菌的分离鉴定及其反硝化特性[J].环境工程学报,2014,8(1):366-371.
[23] 刘树娟,陈磊,钟润生,等.硝酸钙对河流底泥中含硫化合物嗅味原位控制[J].环境科学研究,2012,25(6):691-698.
[24] 丁鹏元,初里冰,张楠,等.O池溶解氧水平对石化废水A/O工艺污染物去除效果和污泥微生物群落的影响[J].环境科学,2015,36(2):604-611.
[25] Zhi Wei,Ji Guodong.Quantitative response relationships between nitrogen transformation rates and nitrogen functional genes in a tidal flow constructed wetland under C/N ratio constraints[J].Water Res,2014,64:32-41.
[26] Juretschko S,Loy A,Lehner A,et al.The microbial community composition of a nitrifying-denitrifying activated sludge from an industrial sewage treatment plant analyzed by the full-cycle rRNA approach[J].Systematic and Applied Microbiology,2002,25(1):84-99.
[27] Akira Hiraishi,Mitsuru Iwasaki,Hisashi Shinjo.Terminal restriction pattern analysis of 16s rRNA genes for the characterization of bacterial communities of activated sludge[J].J Biosci Bioeng,2000,90(2):148-156.
[28] Rani A,Porwal S,Sharma R,et al.Assessment of microbial diversity in effluent treatment plants by culture dependent and culture independent approaches[J].Bioresource Technology,2008,99(15):7098-7107.
[29] Moura A,Tacao M,Henriques I,et al.Characterization of bacterial diversity in two aerated lagoons of a wastewater treatment plant using PCR-DGGE analysis[J].Microbiological Research,2009,164(5):560-569.
[30] 常玉梅,杨琦,郝春博,等.城市污水厂活性污泥强化自养反硝化菌研究[J].环境科学,2011,32(4):1210-1216.
[31] 韩钰洁.焦化废水特征有机污染物厌氧产甲烷降解特性研究[D].太原:太原理工大学,2014.
(编辑:杨 鹏)
Comparison of Dynamic Characteristic and Bacterial CommunityStructure on Phenol Degradating Between Complete andShort-cut Denitrification System
ZHANG Xiaomei,YUE Xiuping,WANG Guoying,MI Jing,BO Hongmiao
(CollegeofEnvironmentalScienceandEngineering,TaiyuanUniversityofTechnology,Taiyuan030024,China)
Two parallel devices of complete and short-cut denitrification were established under the same experimental conditions.Phenol was used as carbon source in the experiment.In two devices,the removal rates of phenol were both about 83%,and the removal rate of nitrate or nitrite nitrogen was 99%.The specific denitrification rate (RDN) was 4.98 and 6.45 mg N/(g VSS·h) respectively in the complete and short-cut denitrification system.Through PCR-DGGE and rubber cutting sequencing,the bacterial community structures of two denitrification systems were analyzed.In the complete denitrification system,the richness value (Rs) and diversity index (H) of bacterial flora were higher; In the two denitrification systems,the classes of bacteria were mainly Proteobacteria (α-,β-,δ-) and Bacteroidetes; According to the result of principal component analysis (PCA),bacteria communities of two systems had a certain relationship and could be cultivated and transformed mutually;From the analysis of phylogenetic tree,a close genetic relationship was found between specific strains related to Simplicispira sp.(short-cut denitrification) and Thermomonas sp.(complete denitrification).
phenol degradating;complete denitrification;short-cut denitrification;specific denitrification rate;bacterial community structure
1007-9432(2015)06-0768-07
2015-04-29
国家自然科学基金资助项目:含氮杂环化合物在厌氧同时反硝化产甲烷体系中的降解性能研究(51378330)
张小妹(1984-),女,山东青岛人,博士生,主要从事水污染控制研究,(Tel)13835177057,(E-mail)93667187@qq.com
岳秀萍(1963-),女,博士,教授,博导,主要从事环境生物技术、废水处理理论与技术、废水回用理论与技术的研究, (E-mail)yuexiuping1990@126.com
X703
A
10.16355/j.cnki.issn1007-9432tyut.2015.06.024
