果梗在梅鹿辄干红葡萄酒酿造中的作用
2015-06-20郭敏瑞南立军程少波袁青锋游佳鸿陈国刚
郭敏瑞,南立军,程少波,张 静,袁青锋,陈 琼,游佳鸿,陈国刚*
(1.石河子大学 食品学院,新疆 石河子 832000;2.新疆生产建设兵团第十三师农科所,新疆 哈密 839000)
梅鹿辄葡萄原产法国波尔多,20世纪80年代引入我国[1]。梅鹿辄被誉为红葡萄的公主,是最受欢迎的红葡萄品种。梅鹿辄成熟速度快,颜色呈宝石红色,浆果含糖量180~195 g/L,含酸量7~9 g/L,出汁率70%~75%,适宜酿制美味而柔滑的葡萄酒[2-3]。
在葡萄酒酿造中,根据品种和工艺的需要可以选择去除果梗或不去果梗,从而获得不同风味的葡萄酒。对葡萄酒品质有利的果梗,通常保留部分或全部。在葡萄酒发酵过程中,常常通过监测发酵液比重的变化来判断葡萄酒发酵是否正常或结束[4]。pH值则影响着葡萄酒发酵过程中的许多生化反应,从而影响着葡萄酒的品质[5]。花色苷是葡萄酒中主要的呈色物质,在溶解状态下,花色苷稳定性容易受到辅助色素、温度、光、pH值及其自身含量的影响[6-7]。在葡萄酒酿造过程中,是否保留果梗或保留果梗的多少与葡萄品种和所酿葡萄酒的品质有关。
新疆哈密光热资源充足,气候干燥,昼夜温差大,病虫害少,生产优质的酿酒葡萄具有得天独厚的气候条件。本实验初步研究了梅鹿辄干红葡萄酒酿造过程中4种不同果梗含量的发酵液的比重、pH值以及花色苷含量的变化,对梅鹿辄干红葡萄酒的酿造和工艺优化具有重要的理论和实践意义。
1 材料与方法
1.1 材料与试剂
梅鹿辄红葡萄,树龄为3~5年,生长状况良好,四月下旬萌芽,六月上旬开花,九月下旬果实成熟,生长期为155 d,成熟果粒呈卵圆形,紫黑色,采自新疆哈密。酵母RC212:法国进口酵母,购买于新疆石河子张裕葡萄酒庄。乳酸杆菌(Lactobacillus):石河子大学食品学院微生物实验室保存菌种。
葡萄糖、次甲基蓝、硫酸铜、酒石酸钾钠、氢氧化钠、酚酞、氯化钾、醋酸钠、偏重亚硫酸钾均为分析纯:国药集团化学试剂有限公司。
1.2 仪器与设备
XE30-比重计(0.9~2.5 g/cm3):北京天连和谐仪器仪表有限公司;PHS-3D型pH计:乐清市西埃姆西测量器具有限公司;722光栅可见分光光度计:上海分析仪器厂;DL203型电子天平:上海精密科学仪器有限公司;DK-8D型电热恒温水浴锅:江苏省金坛市医疗仪器厂;XYJ-A型电动离心机:江苏省金坛市恒丰仪器厂;RA-130手持式折光仪:上海天垒仪器仪表有限公司;全玻璃蒸馏器500 mL:江门市蓬江区易成化玻仪器有限公司;酒精计:沧县津玻玻璃仪器。
1.3 试验方法
1.3.1 酿酒工艺流程
红葡萄→分选→除梗、破碎→酒精发酵(20~29℃)→分离→苹果酸-乳酸发酵(18~20℃)→倒桶、陈酿→澄清
操作说明:
分选:将大小均匀,无机械伤,颜色均匀一致的葡萄分选出来。
除梗破碎:将葡萄果粒与果梗分离、称质量,分别放置在经二氧化硫杀菌过的容器中,然后将葡萄果粒用手捏碎,加入0.18 g/L偏重亚硫酸钾[8-9]。
酵母活化方法:葡萄汁与软化水1∶1混合,酵母与混合液按照质量比1∶10混合,在40℃水浴加热条件下搅拌30 min。
酒精发酵:将破碎过的葡萄装入10 L玻璃发酵罐中,装量约为容器的4/5,入罐12 h以后,接入已经活化好的酿酒酵母(干酵母添加量0.1 g/L)。用湿纱布将容器口盖严,早晚各搅拌一次,常温发酵,控制温度在24~29℃之间,发酵周期11 d。
分离:待酒精发酵完成,还原糖含量<4 g/L时,用杀过菌的纱布将葡萄皮渣分离出来,葡萄酒重新装进新的罐中,满罐储存,进行后续的苹果酸-乳酸发酵。
苹果酸-乳酸发酵:接种乳酸菌进行苹果酸-乳酸发酵,接种量为8 mg/L,温度控制在18~20℃之间,周期为20 d。
倒桶、陈酿:倒桶的目的是为了除去自然沉淀的酒泥,过滤后的葡萄酒重新装罐添加0.18 g/L偏重亚硫酸钾,进行陈酿,周期为2~8月。
葡萄果粒分选后,进行四个处理:①无果梗:即该罐中全为果粒,不含果梗;②1/6果梗:即保留该罐葡萄果粒所产生果梗的1/6,同时发酵;③1/3果梗:即保留该罐葡萄果粒所产生果梗的1/3,同时发酵;④全果梗:即保留该罐葡萄果粒所产生的全部果梗,同时发酵。
1.3.2 分析检测
酒精度的测定采用酒精计法;总酸的测定采用酸碱滴定法;可溶性固形物含量的测定采用手持式测糖仪直接测定粗糖含量;还原糖的测定按照GB/T 15038—2006《葡萄酒、果酒通用分析方法》中的方法进行;比重的测定直接将比重计放在装有葡萄发酵液的100 mL量筒中,待比重计上浮,进行读数;pH值测定采用pH计测定;花色苷含量的测定[10]:取1 mL的试样,分别用pH 1.0和pH 4.5的缓冲液稀释定容至10 mL达到平衡后,以蒸馏水调零点,分别在波长510 nm和700 nm处测定其吸光度值。花色苷含量计算公式如下:
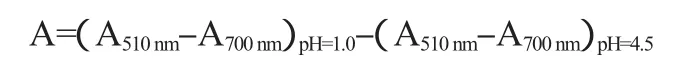
式中:A为吸光度差值;A510nm、A700nm为在波长510 nm、700 nm处的吸光度值。

式中:W为总色苷含量,%;A为吸光度差值;ε为矢车菊-3-葡萄糖苷的摩尔吸光系数,26 900;DF为稀释因子;Mw为矢车菊-3-葡萄糖苷的分子质量,449.2 u;V为取样体积,mL;Wt为样品质量,g。
1.3.3 数据统计分析
实验结果数据采用Origin7.5软件作图。
2 结果与分析
2.1 发酵结束时各项理化指标
经挑选的葡萄按照工艺进行除梗(或不除梗)、破碎,破碎率达到85%,接入活化的酵母菌种,接种量0.1 g/L,进行常温(24~29℃)酒精发酵11 d,主发酵结束。4种不同果梗含量的梅鹿辄干红葡萄原酒发酵第10天分离皮渣后的基本理化指标见表1。

表1 酒精发酵结束时不同处理梅鹿辄干红葡萄原酒的理化指标Table 1 Physiochemical indicators of Merlot dry red wine with different treatments at the end of ethanol fermentation
由表1可知,发酵第10天,所有处理的还原糖含量均<4 g/L,酒精度在10%vol~15%vol,并且其他各项指标满足国标GB 15037—2006《葡萄酒》的要求。以这些数据为理论基础,分离葡萄皮渣,进行后续的苹果酸-乳酸发酵。
2.2 发酵液比重随时间变化规律
比重的下降实际上是发酵液内在成分变化的外在表现,本质是发酵液中还原糖消耗、酒精度增加[11]。4种不同处理梅鹿辄干红葡萄酒发酵过程中比重随时间的变化见图1。图1结果显示,随着发酵时间的不断延长,葡萄汁的比重呈下降趋势,当发酵液比重值<0.996,还原糖含量<4 g/L时,发酵结束。发酵第1~3天,由于发酵温度较低,酵母菌活性较弱,转化率低,导致比重变化趋势较平缓;发酵4~7 d,由于酒精发酵产生了大量的热量,导致发酵温度快速上升至27~29℃,酵母菌活性进一步增强,进而加速了糖份分解,比重下降显著;发酵8~11 d,葡萄皮经过前期的发酵、溶解,组织结构被分解软化,导致整个发酵液中的氧气和酵母发酵的底物糖消耗殆尽,酵母的活性降低,最终导致后期比重变化平缓。发酵至第11天,酒精发酵结束。

图1 不同处理对梅鹿辄葡萄酒发酵过程中比重的影响Fig.1 Effect of different grape stems treatments on the specific gravity of Merlot dry red wine during fermentation
由图1可知,发酵过程中,各发酵罐中果梗含量不同,导致发酵液的比重变化不同。含有果梗的发酵罐,由于果梗与葡萄汁之间存在大量缝隙,有足够的氧气,酵母菌大量繁殖,当温度上升至27℃左右时,酵母菌活性较强,转化率提高,比重变化量大。没有果梗的发酵罐,仅靠果粒的缝隙和有限的开放式搅拌次数提供有限的氧气,致使酵母菌繁殖能力受限,发酵速度比其他发酵罐慢。但是由于果梗的比例不同,发酵罐中的空隙也存在差异:空隙过大,会导致发酵罐散热速度加快,温度降低快,影响酵母菌发酵的速度;空隙过小,没有充足的氧气供给,酵母菌繁殖受限。从比重指标来看,果梗含量在1/6时,最有利于葡萄酒发酵,发酵第10天时,比重降至0.996,还原糖含量3.941 g/L,相比其他处理的葡萄酒提前1 d结束酒精发酵。
2.3 发酵液的pH值随时间的变化规律
在葡萄酒酿造过程中,许多生化反应都与pH值有关,pH值的变化直接或间接的影响着葡萄酒的品质[5]。因此有效的控制pH值对葡萄酒的稳定性有重要的意义[12]。葡萄酒酒精发酵的微生物主要是葡萄酒酵母菌,pH值的改变往往会引起酵母菌代谢途径的改变,使代谢产物发生变化。为保证酵母菌进行正常发酵,最好控制pH值在2.8~3.5[5]。4种不同果梗含量的葡萄发酵液的pH值变化见图2。
由图2可知,发酵过程是动态的变化过程,葡萄汁的标准pH值在3.5~3.8,为保证葡萄酒发酵的正常进行,保证酵母菌在数量上占绝对优势,葡萄酒发酵最好把pH值控制在3.3~3.5。pH值容易受到温度、总酸等因素的影响。发酵第1~2天,酵母菌开始将还原糖转化为酒精,发酵液酸性增强,pH值减小[5];随着发酵时间的延长,发酵液发生复杂的生化反应。发酵第5~6天,发酵液比重值变化率较大,发酵液总酸含量略有下降,pH值开始慢慢的回升,第7天,发酵温度增加,总酸含量增加,pH值回落;发酵第10天,pH值在3.5~3.8之间。从图2可以看出,全果梗的pH值始终大于其他3种处理,葡萄果梗中含有酒石咖啡酸、反式酒石咖啡酸和反式酒石香豆酸,这些物质是酿酒葡萄的主要酚酸[13],由此可见,果梗的存在对发酵液pH值有显著的影响。发酵结束时,无果梗pH值为3.66、1/6果梗pH值为3.52、1/3果梗pH值为3.72、全果梗pH值为3.78。从pH值指标来看,果梗含量为1/6时对发酵有益。
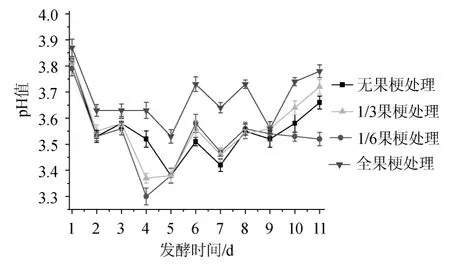
图2 不同处理对梅鹿辄葡萄酒发酵过程中pH值的影响Fig.2 Effect of different grape stems treatments on the pH of Merlot dry red wine during fermentation
2.4 发酵液花色苷含量的变化
花色苷是葡萄酒中的一种色素类物质[14-18],在生理环境下表现出强烈的抗氧化、清除自由基等生物活性,是目前发现的最有效的水溶性自由基清除剂。但是,花色苷成分的稳定性较差[19],易受pH值和温度等因素的影响发生降解反应,也易与蛋白等成分发生聚合褐变。葡萄酒中花色苷的种量受酿酒葡萄原料与生态环境的影响,也受酿造工艺方法等因素的影响[20-21]。4种不同处理的葡萄酒样品的花色苷含量随时间变化的结果见图3。

图3 不同处理对梅鹿辄葡萄酒发酵过程中花色苷含量的影响Fig.3 Effect of different grape stems treatments on the anthocyanin content of Merlot dry red wine during fermentation
从图3可以看出,全果梗和1/6果梗发酵液的花色苷含量变化趋势较平稳,而无果梗和1/3果梗发酵液在发酵过程中花色苷含量出现了骤升骤降。第5~6天时,发酵温度显著升高,花色苷与其他物质的聚合度降低,花色苷发生水解反应[22],花色苷含量降低;而全果梗发酵液的花色苷含量没有下降反而上升,是由于果梗含量较多,一方面果梗中的花色苷随着葡萄汁的浸渍进入发酵液中;另一方面果梗间的缝隙也使得散热速度加快,果梗中的单宁作为辅助色素[22]也会使得葡萄酒中的花色苷更加稳定。发酵第6~8天,无果梗发酵液pH值下降,低pH值有利于花色苷的浸提,适当的光照有利于花色苷的合成,导致花色苷含量上升[23]。发酵结束时,无果梗花色苷含量32.897 mg/L、1/6果梗30.046mg/L、1/3果梗26.879mg/L、全果梗28.561 mg/L,从花色苷指标来看,无果梗的花色苷提取最为充分,但是无果梗发酵过程中不稳定,所以果梗含量为1/6时对发酵有益。
3 结论
比重、pH值和花色苷在干红葡萄酒酿造过程中对葡萄酒发酵影响显著,而葡萄果梗的添加对比重、pH值和花色苷含量的变化也有显著影响。以新疆哈密梅鹿辄葡萄酿造的干红葡萄酒的实验结果表明:
葡萄酒发酵速度的快慢与果梗添加量密切相关,比重的下降是发酵液糖分变化的内在表现,通过控制果梗含量,比较发酵过程中发酵液比重的变化,得到果梗最适宜添加量为1/6,此时的比重降低最明显,发酵第10天比重就降至0.996,还原糖为3.941 g/L。
在葡萄酒酿造过程中,葡萄果梗的添加量直接影响着葡萄酒发酵过程中pH值的变化。葡萄酒发酵最佳pH值控制在3.3~3.5之间,发酵结束时,1/6果梗处理的葡萄酒的pH值为3.52。
葡萄酒的颜色来源于葡萄皮中的花色苷,花色苷决定着干红葡萄酒的色泽。研究发现,果梗添加量为1/6的葡萄酒花色苷含量在整个发酵期间更稳定,提取也较充分。有利于后期葡萄酒颜色形成。
因此,添加1/6果梗葡萄酒发酵过程中最为稳定,对后期梅鹿辄干红葡萄酒的成熟稳定最有利,为后期能酿造出高品质的葡萄酒奠定稳定的基础。
[1]莫寅斌.HPLC法测定梅鹿辄葡萄与葡萄酒中的花色素苷[J].安徽农业科学,2012,40(4):2278-2279,2404.
[2]缪成鹏,张 晖,杨晓雁.可同化氮含量对赤霞珠葡萄酒发酵和香气成分的影响[J].中国酿造,2015,34(1):137-142.
[3]刘一健,孙剑锋,王 颉.葡萄酒酚类物质的研究进展[J].中国酿造,2009,28(8):5-9.
[4]高 畅,毛晓辉,吴秀飞,等.干红葡萄酒发酵过程中发酵液比重下降与生成酒精浓度关系的研究[J].中外葡萄与葡萄酒,2011(1):16-18.
[5]冷慧娟.催陈处理对赤霞珠葡萄酒品质的影响[D].济南:齐鲁工业大学硕士论文,2014.
[6]LAGO-VANZELA E S,PROCOPIO D P,FONTES E A F,et al.Aging of red wines made from hybrid grape cv.BRS Violeta:Effects of accelerated aging conditions on phenolic composition,color and antioxidant activity[J].Food Res Int,2014,56(2):182-189.
[7]WU Y C,WANG Y,ZHANG W L.Extraction and preliminary purification of anthocyanins from grape juice in aqueous two-phase system[J].Sep Purif Technol,2014,124:170-178.
[8]陈 洁,李 皓,杨登想.橘子酿造酒发酵工艺参数的探讨[J].酿酒科技,2011(3):80-83.
[9]陈清婵,简清梅,王劲松,等.蜜橘果酒发酵工艺[J].中国酿造,2015,34(1):168-171.
[10]孙婧超,刘玉田,赵玉平,等.pH示差法测定蓝莓酒中花色苷条件的优化[J].中国酿造,2011,30(11):171-174.
[11]栗 甲,李娇娇,施云鹏.葡萄酒发酵过程比重与还原糖消耗及酒精生成量关系研究[J].酿酒科技,2015(2):76-77,80.
[12]杨晓雁,袁春龙,张 晖,等.酒度、总酸、pH值以及饮用温度对干红葡萄酒涩味的影响[J].食品科学,2014,35(21):118-123.
[13]张 莉,刘树文,王 华.葡萄果梗在红葡萄酒酿造中的应用[J].中外葡萄与葡萄酒,2003(5):14-16.
[14]BIASOTO A C T,CATHARINO R R,SANVIDO G B,et al.Flavour characterization of red wines by descriptive analysis and ESI mass spectrometry[J].Food Qual Prefer,2010,21(7):755-762.
[15]李 琪,李 广,金丽琼,等.HPLC法测定甘肃地产不同品种酿酒葡萄中的花色苷[J].中国酿造,2014,33(3):132-136.
[16]郝笑云,王 宏,张军翔.酚类物质对红葡萄酒颜色影响的研究进展[J].现代食品科技,2013,29(5):1192-1197.
[17]史明科,郭金英,任国艳,等.葡萄酒酚类物质研究进展[J].酿酒科技,2012(4):17-20.
[18]黎莉妮,蔡丽霞,曾艳娴,等.桃红葡萄酒酿造工艺优化研究[J].中国酿造,2014,33(3):67-70.
[19]于庆泉,段长青.蛇龙珠葡萄酒酿造过程中颜色变化规律研究[J].中国酿造,2006,25(11):28-30.
[20]REVILLA E,GARCLA-BENEYTEZ E,CABELLO F,et al.Value of high-performance liquid chromato graphic analysis of anthocyanins in the differentiation of red grape cultivars and red wines made from them[J].J Chromatogr A,2001,915:53-60.
[21]NICOLA F,MARIO C,RAFFAELE R,et al.Indigenous yeast communities in the environment ofRovello biancogrape variety and their use in commercial white wine fermentation[J].World J Microb Biot,2010,26(2):337-351.
[22]刘婷婷.辅色素对葡萄酒花色苷辅色作用及颜色影响的研究[D].无锡:江南大学硕士论文,2014.
[23]陈颖秋,黄永俊,马小星,等.红葡萄酒花色苷的研究[J].云南农业,2011(9):33-35.
