均匀设计法优化重组大肠杆菌产酮基还原酶培养基
2015-06-16石小丹等
石小丹等


摘 要:系统研究了典型碳源、 氮源、金属离子、磷酸盐以及初始pH值等因素对重组大肠杆菌产酮基还原酶的影响。单因素试验结果表明,甘油、酵母浸粉FM888、酵母蛋白胨FP101、MgSO4· 7H2O以及离子浓度为0.1 mol·L-1 pH 值为T7 的磷酸缓冲液对菌体生长以及酶活的表达有一定的促进作用。通过均匀设计试验及分析得到培养基的最优配方:甘油 6.86 g·L-1, FM888 19.53 g·L-1, FP101 8.37 g·L-1, MgSO4· 7H2O 2.50 g·L-1, K2HPO4 14.96 g·L-1, KH2PO4 7.34 g·L-1。优化条件下酶活为431.21 U·mL-1,比优化前(70.25 U·mL-1)提高了5.13倍。此研究可为工业化大生产提供理论指导。
关键词:酮基还原酶;重组大肠杆菌;培养基优化;均匀设计
中图分类号:TQ920.1 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2015.06.001
Abstract: The effects of a number of factors on the production of keto reductase were systematically studied, typically including carbon source, nitrogen source, phosphate and initial pH. The research results of single factor experiment showed that the growth and enzyme activity were promoted by glycerin, yeast extract FM888, yeast peptone FP101, MgSO4 ·7H2O, and phosphate buffer with pH 7 and 0.1 mol·L-1 ion concentration. Through uniform design experiments, the optimal conditions were obtained as follows: Glycerol 6.86 g·L-1, FM888 19.53 g·L-1, FP101 8.37 g·L-1, MgSO4 7H2O 2.50 g·L-1, K2HPO4 14.96 g·L-1, KH2PO4 7.34 g·L-1. Under the optimal conditions, the activity of keto reductase reached 431.21 U·mL-1, which was 5.13 times greater than that of the basic fermentation conditions previously(70.25 U·mL-1). This research could provide theoretical guidance for large-scale production of keto reductase.
Key words: keto reductase; recombinant Escherichia coli; medium formulation optimization; uniform design
酮基还原酶(Keto reductase, KR)是一类依赖还原型辅酶Ⅱ(Nicotinamide adenine dinucleotide hydro-phosphate acid, NADPH)将酮类化合物不对称性还原成手性化合物的氧化还原酶,在手性化合物合成与拆分领域中具有广泛用途。在酮基还原酶的作用下,价格低廉的酮类化合物可被催化还原成手性前体物,这将成为制药工业的一种新的工艺技术思路[1]。例如4-氯乙酰乙酸乙酯(4-chloroacetoacetate, COBE)经酮基还原酶转化为手性化合物4-氯-3-羟基-丁酸乙酯(4-chloro-3-hydroxybutyrate, CHBE),后者是合成L-肉碱的前提物[2]。但由于天然酶的表达量较低,因此利用基因克隆技术,将含有KR基因的质粒重组到大肠或者酵母细胞[3]中表达目标酶成为了研究热点。目前,国内外对KR的研究仍仅限于基因的改造和优化方面的研究[4-6],对于重组菌发酵生产KR的影响因素及过程调控方面的研究甚少,尤其是针对重组大肠杆菌发酵生产KR的培养基优化方面的报道从未见到。
均匀设计(Uniform design,UD)是中国数学工作者方开泰等[7]于 20 世纪 70年代末提出的一种新的多因素多水平试验设计方法,其出发点是将试验点在试验范围内安排均匀分散,使试验点在数值积分范围内散布均匀,使布点离被积函数的各种值充分接近,所用试验点不多却能使积分值得到很好的近似[8]。它与正交设计、响应面方法等其他试验设计法的最大不同之处就在于,能从尽可能少的试验次数中揭示出因素对指标的影响大小和规律;能以最少的次数, 从多个因素中找出影响试验结果的各因素的主次和最优结果。本文首先利用单因素试验法找出适合重组大肠杆菌生产KR的发酵培养基成分,然后用均匀设计方法对培养基各组分添加量进行优化试验, 以提高KR的酶活并降低生产成本, 为大规模生产及应用提供参考。
1 材料和方法
1.1 材料与试剂
1.1.1 菌种 重组大肠杆菌含有KR外源基因的质粒,由安琪酵母股份有限公司菌种室提供。质粒以氨苄抗性基因作为标记基因,以阿拉伯糖为启动子。
1.1.2 试剂 L-阿拉伯糖、NADPH、COBE和CHBE等购自美国Sigma公司;酵母蛋白胨(FP101)和酵母浸粉(FM888)为安琪酵母股份有限公司产品。
1.1.3 培养基 LB培养基(g·L-1):蛋白胨,NaCl,酵母抽提物5,琼脂粉15。TB培养基(种子以及发酵初始培养基,g·L-1):甘油4,酵母抽提物24,酵母蛋白胨12,KH2PO4 2.31, K2HPO4 12.54,pH 值7.0。
1.1.4 诱导剂溶液 L-阿拉伯糖溶液浓度为0.05 g·mL-1。
1.1.5 氨苄青霉素贮存液 氨苄青霉素购于北京鼎国昌盛生物技术有限公司, 用无菌超纯水配成 100 mg·mL-1, 分装在EP管中, -20 ℃冻存, 使用时每 1 mL 培养基加入 l μL, 终质量浓度为 100 μg·mL-1。
1.2 仪器与设备
紫外可见光分光光度计:SP-754型,上海天普分析仪器有限公司;超声波破碎仪: 04711-45型,宁波新芝生物科技股份有限公司。
1.3 方 法
1.3.1 培养方法 种子培养方法:方法参见参考文献[9]。
发酵培养及诱导产酶:将种子液按1%接种量接入装有25 mL发酵培养基的250 mL三角瓶后,在30 ℃,180 r·min-1条件下培养2 h后加入 0.5 mL 灭过菌的L-阿拉伯糖溶液, 继续培养22 h,获取菌体。
1.3.2 粗酶液获取方法 将发酵液离心取菌体2 g,向菌体中加入pH值为9.0的 Tri-HCl缓冲溶液20 mL,搅拌均匀后,在4 ℃下超声波破碎,离心后取上清液即为粗酶液。
1.3.3 检测方法 菌体量测定 :发酵结束后,将稀释适当倍数的发酵液放置分光光度计中,在波长为600 nm下测量吸光值。
KR酶活检测:以COBE为底物, NADPH为辅酶,利用紫外可见光分光光度计在340 nm下,通过连续测定NADPH消耗量来计算酶活力,具体方法见参考文献[10]。定义酶活:在40 ℃,pH值为6.0条件下,每分钟消耗1 μmol NADPH所需要的酶量为1个国际单位(U)。
1.3.4 均匀设计及数据分析 本试验采用均匀设计优化其发酵培养基,试验数据采用 DPS 软件进行逐步回归分析[11],筛选显著变量,建立回归方程,并通过回归方程求取极值,得到最优培养基组成。
2 结果与分析
2.1 不同碳源对重组大肠杆菌的生长以及产KR的影响
碳源为微生物生长提供能量,不同微生物利用碳源物质的范围各不相同,因此为重组菌选择适合的碳源至关重要。本试验以TB培养基为基础培养基,将其碳源改为葡萄糖、甘油、蔗糖、麦芽糖、淀粉,每种碳源以不同的质量浓度(0.5%,1%,1.5%,2%,2.5%,3%)进行添加,其他成分不变, 按照1.3.1方法培养,在诱导发酵22 h后测定酶活和生物量,生物量以菌液OD600表示,结果如图1。
由图1可知,不同的碳源对重组大肠杆菌的生长以及产酶的影响很大。相较于其他三者,重组大肠杆菌对葡萄糖和甘油的利用率较好,当二者添加浓度分别为1%和1.5%时OD600达到最大值,分别为 22和 21。就产KR酶的情况而言,添加1%甘油时,酶活最大为70.25 U·mL-1。葡萄糖虽然能更好地促进菌体生长,但酶活产量不高。可能因为葡萄糖进入细胞中后通过糖酵解途径,会产生丙酮酸,再经其他代谢途径,会产生乳酸、乙酸等代谢副产物,而这些副产物会抑制KR的合成。选择合适的碳源添加量非常重要,添加过高或过低对菌体生长和产酶都有一定的抑制作用。因此,基于生长与产酶两方面考虑,选择甘油为最佳碳源,且最佳添加浓度为1%。
2.2 不同氮源对重组大肠杆菌的生长以及产KR的影响
氮是微生物细胞中需要量仅次于碳的元素,分为有机态和无机态氮,不同菌种对不同来源的氮素利用程度不同[11]。前期试验证实,当以无机氮为唯一氮源时,菌体生长和产酶受到了极大的抑制(发酵结束后,OD600低于2,酶活几乎没有),因此本试验以考察不同有机氮源对重组大肠杆菌的生长以及产酶的影响。试验设计:以甘油为碳源,添加浓度为1%,其他成分不变,将 TB 中的氮源(蛋白胨和酵母膏)替换为胰蛋白胨(Tryptone),牛骨蛋白胨(Beef peptone),酵母蛋白胨FP101,酵母浸出物FM888以及FM818,每种氮源以不同的质量浓度(2%,4%,6%,8%)进行添加,按照1.3.1方法培养,在诱导发酵22 h后测定酶活和生物量,结果如图2。
潘冬瑞等[12]通过对FM888和FP101对大肠杆菌发酵的研究发现FM888中游离氨基酸含量高,可以迅速被大肠杆菌利用,能够使菌体快速积累到最大值,而由于肽类含量较低,对于稳定期产酶的持续增效作用不够,研究还发现当FM888与FP101以7∶3比例混合使用时,可将游离氨基酸和肽类含量调整到合适水平,既能满足菌体快速生长的营养需求,又可促进卤醇脱卤酶的持续高效表达,增强发酵后劲。相较于FM888,FP101游离氨基酸含量稍低,肽类含量却相对较高。从图2也可以看出,相较于其他氮源FM888更有利于菌体生长,且当添加量为6%时高达26。而当以4%的FP101为氮源时,KR的酶活最高,为79.53 U·mL-1,说明KR的表达所需的氮源与潘冬瑞等[12]研究重组大肠杆菌产卤醇脱卤酶相似。因此结合文献以及试验结果选择FM888和FP101为复合碳源,混合比为7∶3,总添加量为4%。
2.3 不同金属离子对重组大肠杆菌的生长以及产KR的影响
金属离子不仅可以调节和维持微生物生长过程中诸如渗透压、氢离子浓度和氧化还原电位等生长条件,如 Na+和 Ka+有调节细胞渗透压的作用[13];还可以参与并稳定微生物细胞的结构,如Mg2+有稳定核糖体和细胞膜的作用;某些金属离子甚至与酶的组成有关,如Mg2+、Zn2+和Cu2+是许多酶的激活剂[9]。本试验考察Na+、Mg2+、Ca2+、Zn2+和Cu2+ 等5种金属离子对重组大肠杆菌的生长以及产酶的影响。发酵培养基中分别添加Nacl, MgSO4· 7H2O, CaCl2, ZnSO4· 7H2O, CuSO4· 5H2O,每种物质以不同的浓度(0, 0.25, 0.5, 1.0, 2.0 g·L-1)进行添加,在甘油为1%,FM888与FP101分别为2.8%,1.2%,TB中其他成分不变条件下发酵,收获菌体后所测得的结果如图3所示。
图3显示,相较于空白组,5种金属离子的添加对菌体的生长影响相对较小,但对KR的表达的影响较大,除Ca2+外,其他4种金属离子在添加量合适的情况下均对酶活有一定的促进作用。尤其是Mg2+,当添加量为0.5 g·mL-1时,酶活达到80.73 U·mL-1。因此,发酵生产KR时,可以在培养基中添加0.5 g·L-1的MgSO4· 7H2O。
2.4 磷酸根离子对重组大肠杆菌的生长以及产KR的影响
在微生物菌体的能量代谢中,磷元素起重要作用。一方面,磷元素是构成三磷酸腺苷、核酸和脂类的重要组分,它的存在有利于能量的代谢;另一方面,培养基中的磷元素常以 PO43-的形式存在,能起缓冲 pH 值的作用。本试验参考TB培养基,以K2HPO4和KH2PO4为培养基中PO43-来源,配置pH值 为7,离子浓度分别为0.01,0.05, 0.1,0.15,0.2 mol·L-1以及离子浓度为0.1 mol·L-1,pH值 分别为 6.0,6.5, 7.0, 7.5 ,8.0 的缓冲溶液,用磷酸缓冲溶液作为培养基中其他成分(甘油10,FM888 28,FP101 12,MgSO4· 7H2O 0.5)的溶剂配置相应的培养基,考察磷酸根离子的浓度以及培养环境的初始pH值对重组大肠杆菌的生长以及产KR的影响,其试验结果如图4所示。
由图4可知,pH值为7时,磷酸盐离子浓度对重组大肠杆菌的生长以及产酶的影响较小,根据测量结果可知,离子浓度在0.05~0.2 mol·L-1时KR酶活较高。反之,培养基的初始pH值对菌体繁殖以及产酶影响较大,结果显示pH 值7 为最佳初始pH值。
2.5 均匀设计优化
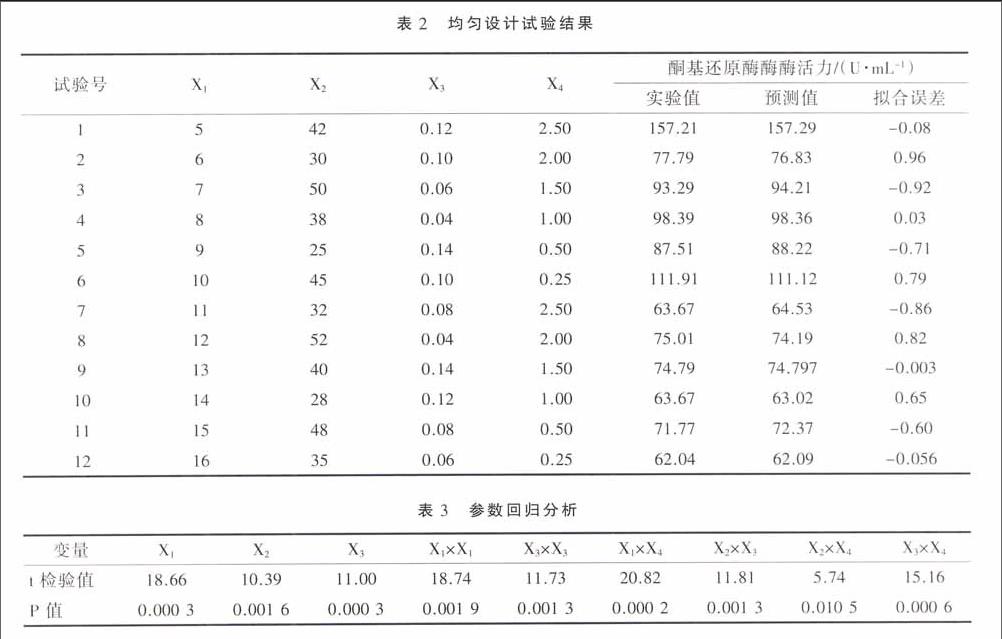
单因素试验已初步选出培养基的主要成分以及最优添加量。试验结果显示:选取甘油 10 g·L-1,酵母浸出物(FM888)以及酵母蛋白胨(FP101)7∶3混合物 40 g·L-1,七水硫酸镁 0.5 g·L-1用pH值为7,离子浓度为0.05 mol·L-1的磷酸盐配置基础培养基有利于菌体的生长以及酶活的提高。基于单因素试验,以KR酶活为响应值,利用均匀设计进一步优化培养基各成分的最优添加量。试验因素以及试验水平设计如表1。
用 DPS 软件均匀设计模块对表2的数据进行多元二次逐步回归分析,得出酶活与各因素关系的方程为:
Y=-1 891.20+302.22X1 +15.62X2 +4 139.311X3-12.44X1×X1-8 728.25X3×X3-35.17X1×X4-181.66X2×X3+0.99X2×X4+3 575.811X3×X4
此方程回归结果如表 3 所示。
模型的复相关系数 r= 0.999 7,修正的决定系数0.999 3,F= 350.17,P= 0.002 9,剩余标准差 S= 1.596,模型的各个变量在α=0.05的水平上均显著,说明模型选择比较恰当。优化后重组大肠杆菌产酮基还原酶培养基配方为:甘油 6.86 g·L-1、FM888 19.53 g·L-1、FP101 8.37 g·L-1、 MgSO4· 7H2O 2.50 g·L-1、 K2HPO4 14.96 g·L-1和 KH2PO4 7.34 g·L-1。酶活拟合结果为448.01 U·mL-1,实测结果为431.21 U·mL-1,与优化前酶活(70.25 U·mL-1)比较提高了5.13倍,说明该培养基配方较佳。
3 结 论
培养基是微生物的生活环境,其组成对微生物的生长和产物的形成有很大的影响,因此在建立一个发酵过程的时候,往往需要对所用的培养基进行优化。本试验首先利用单因素试验筛选了培养基组分并初步优化了各组分的添加浓度;其次,为了进一步考察各因素对酶活的相互影响,本试验选定 U12(122×62)混合水平的均匀设计表对各因素的添加浓度在更小范围进行优化;试验最终优化得到的酶活高达431.21 U·mL-1,是优化前(TB培养基)酶活(70.25 U·mL-1)的5.13倍,较大幅度提高了KR生产效率,为KR酶的后续研究奠定了基础,并对KR酶的工业生产具有一定的指导作用。
参考文献:
[1] 朴文花,李平作,朴桂花,等. 酮基还原酶在Pichia pastoris中表达策略[J]. 延边大学医学学报, 2000, 23(4): 239-242.
[2] Claodio F, Piero G. On the steric course of baker's yeast mediated reduction of alkyl 4-azido-and 4-bromo-3-oxobutyrate Synthesis of (R)-and (S)-carnitine [J]. Tetrohedron Letters, 1985, 26(1): 101.
[3] 朴文花. 掷袍酵母酮基还原酶(KR)在Pihcaipastorsi和E.coli中的表达[D]. 延边:延边大学,2001.
[4] Hideali Y, Sakayu S, Michihiko K,et al.A novel NADPH-dependent aldehyde reductase, catalyzing asymmetric reduction of fl-keto acid esters, from Sporobolomyces salmonicolor: purification and characterization[J]. Fems Microbiology, 1990, 70(1): 45-48.
[5] Colleen A C, Robert A P, Micheal A M, et al.Purification, characterization, cDNA cloning and expression of a novel ketoreductase from Zygosaccharomyces rouxii[J]. Eur J Biochem, 2000,267(17): 5 493-5 501.
[6] Kathrin H, Jan H, Martin H, et al.Identification, Cloning, and Characterization of a novel ketoreductase from the Cyanobacterium Synechococcus sp. strain PCC 7942[J]. Appl Environ Microbiol, 2008, 74(21): 6 697-6 702.
[7] 方开泰, 王元. 均匀设计与均匀设计表[M]. 北京: 科学出版社,1994.
[8] 左斌 ,胡超 ,谢达平. 均匀设计对大肠杆菌产谷氨酸脱羧酶培养基优化的应用[J].湖南农业大学学报:自然科学版,2008,34(5):531-533.
[9] 潘冬瑞,李啸,张瑶,等. Zn2+对基因工程大肠杆菌P84A/MC1061发酵生产卤醇脱卤酶的影响[J]. 天津农业科学, 2013,19(8): 5-9.
[10] 石小丹,李啸,罗宇笛,等. 发酵液中酮基还原酶活性测定方法的构建[J].中国酿造,2014,33(9):151-155.
[11] 唐启义, 冯明光. 实用统计分析及其 DPS 数据处理系统[M]. 北京:科学出版社, 2002.
[12] 潘冬瑞,李啸,张瑶,等. 重组大肠杆菌E.coli P84A/MC 1061发酵生产卤醇脱卤酶的研究 [J] . 天津农业科学, 2013,19(7):6-9.
[13] Joseph, S, David, WR. Expression of cloned genes in E.coli using IPTG-inducible promoters[M]// Joseph S, David W R. Molecular cloning: a laboratory manual. New York: Cold Spring Harbor Laboratory, Cold Spring Harbor, 2002:14-19.
