筛选小鼠Cltb 启动子顺式元件结合蛋白的酵母单杂交文库的构建
2015-06-12吕学军陆卫忠张永娟李少莹李玉英钱桂生
吕学军 陆卫忠 张永娟 郭 亮 李少莹 李玉英 钱桂生
·论著·
筛选小鼠Cltb 启动子顺式元件结合蛋白的酵母单杂交文库的构建
吕学军1陆卫忠1张永娟2郭 亮1李少莹1李玉英1钱桂生1
目的利用酵母单杂交系统筛选与Cltb基因启动子结合的顺式元件,获得调控Cltb基因表达的转录因子,阐明Cltb基因的转录调控机理。方法首先,构建表达Cltb调控序列的诱饵质粒pBait-AbAi,并将诱饵质粒转入Y1HGold菌株,构建可稳定表达“诱饵-报告子”的酵母菌株;然后,运用SMARTTM技术构建小鼠肺组织酵母单杂交cDNA AD融合表达文库,并进行cDNA文库的筛选。结果成功构建了筛选Cltb启动子顺式元件结合蛋白的酵母单杂交文库,该文库的转化效率为:9.35×105CFU/μg。通过对文库的筛选最后获得了5个阳性克隆并测序,得到5个可编码结合蛋白的基因,分别是Srrt、hnRNPs A/B、Irf1、NKx2.5和Zfp953。结论所构建的酵母单杂交文库符合实验要求,筛选的5个转录因子为研究Cltb基因表达调控奠定了基础。
Cltb基因; 酵母单杂交文库; 转录调控
急性肺损伤(acute lung injury, ALI)与急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)是当前危重疾病领域最为重视的研究热点之一。长期以来,国内外学者对该病进行了大量研究,但迄今为止ALI/ARDS的发病机制仍不清楚[1]。肺泡上皮细胞为典型的极性细胞,细胞极性的变化与分泌功能、液体清除功能、膜通道等细胞功能密切相关。研究证实,ALI/ARDS时,肺泡上皮细胞存在极性损伤,而这种极性损伤在ALI/ARDS早期扮演重要角色。
新近研究发现Clathrin蛋白是维持上皮细胞基底的胞外侧质膜极性所必须的重要蛋白。Clathrin基因的沉默会干扰基底外侧蛋白的运输和再循环从而使其失去极性,但是对顶端蛋白的极性没有影响[2]。Clathrin蛋白对于上皮细胞的极性维持和调节起到关键作用,但其上游的调控机制仍不明确。分离Clathrin蛋白上游相关调控基因,对于阐明细胞极性调控机制具有重要价值[3]。
本研究应用酵母单杂交技术从小鼠肺cDNA文库中筛选与Cltb基因启动子顺式元件结合的转录因子,旨在进一步阐明Clathrin蛋白的转录调控机制。
材料与方法
一、诱饵序列的设计
构建表达Cltb调控序列的诱饵质粒pBait-AbAi,同时构建表达Cltb突变调控序列的pMutant-AbAi作为确定阳性克隆特异性的阴性对照质粒。根据小鼠Cltb 基因编码区上游的基因组调控序列,通过在线预测软件预测转录起始位点(启动子序列),进一步预测TFBS(转录因子结合位点),最终选择以下序列作为诱饵序列,全长430bp,同时设计了突变诱饵序列,红色下划线区域为突变序列:
诱饵序列
GGAAAACCAAAAAACTGAGTGAACAGAGTTGA
CTGGAGAGGGAGCAGAGGTCCTAAACCAATTCAAT
TCTGAAAAACCACATGAAGGCTCACAGCCATTTGCA
CAGCTACAGTGTCCTCACATAAATATATAAATAAAT
AAAAAAATTTCAAGTGGGGGAGGGGAACTGTTAGG
GAGGGGATACCTGGGAGGCGTGAGATATGTGAGGG
GGGAGCATATGCTCAAAATGCATTACTTGTTTGTAT
AAAATGACAAAGAGGGCTGTAGAGATGGCTCAGTG
GTTAAGAGCACTGACTGCTCTTCCAGAGGTTCTGAG
TTCAATTCCCAGCAACCACATGGTGGCTCACAACCA
TCTGTGATGTGATCTTGGTGCCTTCTTCTGTCCTACA
GGCATATATGCAGGCAGAACACTGTATACATAATAT
ATATA
突变诱饵序列
GGAAAACCAAAAAACTGAGTGAACAGAGTTGA
CTGGAGAGGGAGCAGAGGTCCTAAACCAATTCAATT
CTGAAAATGGTCTTGAAGGCTCACAGCCATTTGCAC
AGCTACAGTGTCCTCACTATTTCATTATTTCAAATAA
AAAAATTAGTACACGGGGAGGGGAACTGTTAGGGA
GGGGATACCTGGGAGGCGTGAGATATGTGAGGGGG
GAGCATATGCTCAAAATGCATTACTTGTTTGTATAA
AATGACAAAGAGGGCTGTAGAGATGGCTCAGTGGT
TAAGAGCACTGACTGCTCTTCCAGAGGTTCTGAGTT
CAATTCCCAGCATGGTCTTGGTGGCTCACAACCATC
TGTGATGTGATCTTGGTGCCTTCTTCTGTCCTACAGG
CATATATGCAGGCAGAACACTGTATACATAATATAT
ATA
分别全基因合成诱饵序列和突变诱饵序列,序列克隆至PES载体,5′端和3′端分别加上Hind Ⅲ和XhoⅠ酶切位点。
二、重组诱饵质粒的构建
PES/Bait, PES/mu-Bait, pAbAi载体用Hind Ⅲ和XhoⅠ内切酶进行双酶切,酶切产物上样至1% Agarose gel,电泳至适当位置后,紫外灯下切胶回收。PES/Bait,PES/mu-Bait质粒酶切产物回收430bp左右的诱饵片段,pAbAi载体回收5000 bp左右的载体线性化片段。对回收后的Bait,mu-Bait片段及pAbAi载体定量后,进行DNA连接反应。连接产物转化XL1-Blue感受态菌,转化后菌铺至LB-Ampr+平板,37 ℃温箱孵育过夜。挑取平板上长出的单克隆至LB-Ampr+液体培养基,37 ℃,200 rpm,振荡培养15 h,提取细菌培养物中的质粒并双酶切鉴定。
三、构建可稳定表达“诱饵-报告子”的酵母菌株
1. 线性化诱饵质粒并转化酵母细胞: 对pAbAi/Bait,pAbAi/mu-Bait及p53-AbAi重组质粒进行BbsI酶切,将酶切的重组质粒转化进入Y1HGold菌株,通过同源重组整合进入酵母基因组,在SD/-Ura平板上筛选酵母转化子。以酶切的诱饵突变质粒pAbAi/mu-Bait作为阴性对照,酶切的质粒p53-AbAi 作为阳性对照。
2. 酵母诱饵报告子的PCR 鉴定: 分别挑取Y1HGold[pAbAi/Bait]、Y1HGold[pAbAi/mu-Bait]和Y1HGold[p53-AbAi]酵母菌落于30 ℃培养过夜。PCR 鉴定反应体系如下:25 μl重组菌液、Matchmaker Insert Check PCR Mix 25 μl。PCR反应条件: 95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,68 ℃ 2 min,30 cycles。预期的PCR 结果为:阳性组(p53-AbAi)PCR 产物大小应为1.4 kb;阴性组(单纯Y1HGold菌株)无条带;诱饵及突变诱饵组(pAbAi/Bait,pAbAi/mu-Bait):1.35 kb + 插入的诱饵片段大小(约1.8 kb)。
3. 酵母诱饵报告子的AbAr 最小抑制浓度测定: 分别挑选Y1HGold[pAbAi/Bait]、Y1HGold[pAbAi/mu-Bait]和Y1HGold[p53-AbAi] 中大而健康的酵母菌落,每个菌落斑用0.9% 的NaCl 重悬(2000 个细胞/100 μl)。将100 μl 菌液分别涂布到以下培养基上:SD/-Ura、SD/-Ura /AbA(100 ng/ml)、SD/-Ura/AbA(200 ng/ml)和SD/-Ura/AbA(300 ng/ml),然后于30 ℃培养2~3 d,观察菌落的生长情况。
四、运用SMARTTM技术构建小鼠肺组织酵母单杂交cDNA AD融合表达文库
1.cDNA 第一链的合成: 将新鲜小鼠肺组织块放置于液氮中,将组织磨成粉末后,加入Trizol提取总RNA,按照Trizol Reagent操作说明进行。然后,用FastTrack®MAG mRNA isolation Kit从总RNA中分离mRNA。取纯化并定量的mRNA 1 μl(~1.0 μg poly A+),加入1μL CDSⅢ(oligo-dT)primer 和2 μl去离子水,72 ℃温育 2 min 后置冰上,加入下列混合液:5×First-Strand Buffer 2 μl、DTT(100 mM)1 μl、dNTP mix(10mM)1 μl和SMART MMLV RT 1 μl,混匀后,42 ℃温育10 min。加入1 μl BD SMART Ⅲ Oligo,混匀,42 ℃温育1 h,75 ℃放置10 min终止反应后降至室温,加入1 μl RNase H(2 units),37 ℃温育20 min;-20 ℃保存备用。
2.运用长距离PCR(LD-PCR)扩增SMART cDNA: 建立以下反应体系:SMART cDNA 第一链2 μl、去离子水70 μl、10×Advantage 2 PCR Buffer 10 μl、50×dNTP Mix 2 μl、5′PCR Primer 2 μl、3′PCR Primer 2 μl、Melting Solutiont 10 μl、50×Advantage 2 Polymerase Mix 2 μl。混合均匀后,运行以下循环:95 ℃ 30 s;95 ℃ 10 s,68 ℃ 6 min (每运行一个循环扩增时间增加5 sec),28 cycles;68 ℃ 5 min。
3.使用纯化柱纯化双链cDNA: 利用BD CHROMA SPINTM-400 Columns纯化双链cDNA,以去除小片段。加入l/10 体积的3M NaAc 和2.5 体积的95%乙醇,-20 ℃沉淀1 h。700×g离心5 min,去上清,75%乙醇洗涤两次后,干燥,无菌水溶解(100~150 ng/μl),-20 ℃贮存备用。
五、 酵母单杂交cDNA文库筛选
分别制备酵母感受态细胞Y1HGold[p53-AbAi]和Y1HGold[pAbAi/Bait]。对于诱饵酵母菌株的转化设定如下反应体系:5 μg SMART 扩增的双链cDNA文库、3 μg SmaI线性化的pGADT7-Rec质粒、PGE/LiAc 2.5 ml、感受态细胞Y1HGold[pAbAi/Bait] 600 μl。对于p53阳性对照酵母菌株的转化设定如下反应体系:100 ng p53片段、1 μg SmaI线性化的pGADT7-Rec质粒、PGE/LiAc 200 μl、感受态细胞Y1HGold[p53-AbAi] 50 μl。30 ℃温浴4 min,混匀15 min/次。加入160 ml DMSO,42 ℃ 热激30 min,混匀后700×g 离心5 min,去上清,用3 ml的YPDA液体培养基重悬。30 ℃ 250 rpm摇床培养90 min。700×g离心5 min,用15 ml 0.9% NaCl重悬。按 1/10、1/100 和 1/1000的比例对转化产物分别进行稀释,从3个稀释液中各取 100 μl分别涂布在 SD/-Leu、SD/-Leu/AbA(300 ng/ml)(文库筛选) 和SD/-Leu/AbA(200 ng/ml)(p53阳性对照)平板上培养,用于计算转化效率。将剩余的文库转化产物均匀铺至150 mm SD/-Leu/AbA(300 ng/ml)平板进行筛选,每个平板铺150 μl,30 ℃孵育3~5 d。计算筛选克隆总数。
六、阳性克隆的确认及文库质粒的分离纯化
1.将阳性克隆在新鲜选择培养平板上重新划线以确认阳性表型: 将在筛选平板上长出的阳性克隆重新划线接种至SD/-Leu/AbA(300 ng/ml)平板上,2~4 d后长出单个菌落。将单个阳性克隆菌用PBS混悬后,再次接种至SD/-Leu/AbA(300 ng/ml)上,观察菌落的生长情况,仍然生长的克隆进入下一步实验。
2. PCR分析以排除重复克隆: 挑取直径较大阳性单克隆,采用clontech 公司的Matchmaker Insert Check PCR Mix 2 试剂盒初步鉴定阳性克隆。PCR 鉴定,反应体系如下:25 μl酵母菌液、Matchmaker Insert Check PCR Mix 2 25 μl。PCR反应条件: 95 ℃ 3 min;95 ℃ 30 s, 55 ℃ 30 s,68 ℃ 2 min,30 cycles。
3. 分离和纯化阳性文库质粒: 扩增含有阳性克隆的酵母细胞后通过化学及物理裂解的方法提取其中的文库质粒DNA。通过转化上述质粒DNA至大肠杆菌后,分离纯化文库质粒DNA。将100 ng阳性文库质粒分别转化进入Y1HGold[pAbAi/Bait]、Y1HGold[pAbAi/mu-Bait]菌株。将转化产物按照1︰100稀释后,分别接种至以下平板:SD/-Leu、SD/-Leu/AbA(300 ng/ml)。30 ℃孵育3~5 d,观察克隆生长情况。
结 果
一、重组诱饵质粒的酶切鉴定
诱饵序列、突变诱饵序列和pAbAi载体进行DNA连接反应产物后转化XL1-Blue感受态菌,提取质粒并双酶切鉴定,见图1。
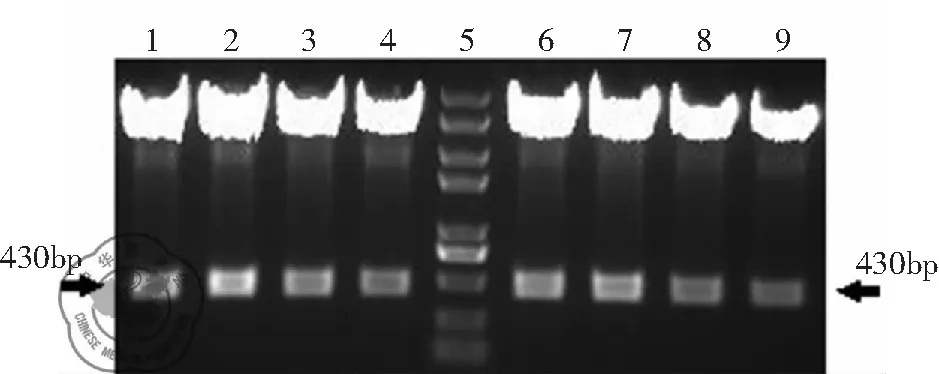
注:Lane 1-4为Bait克隆4酶切产物; Lane 5:DNA marker;Lane 6-9:mu-Bait克隆2酶切产物
结果显示,AbAi/Bait和pAbAi/mu-Bait的1,2,3,4号克隆均为阳性克隆,各选取1号克隆送测序,测序结果显示序列无误。采用该克隆进行后续的“诱饵-报告子”酵母菌株构建实验。
二、酵母诱饵报告子的PCR鉴定
对pAbAi/Bait,pAbAi/mu-Bait及p53-AbAi重组质粒进行BbsI酶切,酶切的重组质粒转化进入Y1HGold菌株,在SD/-Ura平板上筛选酵母转化子并行PCR 鉴定,结果表明插入的诱饵序列、突变诱饵序列及插入方向完全正确,如图2。

注:Lane 1:DNA marker;Lane 2:报告子Y1HGold[p53-AbAi]的菌液PCR 产物1.4 kb;Lane 3:报告子Y1HGold[pAbAi/Bait]的菌液PCR 产物(1.8 kb);Lane 4:报告子Y1HGold[pAbAi/mu-Bait]的菌液PCR 产物(1.8 kb);Lane 5:单纯Y1HGold菌液PCR 产物
三、酵母诱饵报告子的AbAr 最小抑制浓度测定
将酵母诱饵报告子菌液分别涂布到以下培养基上:SD/-Ura、SD/-Ura /AbA(100 ng/ml)、SD/-Ura/AbA(200 ng/ml)和SD/-Ura/AbA(300 ng/ml),然后于30 ℃培养2~3天,观察菌落的生长情况。最低抗性测定结果如图3所示。根据实验结果,确定酵母诱饵报告子的AbA 最小抑制浓度:以SD/-Ura AbA200 作为Y1HGold[p53-AbAi]阳性反应的筛选条件;SD/-Ura AbA300 作为Y1HGold[pAbAi/Bait]的筛选条件。

图3 酵母诱饵报告子的AbAr 最小抑制浓度测定
四、小鼠肺组织酵母单杂交cDNA文库构建
提取小鼠肺组织总RNA并纯化分离mRNA,反转录合成ss cDNA,再用LD-PCR扩增合成ds cDNA,并对扩增产物进行纯化和琼脂糖凝胶电泳分析,结果表明:经纯化后的SMART cDNA 片段大小主要分布于500~3000 bp 之间,呈现明亮的弥散状条带,符合文库构建要求,如图4。

图4 过柱纯化的双链cDNA
五、酵母单杂交cDNA文库筛选
诱饵酵母菌和p53阳性对照酵母菌转化后按 1/10、1/100 和 1/1000 的比例对转化产物分别进行稀释,从3个稀释液中各取 100 μl分别涂布在 SD/-Leu、SD/-Leu/AbA(300 ng/ml)(文库筛选) 和SD/-Leu/AbA(200 ng/ml)(p53阳性对照)平板上培养,结果如图5,转化效率为:187×50×100=9.35×105。将剩余的文库转化产物均匀铺至150 mm SD/-Leu/AbA(300 ng/ml)平板进行筛选,每个平板铺150 μl,30 ℃孵育3~5 d 。计算筛选克隆总数:187 cfu/0.1 ml×100×15 ml=2.8 million。将阳性克隆在新鲜选择培养平板上重新划线以确认阳性表型。并经PCR分析以排除重复克隆。扩增含有阳性克隆的酵母细胞后提取文库质粒DNA。将阳性文库质粒分别转化进入Y1HGold[pAbAi/Bait]、Y1HGold[pAbAi/mu-Bait]菌株。将转化产物按照1︰100稀释后,分别接种至以下平板:SD/-Leu、SD/-Leu/AbA(300 ng/ml)。30 ℃孵育3~5 d,克隆生长情况如图6:每种克隆、每株菌株在每种平板上各接种2个复点。C1、C3、C4、C6、C8转化的Y1HGold[pAbAi/Bait]菌株在SD/-Leu/AbA(300 ng/ml)平板上可以生长,而Y1HGold[pAbAi/mu-Bait]菌株无法生长,证明为真正的阳性克隆;C2、C5、C7转化的Y1HGold[pAbAi/Bait]菌株在SD/-Leu/AbA(300 ng/ml)平板上可以生长,Y1HGold[pAbAi/mu-Bait]菌株也可以生长,证明为假阳性克隆。

图5 酵母单杂交cDNA文库筛选阳性克隆
六、真性阳性克隆进行测序分析结果
C1:Mus musculus serrate RNA effector molecule homolog (Arabidopsis)(Srrt), transcript variant 1, mRNA.
C3:Mus musculus heterogeneous nuclear ribonucleoprotein A/B (Hnrnpab), transcript variant 2, mRNA.C4:Mus musculus interferon regulatory factor 1 (Irf1), transcript variant 1, mRNA.
C6:Mus musculus NK2 homeobox 5 (Nkx2.5), mRNA.
C8:Mus musculus zinc finger protein 953 (Zfp953), mRNA.
讨 论
酵母单杂交方法(yeast one hybrid method) 是根据DNA 结合蛋白( 即转录因子) 与DNA 顺式作用元件结合调控报道基因表达的原理来克隆编码目的转录因子的基因(cDNA)[4]。该方法也是在细胞内(in vivo)分析鉴定转录因子与顺式作用元件结合的有效方法。在该系统中,目标DNA和蛋白的作用发生在真核细胞内的生理环境,有利于保持蛋白的天然构象,而且通过报告基因的表达水平变化来检测杂交的发生,因而较其它的体外方法具有更高的准确性[5]。
本研究利用Clontech公司酵母单杂交文库构建系统构建了筛选Cltb启动子顺式元件结合蛋白的酵母单杂交文库。该文库的转化效率为:187×50×100=9.35×105。对文库的筛选最终获得了5个含有完整ORF框的阳性克隆。其中,Srrt 和Zfp953同属于锌指蛋白家族,锌指蛋白在真核生物中表达广泛,具有广泛的生物功能,如DNA识别,RNA包装,转录及转录后调控,蛋白折叠和装配,脂质结合,并参与肿瘤的形成和机体免疫干预等功能[6-9]。
hnRNPs A/B属于hnRNPs(heterogeneous nuclear ribonucleoproteins)核内不均一核糖核蛋白家族,是一组核内RNA结合蛋白,具有多种亚体,发挥一系列重要的细胞功能,如mRNA的剪接,mRNA稳定性的调控,核胞质的转运,RNA代谢转录,转录后调控,DNA复制与重组[10-12]。Irf1不仅可激活Ⅰ类干扰素基因的表达,还有抗肿瘤效应及介导细胞凋亡的作用[13-16]。NKx2.5是NK型同源盒基因家族Nkx2型的成员,是重要的转录因子,与心脏发育、功能维系密切相关。Nkx2.5的突变可以导致心肌肥厚、心律失常、先心病等疾病[17-19]。
由此可见,所构建的酵母单杂交文库符合要求,满足实验需要。当然,酵母单杂交作为一种研究蛋白质与DNA相互作用的初步实验技术手段,其实验结果还需要进一步加以证实。同时对以上5个基因在ALI/ARDS极性损伤中作用也正在研究中,以期获得调控Cltb基因表达的转录因子,并有助于进一步阐明Cltb基因的转录调控机理。
1 金发光.急性肺损伤的诊治研究现状及进展[J/CD]. 中华肺部疾病杂志:电子版, 2013, 6(1):1-3.
2 Deborde S, Perret E, Gravotta D, et al. Clathrin is a key regulator of basolateral polarity[J]. Nature, 2008, 452 (7188): 719-723.
3 吕学军, 陆卫忠, 张永娟, 等. 酵母双杂交筛选Clathrin相互作用蛋白[J/CD]. 中华肺部疾病杂志:电子版,2014, 7(4):379-383.
4 Li JJ, Herskowitz I. Isolation of ORC6, a component of the yeast origin recognition complex by a one-hybrid system[J]. Science, 1993, 262(5141): 1870-1874.
5 Alle JB, Walberg MW, Edwards MC, et al. Finding prospective partners in the library: the two-hybrid system and phage display find a match[J]. Trends Biochem Sci, 1995, 20(12): 511-516.
6 Gruber JJ, Zatechka DS, Sabin LR, et al. Ars2 links the nuclear cap-binding complex to RNA interference and cell proliferation[J]. Cell, 2009, 138(2): 328-339.
7 Wilson MD, Wang D, Wagner R, et al. ARS2 is a conserved eukaryotic gene essential for early mammalian development[J]. Mol Cell Biol, 2008, 28(5): 1503-1514.
8 Andreu-Agullo C, Maurin T, Thompson CB, et al. Ars2 maintains neural stem-cell identity through direct transcriptional activation of Sox2 [J]. Nature. 2011, 481(7380): 195-198.
9 Krishna SS, Majumdar I, Grishin NV. Structural classification of zinc fingers: survey and summary[J]. Nucleic Acids Res, 2003, 31(2): 532-550.
10 Taga Y, Miyoshi M, Okajima T, et al. Identification of heterogeneous nuclear ribonucleoprotein A/B as a cytoplasmic mRNA-binding protein in early involution of the mouse mammary gland[J]. Cell Biochem Funct. 2010, 28(4):321-328.
11 Sinnamon JR, Waddell CB, Nik S, et al. Hnrpab regulates neural development and neuron cell survival after glutamate stimulation [J]. RNA, 2012, 18(4):704-719.
12 Fukuda N, Fukuda T, Sinnamon J, et al. The transacting factor CBF-A/Hnrnpab binds to the A2RE/RTS element of protamine 2 mRNA and contributes to its translational regulation during mouse spermatogenesis[J]. PLoS Genet, 2013, 9(10): e1003858.
13 Maloney NS, Thackray LB, Goel G, et al. Essential cell-autonomous role for interferon (IFN) regulatory factor 1 in IFN-γ-mediated inhibition of norovirus replication in macrophages[J]. J Virol, 2012, 86(23): 12655-12664.
14 Jiang DS, Li L, Huang L, et al. Interferon regulatory factor 1 is required for cardiac remodeling in response to pressure overload [J]. Hypertension, 2014, 64(1): 77-86.
15 Yoon GS, Dong C, Gao N, et al. Interferon regulatory factor-1 in flagellin-induced reprogramming: potential protective role of CXCL10 in cornea innate defense against Pseudomonas aeruginosa infection[J]. Invest Ophthalmol Vis Sci, 2013, 54(12): 7510-7521.
16 Zhang L, Cardinal JS, Pan P, et al. Splenocyte apoptosis and autophagy is mediated by interferon regulatory factor 1 during murine endotoxemia [J]. Shock, 2012, 37(5): 511-517.
17 Nakashima Y, Yanez DA, Touma M, et al. Nkx2-5 suppresses the proliferation of atrial myocytes and conduction system [J]. Circ Res. 2014, 114(7):1103-1113.
18 Zheng W, Lu YB, Liang ST, et al. SIRT1 mediates the protective function of Nkx2.5 during stress in cardiomyocytes[J]. Basic Res Cardiol, 2013, 108(4): 364.
19 Zhang L, Nomura-Kitabayashi A, Sultana N, et al. Mesodermal Nkx2.5 is necessary and sufficient for early second heart field development[J]. Dev Biol. 2014, 390(1): 68-79.
(本文编辑:王亚南)
吕学军,陆卫忠,张永娟,等. 筛选小鼠Cltb 启动子顺式元件结合蛋白的酵母单杂交文库的构建[J/CD]. 中华肺部疾病杂志: 电子版, 2015, 8(1): 24-29.
Construction of yeast one-hybrid library for screening the binding protein of mouse Cltb promoter cis-element
LyuXuejun1,LuWeizhong1,ZhangYongjuan2,GuoLiang1,LiShaoying1,LiYuying1,QianGuiSheng1(1InstituteofRespirationDiseases,XinqiaoHospital,ThirdMilitaryMedicalUniversity,Chongqing400037,China;2DepartmentofPhysiology,GuangdongMedicalCollege,Dongguan523808,China)
LiYuying,Email:lzhlyyhy@163.com
Objective To screen the binding protein of mouse Cltb promoter cis-element using the yeast one hybrid system. Methods Step 1, the bait plasmid pBait-AbAi of Cltb regulatory sequence was constructed and transformed into Y1HGold yeast to build stable expression strain of "bait-Report". Step 2, the yeast one-hybrid cDNA AD fusion expression library of mouse lung was constructed with SMARTTMtechnology to screen transcription factors of mouse Cltb. Results The yeast one hybrid library of screening Cltb promoter cis element binding protein was successfully constructed. The results showed that the co-transformation efficiency was 9.35×105CFU /μg. 5 positive clones were screened and sequenced, we got five encoding genes of binding protein:Srrt; hnRNPs A/B; Irf1; NKx2.5 and Zfp953.Conclusion The yeast one-hybrid library meets the requirement of laboratory, The above work laid a foundation for the screening of transcription factors regulating Cltb gene expression.
Clathrin; Yeast One-hybrid; transcriptional regulation
10.3877/cma.j.issn.1674-6902.2015.01.006
国家自然科学基金资助(81070052)
400037 重庆,第三军医大学新桥医院全军呼吸病 研究所1523808 东莞,广东医学院生理学教研室2
李玉英,Email: lzhlyyhy@163.com
R563
A
2014-07-19)
