番鸭胚成纤维细胞的原代分离与培养研究
2015-06-11沈学怀张丹俊潘孝成赵瑞宏胡晓苗侯红艳周学利朱传民
沈学怀,张丹俊,潘孝成,戴 银,赵瑞宏,胡晓苗,侯红艳,周学利,朱传民
(安徽省农业科学院畜牧兽医研究所,安徽合肥230031)
番鸭又称瘤头鸭或麝香鸭,具有生长速度快、饲料报酬高、耐粗饲、肉质鲜嫩等特点,近年来在我国的南方地区的养殖量逐渐增加[1]。由于饲养量的增加,其疫病的发生也呈现逐年上升趋势,目前,关于番鸭疫病的研究仍落后于其他家禽[2]。细胞培养模拟细胞在体内的生长环境,使其在体外继续生长增殖从而用于试验研究,其在细胞学、病毒学、免疫学和基因功能组学等多领域中发挥重要作用[3]。由于一些番鸭疫病如番鸭细小病毒病等在自然环境下感染仅有番鸭发病[4],因此,与鸭胚成纤维细胞(DEF)相比,MDEF 更适合作为相关疫病的体外研究模型[5],但目前鲜有系统的MDEF 原代分离和培养的研究报道,鉴于此,本研究对MDEF的体外培养、传代和冻存技术进行较为系统的研究,旨在为建立适用于番鸭疫病相关研究的体外细胞培养体系奠定基础。
1 材料与方法
1.1 材料
1.1.1 试验用番鸭胚 番鸭胚购买于安徽安庆某种番鸭场,于本研究室孵化箱中孵化至11胚龄。
1.1.2 主要试剂 DMEM 高糖培养基、胎牛血清、D-Hanks平衡液均是Hyclone(美国)产品;二甲基亚砜(DMSO)为Sigma公司产品;2.5g/L 胰蛋白酶、青链霉素混合液均购自碧云天生物技术公司。
1.2 方法
1.2.1 不同消化方式对MDEF活率的影响 取11日龄番鸭胚,用碘酒和酒精消毒蛋壳,从气室端用镊子小心取出鸭胚,置于灭菌玻璃皿中;用剪刀小心去除头、四肢和内脏部分,剩余胚体用D-Hanks平衡液清洗3次,将洗净的胚体移入小烧杯中,用消毒剪刀反复剪碎,剪碎后的胚体分为两等份。
1.2.1.1 热消化法 取1份剪碎胚体加入5倍体积2.5g/L胰酶于三角烧瓶中,置于37℃培养箱中消化,消化过程中每间隔10 min轻混消化瓶,注意观察消化程度,以胚体碎块边缘呈现毛絮状,消化液开始浑浊为宜,取出消化瓶,用剪头吸管反复吹吸,待组织快基本消失后,加入等体积完全培养基(含100mL/L血清的DMEM)混匀,用四层灭菌纱布过滤,细胞滤液于1 000r/min离心3 min,弃去上清液,加入完全培养基,吹打分散细胞,取少许细胞台盼蓝染色,计数并计算细胞活率,调整细胞密度(2×106/mL)个/mL,分装于培养瓶或培养板中,于37℃体积分数为5%的CO2培养箱中培养。
1.2.1.2 冷消化法 取相同体积的胚体和胰酶,混匀后置于4℃冰箱消化过夜(12h~18h),其余操作与热消化法相同,台盼蓝染色,计数并计算细胞活率,调整细胞密度后接种于细胞板,置培养箱中培养。
1.2.2 不同血清浓度对MDEF生长的影响 细胞过夜培养(12h~18h)贴壁后,弃去培养液,预热的D-Hanks洗去除未贴壁细胞,分别更换含血清浓度为20、50、80、100mL/L 的DMEM 培养液,分别在12、24、48、72、96h,观察细胞生长情 况并记录,MTT 法检测细胞增殖活性。
1.2.3 不同血清浓度对MDEF冻存活性的影响细胞铺壁90%左右且生长状态良好时,可进行细胞冻存,冻存时细胞消化与传代操作步骤相同,将分散的细胞悬液吸入离心管中,1 000r/min离心3min,弃去上清,分别吸取血清终浓度分别为100、150、200、250、300 mL/L 的 细 胞 冻 存 液(均 含 有100 mL/L的DMSO),轻轻吹打悬浮细胞,调整细胞密度为1.0×107个/mL,分装入细胞冻存管中,每管分装1mL,置于专用的细胞冻存盒中,放入-80℃冰箱过夜,次日取出放入液氮中保存。细胞复苏时从液氮罐中取出冻存管,37℃水浴溶解,调整细胞密度后,接种于96 孔细胞培养板中培养,每组设置6个重复,培养18h后使用MTT 法检测细胞增殖活性。
1.2.4 离心对MDEF传代和复苏细胞活率的影响
1.2.4.1 离心对MDEF传代细胞活率的影响 待细胞长满瓶底部时进行传代,弃去瓶中培养液,DHanks液洗涤细胞表面2 次,加入适量预热的2.5 g/L胰酶进行消化,并置于显微镜下观察,待细胞间出现裂隙,细胞逐渐变圆,个别细胞开始漂起时,倾去消化液,加入适量培养液,用移液枪反复轻轻吹打,使细胞分散成单个细胞。将细胞悬液分为2等份,1份以1 000r/min离心3min,弃去上清液,适量加入完全培养液,台盼蓝检测细胞活率;另1 份不离心直接加入完全培养液后,检测细胞活率。调整细胞密度为5×105个/mL,分装于细胞瓶或细胞板中培养,观察细胞贴壁和生长情况。
1.2.4.1 离心对MDEF复苏细胞活率的影响 将冻存的细胞取出,37℃水浴溶解后分为2等份,1份缓缓加入3倍~4倍体完全培养基,以1 000r/min离心3min,弃去上清液,适量加入完全培养液,台盼蓝检测细胞活率;另1份缓缓加入9倍~10倍体积的生长液,混匀后取少量细胞,检测细胞活率,调整细胞密度,37℃培养箱中过夜培养,次日更换培养液,并观察细胞贴壁和生长情况。
1.2.5 细胞计数与活率测定 取细胞悬液与4mL/L台盼蓝工作液以9∶1 的比例轻轻混合混匀,采用血球计数板在3min内统计细胞密度和细胞活率,其中死细胞被染成蓝色,而活细胞不着色。
细胞密度(细胞数/mL)=(4大格的细胞数/4)×10 000×稀释倍数;
细胞存活率(%)=[(细胞总数-死细胞数)/细胞总数]×100%。
1.2.6 细胞活性测定 细胞接种于96孔细胞板,待生长到一定阶段,加入配置好的MTT 工作液(5mg/mL)20μL,孵育4h后,吸出细胞上清液,每孔加入200μL DMSO,取出培养板,振荡10min,待紫色结晶物完全溶解,酶标仪检测,490nm 处测各孔的吸光值(OD490)。
1.3 数据统计
所有试验均重复3次,试验数据采用Excel软件进行初步整理,SPSS17.0 软件进行组间差异性比较。部分统计数据结果以平均值±标准误表示。
2 结果
2.1 原代MDEF的生长与形态特征
采用2.5 g/L 胰 酶 消 化,获 得 较 为 纯 净 的MDEF,原代细胞于培养瓶中培养4h后即可贴壁,在100mL/L血清培养液中细胞生长迅速,细胞贴壁紧密,呈长梭形,多数细胞向两侧伸出触角,显微镜下观察,细胞透亮,立体感较强,杂细胞少(图1)。

图1 原代番鸭胚成纤维细胞生长状态(100×)Fig.1 Growth state of primary MDEF(100×)
2.2 不同消化方式对MDEF密度和活率的影响
相同体积的组织块和消化液,分别采用热、冷两种方式进行消化,经细胞计数和台盼蓝染色对比细胞密度和活率,结果如图所示(表1),冷消化法的细胞密度较热消化法高1.85×106/mL,但差异不显著(P>0.05),细胞的活率较热消化高5.55%,差异显著(P<0.05),由此可见,在MDEF 的原代培养中冷消化法优于热消化法。
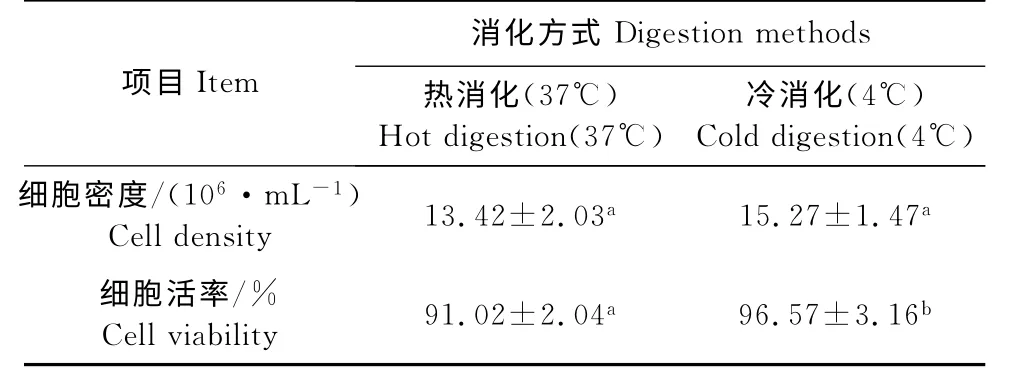
表1 不同消化方式对原代番鸭胚细胞密度和活率的影响Table 1 Effect of different digestion methods on primary MDEF density and viability
2.3 不同的血清浓度对MDEF生长的影响
细胞在不同血清浓度的培养液中生长的速度存在 差 异,采 用 含 血 清20、50、80、100 mL/L 的DMEM 培养MDEF(图2),血清的浓度越高,细胞生长速度越快,进入平台期的时间越短;在80mL/L 和100mL/L血清浓度培养48h后即可达到平台期,随后细胞快速衰老;50 mL/L 血清浓度培养细胞的平台期推迟到72h,且衰老的速度较慢;20 mL/L血清浓度细胞生长缓慢,96h时仍具有较高的增值活性,但由于长时间没有铺满底壁,出现形态不规则,并存在一些杂细胞。
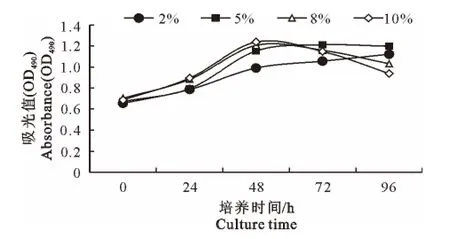
图2 不同血清浓度对番鸭胚成纤维细胞生长的影响Fig.2 Effect of different serum concentration on MDEF growth
2.4 不同的血清浓度对MDEF冻存活性的影响
使用DMSO 终浓度为100 mL/L,血清浓度分别为100、150、200、250、300mL/L的细胞冻存液冻存MDEF,比较细胞复苏后的增值活性,结果显示(图3),在10%~20%范围内随着冻存液中血清比例的升高细胞复苏后的增殖活性显著升高(P<0.05),20%~30%范围内血清浓度的增加对MDEF的活性并无明显的影响(P>0.05),提示MDEF冻存液中DMSO∶血清∶培养液的比例为1∶2∶7可满足MDEF的冻存需要。

图3 不同血清浓度对番鸭成纤维细胞冻存活性的影响Fig.3 Effect of different serum concentration on MDEF cryopreservation viability
2.5 离心对MDEF传代和复苏活率的影响
细胞传代或复苏操作中,离心可去除培养液中残留的消化液(如胰酶、胶原酶等)和DMSO 等,本研究探讨在传代和复苏番鸭胚细胞操作中离心和不离心对细胞活率的影响(图4~图5),传代时不离心细胞的活率较离心高1.65%(P<0.05),复苏时不离心细胞的活率较离心高0.96%,这可能由于离心操作会损伤部分细胞的细胞壁,而少量的消化液和低浓度的DMSO 不会影响细胞的贴壁和生长有关。

图4 离心对原代番鸭胚成纤维细胞传代和复苏活率的影响Fig.4 Effect of centrifugation on MDEF viability after cell subculture and resuscitation

图5 离心对复苏番鸭胚成纤维细胞活率的影响(16h,200×)Fig.5 Effect of centrifugation on MDEF viability in resuscitation(16h,200×)
3 讨论
原代组织细胞培养一般是通过组织消化法,胰蛋白酶是一种常用的组织消化酶,其可水解细胞间质中精氨酸与赖氨酸羧基所形成的肽键,从而使组织块分散成单个细胞[6-7]。本研究采用2.5g/L 的胰酶消化11 胚龄番鸭胚体,获得较为纯净的MDEF,细胞呈长梭形,贴壁紧密,在含100 mL/L血清的DMEM 培养液中生长良好。原代细胞制备过程中常采用热消化法,即将组织快与消化液混均后放入37℃培养箱中消化,此方法可较为快速的得到原代细胞,由于热消化时消化酶的活力较强,原代细胞可能由于过度消化而造成损伤[8]。本研究比较了热消化与冷消化在MDEF 制备过程中获得的细胞密度和细胞活率,与热消化法相比,冷消化获得的细胞密度和细胞活率均明显增加,这可能是由于低温长时间消化,使组织块消化的更彻底,且低活力的胰酶对细胞的损伤也较小。
血清中的营养物质可促进细胞的贴壁和生长[9-10],不同种类的细胞生长所需血清的种类和浓度也不相同。对特定种类的细胞而言,不同浓度的血清也会使细胞表现出不同的生长曲线[11],本研究分别采用20、50、80、100 mL/L FBS 的DMEM 培养液原代番鸭胚成纤维细胞,随着血清浓度的升高MDEF达到平台期的时间越短,血清浓度高细胞生长迅速,可能不利于试验的操作和观察,而血清浓度太低会使原代细胞生长缓慢,并出现较多的杂细胞,因此在原代番鸭胚成纤维细胞的培养中,应根据研究需要进行灵活的调整。
细胞冻存可保证细胞的扩大培养和研究的连续使用,细胞冻存时必须使用细胞冻存液。血清中由于含有多种蛋白质、多肽和激素等物质,其在冻存液中不仅具有促细胞贴附和增殖作用,还可有效减少和缓冲不利因素对细胞的毒性和损伤[12]。研究表明,冻存液中血清的浓度会影响细胞复苏时的活率[13]。本研究使用DMSO 为保护剂,终浓度100 mL/L,血 清 浓 度 分 别 为100、150、200、250、300 mL/L的细胞冻存液冻存MDEF,结果表明,血清浓度在20%时细胞活率显著高于10%和15%,但血清浓度高于20%时对MDEF 的复苏活率无显著的影响,因此DMSO∶血清∶DMEM 浓度比为1∶2∶7时可满足鸭胚成纤维细胞的冻存需求。
细胞传代和复苏过程中的离心操作可去除残留的胰酶和冻存液,但离心操作会使细胞堆积,细胞壁相互粘连,在吹打细胞的过程中也会有部分细胞损伤[14],除此之外,离心过程增加器材的使用,也相对增加了细胞被污染的机率。本研究比较离心与不离心在MDEF传代和复苏过程中对细胞活率的影响,结果显示,在细胞传代和复苏过程中去除离心步骤,细胞活率分别提高1.65%和0.96%,细胞的贴壁和生长良好,并且使操作更加简单。有研究发现,血清中的A2巨球蛋白有抑制胰蛋白酶的作用,可使残留的胰酶被灭活[11],DMSO 作为细胞冻存时的保护剂,可使细胞失去部分水分,从而在冻存和复苏过程中防止细胞破裂,高浓度的DMSO 对细胞有一定毒性,本研究采用培养液对复苏MDEF进行9倍~10倍稀释,DMSO 经稀释后终浓度约为10 mL/L,MDEF复苏时的活率不仅没有下降,反而增加了0.96%。有研究发现,DMSO、甘油等细胞冻存保护剂的浓度为1mol/L左右时对细胞相对无毒[15],并且终浓度在20mL/L以内的DMSO 不会对细胞的生长和活性产生明显的影响[16-17],本研究中由于去除离心操作,减少了细胞的损伤,细胞的活率反而有一定的增加。
[1] 林 谦,吴买生,蒋桂韬,等.不同羽色和性别番鸭屠宰性能及肌肉成分比较研究[J].家畜生态学报,2014,35(1):30-34.
[2] 陈仕龙,陈少莺,林锋强,等.番鸭主要病毒病及其防控要点[J].中国家禽,2015,37(1):71-72.
[3] 李 群,钱 钟,范 娟,等.动物细胞悬浮培养技术在兽用疫苗生产领域中的应用[J].中国畜牧兽医,2013,40(6):236-240.
[4] 贺亦龙,邵周伍林,白小飞,等.5株水禽细小病毒全基因组序列分析[J].畜牧兽医学报,2014,45(11):1837-1843.
[5] 阮二垒,陈申秒,朱秀高,等.番鸭细小病毒在番鸭胚成纤维细胞上的培养[J].上海畜牧兽医通讯,2011,2:45-46.
[6] 许 静,李进军,熊 胜,等.鸭胚成纤维细胞培养、传代及保存方法的研究[J].中国家禽,2012,34(13):9-13.
[7] 杨 航,易 琼,李圆方,等.两种不同消化法对小鼠乳腺上皮细胞培养的影响[J].动物医学进展,2014,35(3):59-64.
[8] 项碧飞,孟宇航,郭春华,等.鸭胚成纤维细胞培养技术的改良[J].四川畜牧兽医,2008,6:29-30.
[9] 张宝红,张为宇,韩忠燕,等.牛血清中蛋白组分初步分析及其对细胞培养的影响[J].动物医学进展,2009,30(1):33-37.
[10] Freshney R.Culture of animal cells:A manual of basic technique and specialized applications[M].6th ed.New York:Wiley-Sons,2010:149-175.
[11] 吴宏梅,刘 帅,包阿东,等.不同胎牛血清对动物细胞体外培养的影响[J].中国畜牧兽医,2009,34(4):96-99.
[12] Remi T,Fumito Y,Yoshihisa K.Cell type-selective expression of green fluorescent protein and the calcium indicating protien,yellow cameleon,in rat cortical primary cultures[J].Brain Res,2002,956(2):221-229.
[13] 陈露萍,王 璞,汤海亮,等.不同冻存液对人诱导性多能干细胞冻存与复苏效果的影响[J].中国临床精神科学,2012,20(5):494-499.
[14] 陆 瑶,张嘉卿,周 晨,等.白细胞滤除、离心对红细胞的损伤分析[J].临床输血与检验,2006,8(3):212-213.
[15] 肖 雄,邓玉金,赵海龙,等.不同冷冻保护剂和冷冻方法对小鼠耳皮肤成纤维细胞冻存效果的影响[J].动物医学进展,2012,33(5):69-74.
[16] 吴 迪,巴哈尔古丽·卡哈尔,吴桂荣,等.溶媒二甲基亚砜对细胞生长与活力的影响研究[J].新疆医科大学学报,2010,33(5):489-491.
[17] Lin J,Zhu LQ,Qin T,et al.Enhancement of gene transfer efficiency in the Bcap-37cell line by dimethyl sulphoxide and menthol[J].Mol Med Rep,2012,6(6):1293-1300.
