预测乙烷/离子液体系统溶解平衡的UNIFAC模型
2015-06-09唐盛伟
张 圆,唐盛伟,张 涛
(四川大学 化学工程学院 四川省多相流传质与反应工程重点实验室,四川 成都 610065)
预测乙烷/离子液体系统溶解平衡的UNIFAC模型
张 圆,唐盛伟,张 涛
(四川大学 化学工程学院 四川省多相流传质与反应工程重点实验室,四川 成都 610065)
采用UNIFAC模型对乙烷在1-烷基-3-甲基咪唑双三氟甲基磺酰亚胺盐 ([RMIm][Tf2N],R=乙基(E)、丁基、己基、辛基(O)、癸基)离子液体中的113个溶解度数据进行关联,得到了乙烷与主基团CH2—和[MIm][Tf2N]间的交互参数,建立了预测乙烷在该类离子液体中溶解度的UNIFAC模型。利用该模型预测了乙烷在[EMIm][Tf2N]和[OMIm][Tf2N]两种离子液体中的溶解度,预测值与文献值吻合较好,平均误差分别为4.01%和3.81%,最大误差为9.86%。将该模型用于分析改变烷基链长对乙烷在[RMIm][Tf2N]离子液体中溶解度的影响发现,在烷基链长较短时,增加其链长可有效提高乙烷的溶解度;但当烷基链长较长时,其效果减弱。该模型可对乙烷在该类离子液体中的溶解度进行有效预测,为其相关的传质分离过程提供相平衡数据。
乙烷;离子液体;溶解度;UNIFAC模型;1-烷基-3-甲基咪唑双三氟甲基磺酰亚胺盐
离子液体具有蒸汽压极低、难挥发、良好的 化学稳定性和热稳定性、不易燃及良好的导电性等优良特性[1],更重要的是其结构可按实际要求进行设计。离子液体已广泛应用于催化反应、分离和电化学等众多领域[2-8]。
离子液体系统的相平衡是对其在反应、分离等涉及传质的过程中的应用进行研究、设计的基础。如在离子液体催化的气液反应中,气体在离子液体中的溶解度直接影响反应的效率,进一步会影响产物的收率;在气体分离中,不同气体组分在离子液体中的溶解度差异将决定其分离的难易程度。目前,已有许多学者测定了气体在离子液体中的溶解度,但这远不能满足实际应用需求。单纯从实验中获得溶解度数据的工作量是巨大的,用相平衡模型预测气体在离子液体中的溶解度对离子液体在化工过程中的应用十分重要。UNIFAC基团贡献法[9]将分子划分为基本基团,只考虑基团间的交互作用,特别适用于相平衡数据十分缺乏的离子液体系统。Lei等[10]将UNIFAC模型应用于CO2/离子液体系统,回归了CO2与22种离子液体基团间的交互参数,并预测了CO2在混合离子液体中的溶解度,还回归了CO和H2与离子基团间的UNIFAC模型交互参数[11]。但在其他气体/离子液体系统中,UNIFAC模型的应用还较少。
本工作对乙烷/1-烷基-3-甲基咪唑双三氟甲基磺酰亚胺盐([RMIm][Tf2N], R=乙基(E)、丁基(B)、己基(H)、辛基(O)、癸基(D))离子液体系统的UNIFAC模型基团交互参数进行了回归,并预测了离子液体烷基链长对乙烷溶解度的影响。
1 UNIFAC模型
当乙烷/离子液体系统处于相平衡时,有

式中,x1和y1分别为乙烷在液相和气相中的摩尔分数;φ1(T, p, y1)为乙烷在气相中的逸度系数,由PR方程计算得到;p为系统压力,kPa;为乙烷的饱和蒸气压,kPa;γ1为乙烷在离子液体中的活度系数,可由实验数据或UNIFAC模型求得。由于离子液体的蒸气压极低,气相中几乎不存在离子液体,所以气相为纯乙烷相,y1=1。
UNIFAC模型[9]是UNIQUAC模型与基团分析法相结合而发展起来的活度系数模型,该模型将活度系数分为两部分:组合项ln(是由分子大小和形状引起的)和剩余项ln(是由分子间相互作用引起的)。其表达式为:组合项ln的计算式为:

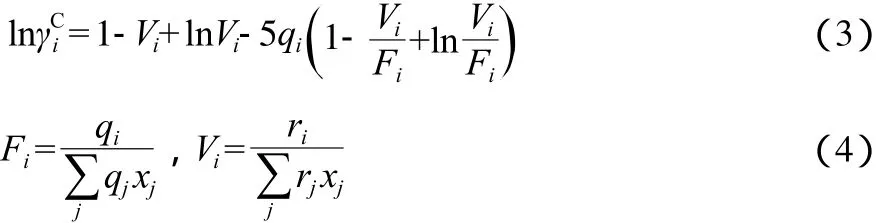
式中,qi和ri分别为纯组分分子的表面积参数和体积参数,其计算式为:



式中,xi为组分i的摩尔分数;Xm为基团m在溶液中的摩尔分数;ψnm为基团交互作用参数。

2 结果与讨论
2.1 UNIFAC模型参数回归
在应用UNIFAC模型时,需将组分拆分为基本基团。将气态乙烷分子作为一个主基团;对于离子液体,由于离子对之间有较强的静电作用[12],所以将阳离子甲基咪唑环和阴离子看作一个整体,将其作为主基团。以[BMIm][Tf2N]为例,将其拆分为1个[MIm][Tf2N]、1个CH3—和3个CH2—共5个基团(见图1)。离子液体的基团拆分见表1。

图1 [BMIm][Tf2N]的基团拆分示意图Fig.1 Diagram of split groups of[BMIm][Tf2N].

表1 离子液体的基团拆分Table 1 Groups of the ionic liquids for the UNIFAC model
UNIFAC模型计算中所需的基团表面积参数(Q)和体积参数(R)取自文献[12-13],见表2。

表2 基团体积参数和表面积参数Table 2 Volume parameters(R) and surface area parameters(Q) of the groups
UNIFAC模型交互参数回归中,目标函数OF定义为:

式中,xexp和xcal分别为乙烷在离子液体中的溶解度实验值和UNIFAC模型计算值;N为实验数据点数,N=113。
为提高交互参数回归效率和减少交互参数回归个数,CH2—(m)与[MIm][Tf2N](n)之间的交互参数直接使用文献值[12]:amn=400.89,anm=145.8。C2H6与CH2—和[MIm][Tf2N]之间的交互参数通过拟合乙烷在[EMIm][Tf2N][14],[BMIm][Tf2N][15],[HMIm][Tf2N][16-17],[DMIm][Tf2N][15]离子液体中的溶解度实验数据得到。通过求解目标函数式(10)得到的UNIFAC模型基团交互参数回归值见表3。回归时最小化目标函数值为0.042 9。
乙烷在离子液体中的溶解度实验值与UNIFAC模型回归值的比较见图2。由图2可见,绝大多数数据点的相对误差在10%以内,只有少数数据点的相对误差大于10%,但未超过15%。
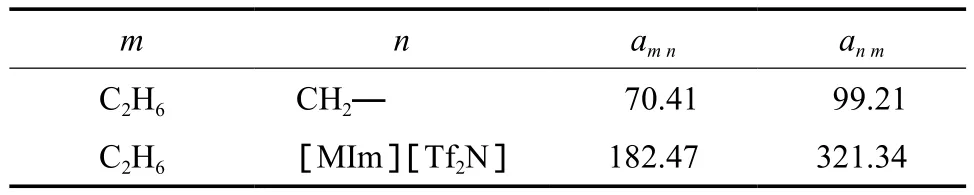
表3 UNIFAC模型基团交互参数回归值Table 3 Fitted group interaction parameters for the UNIFAC model

图2 乙烷在离子液体中的溶解度实验值与UNIFAC模型回归值的比较Fig.2 Comparison between the experimental data(xexp) and the values calculated by the UNIFAC model(xcal) for the solubility of ethane in the ionic liquids.
UNIFAC模型回归的平均相对误差见表4。由表4可知,在乙烷/[EMIm][Tf2N]系统中平均相对误差最小,为1.36%;在乙烷/[HMIm][Tf2N]系统中平均相对误差最大,为7.35%。考虑到溶解度数据来源于不同的文献,存在实验误差等因素,该预测结果是可以接受的,模型参数回归效果较好。

表4 UNIFAC模型回归的平均相对误差Table 4 Average relative deviation(ARD) of regression with the UNIFAC model
2.2 利用溶解度数据验证UNIFAC模型参数
为验证回归的基团交互参数的有效性,采用乙烷在[EMIm][Tf2N][18]和[OMIm][Tf2N][15]中的溶解度数据与UNIFAC模型预测值进行比较(见图3),其相对误差见表5。从表5可看出,UNIFAC模型预测值与实验值吻合得较好,最大相对误差小于10%;乙烷/[EMIm][Tf2N]系统的平均相对误差为4.01%,乙烷/[OMIm][Tf2N]系统的平均相对误差为3.81%。UNIFAC模型中基团交互参数的有效性与回归所用实验数据的准确性和数量有很大关系,实验数据越精确,数量越多,回归得到的基团交互参数越有效。目前乙烷在离子液体中的溶解度数据还较少,还需广大科研工作者继续完善。

表5 乙烷在离子液体中的溶解度实验值与UNIFAC模型预测值的相对偏差Table 5 Relative deviation of the values predicted by the UNIFAC model and the experimental data
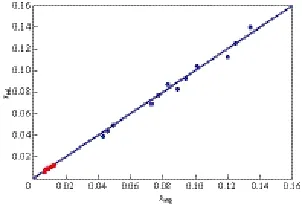
图3 乙烷在离子液体中的溶解度实验值与UNIFAC模型预测值的比较Fig.3 Comparison between the experimental data and the values predicted by the UNIFAC model for the solubility of ethane in the ionic liquids.
2.3 UNIFAC模型预测离子液体结构对乙烷溶解度的影响
运用回归的基团交互参数,可预测离子液体烷基链长与乙烷溶解性能的关系。以亨利常数表示乙烷在离子液体中的溶解度,其值越小,则表示乙烷的溶解度越大。亨利常数定义为:
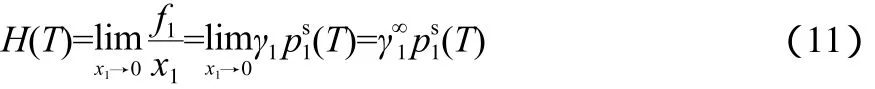
式中,H(T)为温度T下乙烷在离子液体中的亨利常数,MPa;为乙烷在离子液体中的无限稀释活度系数,由UNIFAC模型计算;(T)为乙烷在温度T下的饱和蒸气压,MPa;f1为乙烷的逸度,MPa;x1为乙烷在离子液体中的摩尔分数。
预测了298.15 K时乙烷在不同烷基链长离子液体中的亨利常数,并与文献值进行比较(见图4)。从图4可看出,在考虑了实验方法不同以及实验装置误差的情况下,乙烷在[EMIm][Tf2N],[BMIm][Tf2N],[HMIm][Tf2N],[OMIm]·[Tf2N],[DMIm][Tf2N]等5种离子液体中的亨利常数的UNIFAC模型预测值与文献值[14-19]吻合得很好,且其随烷基链长的变化规律一致。这进一步说明了UNIFAC模型能对乙烷在离子液体中的溶解度进行比较准确的预测。从图4还可看出,离子液体烷基侧链上的碳原子数目对乙烷在离子液体中的亨利常数影响很大。对于不同长度的烷基链,当碳原子数目变化相同时,对亨利常数的影响程度差别很大。如当烷基侧链上碳原子数目由2增至4时,单位碳原子对亨利常数的改变量为2.12 MPa;而当碳原子数目由18增至20时,单位碳原子对亨利常数的改变量仅为0.13 MPa。总体上,随烷基链长的增加,乙烷在离子液体中的亨利常数呈降低趋势,且降幅先快后慢,逐渐趋于平稳。这表明随烷基链长的增加,烷基链长变化对乙烷溶解度的影响逐渐减弱。所以在离子液体烷基链长较短时,增加其链长能有效提高乙烷在其中的溶解度;但当烷基链长较长时,增加其链长对乙烷溶解度的影响减弱,此时需采取其他手段来提高乙烷的溶解度,如改变其阴离子结构等。

图4 298.15 K时UNIFAC模型预测乙烷在离子液体中的HFig.4 Henry constants(H) of ethane in ionic liquids at 298.15 K predicted by the UNIFAC model.
3 结论
1)对乙烷/[RMIm][Tf2N]离子液体系统的UNIFAC模型基团交互参数进行了回归,拟合效果较好,最小化目标函数值为0.042 9。将回归的基团交互参数用于[EMIm][Tf2N]和[OMIm][Tf2N]离子液体中乙烷溶解度的模拟计算,计算结果与文献值的平均相对误差分别为4.01%和3.81%。
2)运用拟合的UNIFAC模型,预测了298.15 K时乙烷在不同烷基链长离子液体中的亨利常数,预测值与实验值的吻合程度高。通过分析离子液体烷基链长对乙烷溶解度的影响发现,随离子液体烷基链长的增加,改变烷基链长对乙烷溶解能力的影响逐渐减弱。
3)所建立的乙烷/[RMIm][Tf2N]离子液体系统的UNIFAC模型可对乙烷在该类离子液体中的溶解度进行有效预测,为其相关的传质分离过程提供相平衡数据。
符 号 说 明
a UNIFAC模型基团交互参数
f1乙烷的逸度,MPa
H 亨利常数
N 实验数据点数
p 体系压力,kPa
Q 基团表面积参数
R 基团体积参数
T 温度,K
X 基团在溶液中的摩尔分数
x1乙烷在液相中的摩尔分数
xexp乙烷在离子液体中的溶解度(摩尔分数)
xcalUNIFAC模型计算得到的溶解度(摩尔分数)
Γk基团k的剩余活度系数
γ1乙烷在液相中的活度系数
θ 基团表面积分数
φ1乙烷在气相中的逸度系数
ψ 基团交互作用参数
下角标
i,j 组分,i,j = 1,2,…
k,m,n 基团,k,m,n=1,2,…
[1] Rogers R D,Seddon K R. Ionic Liquids:Solvents of the Future?[J]. Science,2003,302(5646):792 - 793.
[2] Sheldon R. Catalytic Reactions in Ionic Liquids[J]. Chem Commun,2001(23):2399 - 2407.
[3] Berthod A,Ruiz-Angel M,Carda-Broch S. Ionic Liquids in Separation Techniques[J]. J Chromatogr A,2008,1184(1):6 - 18.
[4] Galiński M,Lewandowski A,Stępniak I. Ionic Liquids as Electrolytes[J]. Electrochim Acta,2006,51(26):5567 - 5580.
[5] 徐新,罗国华,王莉. 氯铝酸离子液体催化苯与氯乙烷合成乙苯[J]. 石油化工,2012,41(1):33 - 36.
[6] 刘春萍,刘刚,胡玉才,等. 1-苄基-4-甲基吡啶盐离子液体的合成及其电导性能的研究[J]. 石油化工,2011,40(7):764 - 769.
[7] 王吉林,王璐璐. 离子液体1-丁基-3-甲基咪唑磷酸二丁酯的制备及其催化酯化反应的性能[J]. 石油化工,2011,40(6):635 - 639.
[8] 田征,崔现宝,彭艳枚,等. 离子液体萃取精馏分离乙酸甲酯-甲醇共沸物[J]. 石油化工,2013,42(5):537 - 541.
[9] Fredenslund A,Jones R L,Prausnitz J M. Group-Contribution Estimation of Activity Coeffcients in Nonideal Liquid Mixtures[J]. AIChE J,1975,21(6):1086 - 1099.
[10] Lei Zhigang,Dai Chengna,Wang Wei,et al. UNIFAC Model for Ionic Liquid-CO2Systems[J]. AIChE J,2014,60(2):716 - 729.
[11] Lei Zhigang,Dai Chengna,Yang Qian,et al. UNIFAC Model for Ionic Liquid-CO(H2) Systems:An Experimental and Modeling Study on Gas Solubility[J]. AIChE J,2014,60(12):4222 - 4231.
[12] Lei Zhigang,Zhang Jiguo,Li Qunsheng,et al. UNIFAC Model for Ionic Liquids[J]. Ind Eng Chem Res,2009,48(5):2697 - 2704.
[13] Banerjee T,Singh M K,Sahoo R K,et al. Volume,Surface and UNIQUAC Interaction Parameters for Imidazolium based Ionic Liquids via Polarizable Continuum Model[J]. Fluid Phase Equilib,2005,234(1):64 - 76.
[14] Hong Gao,Jacquemin J,Deetlefs M,et al. Solubility of Carbon Dioxide and Ethane in Three Ionic Liquids Based on the Bis{(Trifluoromethyl) Sulfonyl}Imide Anion[J]. Fluid Phase Equilib,2007,257(1):27 - 34.
[15] Gomes M F C,Pison L,Pensado A S,et al. Using Ethane and Butane as Probes to the Molecular Structure of 1-Alkyl-3-Methylimidazolium Bis[(Trifluoromethyl) Sulfonyl]Imide Ionic Liquids[J]. Faraday Discuss,2012,154:41 - 52.
[16] Florusse L J,Raeissi S,Peters C J. High-Pressure Phase Behavior of Ethane with 1-Hexyl-3-Methylimidazolium Bis(Trifluoromethylsulfonyl)Imide[J]. J Chem Eng Data,2008,53(6):1283 - 1285.
[17] Costa G M. Low-Pressure Solubility and Thermodynamics of Solvation of Carbon Dioxide,Ethane,and Hydrogen in 1-Hexyl-3-Methylimidazolium Bis(Trifluoromethylsulfonyl)Amide Between Temperatures of 283 K and 343 K[J]. J Chem Eng Data,2007,52(2):472 - 475.
[18] Liu Xiangyang,Afzal W,Prausnitz J M. Solubilities of Small Hydrocarbons in Tetrabutylphosphonium Bis(2,4,4-Trimethylpentyl)Phosphinate and in 1-Ethyl-3-Methylimidazolium Bis(Trifuoromethylsulfonyl)Imide[J]. Ind Eng Chem Res,2013,52(42):14975 - 14978.
[19] Anthony J L,Anderson J L,Maginn E J,et al. Anion Effects on Gas Solubility in Ionic Liquids[J]. J Phys Chem B,2005,109(13):6366 - 6374.
(编辑 安 静)
UNIFAC Model for Prediction of Dissolution Equilibrium of Ethane/Ionic Liquid Systems
Zhang Yuan,Tang Shengwei,Zhang Tao
(Multi-Phases Transfer and Reaction Engineering Laboratory,College of Chemical Engineering,Sichuan University,Chengdu Sichuan 610065,China)
113 Solubility data of ethane in ionic liquids 1-alkyl-3-methylimidazolium bis(trifluoromethylsulfonyl)imide([RMIm][Tf2N],R=ethyl(E),butyl,hexyl,octyl(O),decyl) were fitted by the UNIFAC model and the interaction parameters between C2H6,and CH2— and[MIm][Tf2N] were obtained. The UNIFAC model was used to predict the solubilities of ethane in[EMIm][Tf2N] and [OMIm][Tf2N]. The results showed that the predicated data agreed with the experimental data well,the average relative deviations were 4.01% and 3.81% respectively,and the largest relative deviation was 9.86%. The effect of alkyl chain length on the ethane solubility in the ionic liquids was investigated by means of the UNIFAC model. It was found that increasing the alkyl chain length could enhance the dissolution effectively when the length was relatively short,but when the carbon number was larger than 10,the effects became weaker. The obtained UNIFAC model is useful for predicting the ethane solubility in[RMIm][Tf2N].
ethane;ionic liquids;solubility;UNIFAC model;1-alkyl-3-methylimidazolium bis(trifuoromethylsulfonyl)imide
1000 - 8144(2015)10 - 1212 - 06
TQ 013.1
A
2015 - 04 - 13;[修改稿日期] 2015 - 06 - 27。
张圆(1989—),男,四川省武胜县人,硕士,电邮 sccdzy2008@163.com。联系人:唐盛伟,电话 028 - 85405201,电邮tangdynasty@scu.edu.cn。
国家自然科学基金项目(21276163)。
