枯草芽孢杆菌转基因研究进展
2015-06-09武彩霞综述刘开扬审校
武彩霞,王 静 综述,刘开扬 审校
(河北北方学院生命科学研究中心,河北 张家口 075000)
枯草芽孢杆菌转基因研究进展
武彩霞,王 静 综述,刘开扬 审校
(河北北方学院生命科学研究中心,河北 张家口 075000)
随着基因工程和分子生物学的飞速发展,在转基因微生物领域里,枯草芽孢杆菌表达系统已经成为一种继大肠杆菌表达系统和酵母表达系统之后的新型表达系统,为外源基因提供了良好的宿主环境,使外源基因可以进行表达,目前已经取得了较显著的成绩。该文阐述了枯草芽孢杆菌转基因研究中质粒载体的构建、转化方法、菌株全基因序列及外源基因在枯草芽孢杆菌中的表达等方面的进展。
枯草芽孢杆菌;质粒载体;外源基因;表达
转基因技术是基因工程的一种技术手段,以分子遗传学为理论基础,以微生物学和分子生物学的方法为手段,按照人类的意愿将外源基因通过构建表达载体并转入表达宿主菌等,产生人类所需要的目标产物,因此而获得新的菌株(修饰后的转基因菌株)、新的产品制备法(之前产品制备量少,现在可大规模生产)和新的品种。转基因技术为基因结构和功能的研究提供了强有力的手段,利用转基因微生物生产医药、工业、食品及环境用外源蛋白是微生物技术研究和开发的重点之一。目前已经能够利用枯草芽孢杆菌生产许多外源蛋白,如具有活性的LTB抗原蛋白[1]、碱性蛋白酶[2]、乙醇脱氢酶[3]、内切葡聚糖酶和β-葡萄糖苷酶[4]等。随着对枯草芽孢杆菌表达宿主的深入研究,枯草芽孢杆菌将会成为转基因技术研究中重要的宿主菌,具有很重要的理论研究和应用价值。
1 枯草芽孢杆菌
枯草芽孢杆菌(Bacillussubtilis,简称B.subtilis)属于芽孢杆菌属,是一类嗜温、好氧、内生抗逆性孢子的革兰氏阳性菌,广泛分布于土壤及腐败的有机物中。作为革兰氏阳性细菌的典型代表,对其生理生化,遗传及分子生物学的研究已有50多年的历史[5]。枯草芽孢杆菌是转基因技术常用宿主菌之一,其它常用的宿主菌有大肠杆菌、酵母菌和农杆菌等。
枯草芽孢杆菌也是一种益生菌,作为益生菌被应用在多个领域。在食品行业方面,枯草芽孢杆菌因在生长过程中能产生具有一定抗菌效果的抗菌素,并且研究证明枯草芽孢杆菌不产生对人体有害的物质,所以可以作为食品产品的发酵菌种[6];在农业上,枯草芽孢杆菌作为一种有效的生防菌已经被广泛使用,不仅可抑制病原菌的生长,还可以促进农作物增产[7];枯草芽孢杆菌目前还可被应用在饲料、医药(新型的药物或抗原投递系统等)、养殖业、洗涤和纺织皮革等行业;枯草芽孢杆菌也可以作为一种微生态制剂应用在多种领域中[8]。
2 枯草芽孢杆菌表达系统
枯草芽孢杆菌表达系统是缓慢发展起来的一种表达系统,之前因为芽孢杆菌自身质粒没有标记基因,不利于筛选,所以一直不能被用作表达系统,但自从发现芽孢杆菌表达系统可以允许来源于其它菌的载体的复制和表达,尤其是研究发现金黄色葡萄球菌的载体能运用于芽孢杆菌之后,芽孢杆菌表达系统(转化金黄色葡萄球菌的载体)被大量应用。芽孢杆菌中大多数可以作为表达宿主,主要包括枯草芽孢杆菌和地衣芽孢杆菌,其中枯草芽孢杆菌是目前使用最多的表达宿主菌。芽孢杆菌属中其它可以用于外源基因克隆表达的宿主菌有:嗜碱芽孢杆菌、淀粉芽孢杆菌、短芽孢杆菌、巨大芽孢杆菌、短小芽孢杆菌、球形芽孢杆菌、嗜热脂肪芽孢杆菌、苏云金芽孢杆菌、耐热的芽孢杆菌和病原菌炭疽芽孢杆菌等[9]。
1958年Spizizen首次发现了枯草芽孢杆菌168菌株能摄取外源基因,后来随着DNA重组技术的发明,又因为金黄色葡萄球菌(Staphylococcusaureus)带抗性标志的质粒可作为枯草芽孢杆菌载体的发现(克服了枯草杆菌只有隐秘性质粒的困难)及枯草芽孢杆菌全基因组DNA测序的完成使得枯草芽孢杆菌基因工程的工作的到了迅速发展。枯草芽孢杆菌作为继大肠杆菌表达系统和酵母表达系统之后的基因工程菌具有巨大潜力和优势[10],主要因素有:非致病性,与大肠杆菌相比枯草芽孢杆菌被认为是GRAS生物;枯草芽孢杆菌与大肠杆菌和酵母相比,对培养基的要求成本相对较低;枯草芽孢杆菌没有明显的密码子偏好性,不会出现因表达的外源蛋白含有大量连续的稀有密码子而降低蛋白表达量,或者翻译提前终止等问题[11];枯草芽孢杆菌在极端条件下可以诱导产生抗逆性很强的内源孢子,具有较强的抗逆性;与大肠杆菌相比,较多的外源质粒载体(研究者构建的各种优良载体)可以被转入枯草芽孢杆菌中;通过实验和实际生产证明枯草芽孢杆菌表达系统比较稳定可靠;枯草芽孢杆菌具有分泌自身胞外蛋白和外源蛋白的功能,所以表达后的外源蛋白可以被简单的回收和纯化;有多种转运机制,能够在蛋白空间构象正确形成后,将外源蛋白被转运到细胞外;枯草芽孢杆菌的培养条件及代谢过程已经被研究透彻,所以能够很好的控制其发酵过程,并将枯草芽孢杆菌应用于发酵培养。
枯草芽孢杆菌启动子是实现外源基因在枯草芽孢杆菌宿主菌中高效表达的关键因子,启动子根据控制转录水平的高低,可以分为强启动子和弱启动子;根据诱导机制,启动子又可分为组成型启动子、诱导型启动子、时期特异性启动子和自诱导启动子[12]。组成型启动子在表达时无需受外界的诱导,具有持续性且大体恒定在一定水平上,枯草芽孢杆菌中应用的组成型启动子有HpaⅡ、lepA、SPO2和P43等,其中以P43应用较为广泛[11]。枯草芽孢杆菌诱导启动子有:PamyQ、温度诱导启动子、Tet启动子、IPTG诱导型启动子、PxylA、Pglv、PspaS、PmanP和PliaI。PamyQ诱导剂为淀粉;Tet启动子诱导剂为四环素;IPTG诱导型启动子包括PgroE、Pspac和Pgrac;PxylA诱导剂为木糖;Pglv诱导剂为麦芽糖;PspaS诱导剂为subtilin;PmanP诱导剂为甘露糖;PliaI诱导剂为杆菌肽。而在枯草芽孢杆菌的基因工程中,常用的化学诱导系统有Pspac、Pxyl和PsacB系统等[13-14]。Su-Jin Lee等(2010)将苏云芽孢杆菌中产Cry(晶体蛋白)的cry3Aa启动子的-35和-10区改成与枯草芽孢杆菌σA-依赖性启动子一致的序列。cry3Aa启动子的修饰使AprE的产量显著提高,这表明了该启动子可能有利于枯草芽孢杆菌蛋白的高效表达[15]。B.R.Belitsky等[16](2015)研究了枯草芽孢杆菌总调控因子CodY和ScoC之间的相互调节作用,ScoC-lacZ融合和DNA结合试验表明:ScoC被CodY抑制,产生了级联调节反应;最后研究表明,ScoC的功能会由于其自身表达或与DNA结合调节而被其它转录因子所调控。Yan等[17](2015)发现了枯草芽孢杆菌类真核蛋白激酶(STPK PrkA)在芽孢形成中的新功能,Hpr(ScoC)对转录因子σK的表达起抑制作用,而PrkA可以通过抑制Hpr(ScoC)来促进孢子的形成和σK的表达。T.Phanaksri等[18](2015)研究发现依赖于调节因子σB和σA的两个启动子的协同作用可以提高枯草芽孢杆菌中外源基因的表达,这个双启动子的协同效应是很保守的,仅在σB-启动子位于σA-启动子上游和双启动子定位彼此独立时才出现。
3 枯草芽孢杆菌质粒载体的构建
枯草芽孢杆菌表达系统中质粒载体的构建也是很关键的一步,研究者需根据枯草芽孢杆菌宿主菌的不同来选择合适的表达载体。
目前枯草芽孢杆菌表达载体有整合载体(整合质粒)、噬菌体载体和可复制质粒载体三种。采用整合载体携带外源基因进入枯草芽孢杆菌表达宿主后,整合载体连同外源基因表达单元进入染色体并随染色体的复制而复制和表达,染色体整合表达的优势是外源基因在宿主中可保持较好的稳定性[19],整合载体依据其与染色体基因组DNA的同源重组方式不同,可以分为单交叉同源重组载体(single crossover)和双交叉同源重组载体(double crossover)[12]。可用于枯草芽孢杆菌表达载体的噬菌体有spp1噬菌体和Ф105噬菌体等,其中Ф105噬菌体应用最多,由该噬菌体衍生出的表达载体有Ф105J27和Ф105dcM等[20]。可复制质粒也称为游离质粒或附加型质粒,其在宿主中有多个拷贝,所以使用可复制质粒进行表达的优势是目标基因进入宿主的剂量增大,从而有可能使目的基因表达量大大提高。
目前市场上销售的枯草芽孢杆菌表达质粒载体有pWB980、pHT43、pHP13、pHP43、pBE2、pMUTIN4、pUB110、pE194、pMA5、pMK3、pMK4、pHT304、pHY300PLK、pBest502、pDG1363、pSG1154、pAX01、pSAS114、pDL、pDG148-stu、pDG641、pAL12、pUCX05-bgaB、pHT01和pVLT33,其中pVLT33是广宿主质粒;相配套的菌株有Bacillus subtilis 168、WB600、WB700、WB800、WB800N和FZB42等。科学研究中常用的蛋白酶缺陷型菌株有BG2054、DB104、DB105、DB431、WB600、WB700、LB700和WB800[20]。
T.T.Phan等[21](2015)发现构建的IPTG诱导型表达载体Pgrac100(含外源基因)在枯草芽孢杆菌1012中外源基因有较高水平的表达量,而在大肠杆菌中外源基因的表达量却相对较低,在此载体基础上,他们还构建了Pgrac100-His-tag-MCS载体、Pgrac100-MCS -His-tag载体和Pgrac100-MCS-Strep-tag载体。T.Ogawa等[22](2015)发明了一种新型的枯草芽孢杆菌基因组BGM载体(诱导recA表达系统)——iREX载体,与传统的BGM载体相比,iREX载体能够通过抑制错误重组体来操纵大片段的DNA,而且iREX载体还能被用来处理许多同源序列(比如多重报告表达框)的DNA,因此,iREX载体作为处理大片段DNA的一个平台可以扩大BGM载体的利用率。
4 枯草芽孢杆菌转化方法
枯草芽孢杆菌是表达外源蛋白的良好宿主菌,如表达蛋白酶、磷脂酶和纤维素酶,因此枯草芽孢杆菌可以被直接应用在工业化生产中。但是很多枯草芽孢杆菌宿主菌因为转化效率低而影响了其应用价值。目前质粒载体转入枯草芽孢杆菌的方法有固体培养基法、原生质体裂解物固体培养基法(LP转化法)、感受态细胞制备及转化法(化学转化法,又称为Spizizen法)、电转化法(包括电转化完整枯草芽孢杆菌法和甘氨酸处理的电转化法)和原生质体法。
早在1958年John Spizizen就研究了枯草芽孢杆菌的转化方法,他发明的转化方法Spizizen法目前仍被广泛使用和改进[23]。Zhang等(2011)基于枯草芽孢杆菌SCK6和多聚体质粒的重组发明了一种制备超感受态细胞的新方法,此法简单、快速和高效,简单到只需限制性内切酶、磷酸酶和连接酶即可,高效性体现在转化效率:~107转化子/μg多聚体质粒和~104转化子/μg重组质粒DNA。枯草芽孢杆菌超感受态细胞的制备机制:通过添加木糖诱导感受态主控调节因子ComK的过表达。DNA突变文库的构建需要两轮PCR:①通过易错聚合酶链反应(epPCR)获得诱变处理的DNA,通过高保真PCR(high-fidelity PCR)获得线性质粒;②第一步的两种模板DNA进行重叠PCR(overlap PCR)可获得多聚体质粒。此法为Zhang等(2011)年发明的新方法,通过此新方法不仅提高了蛋白表达水平,还提高了糖苷水解酶家族5内切葡聚糖酶再生非晶态纤维素的特殊活性。DNA突变文库构建的常规方法比较费时、耗力和成功率低,此新方法简单、快速和高效。常规方法和新方法的比较如图1所示[24]。
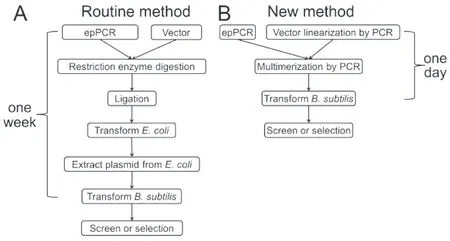
A:常规方法流程 B:新方法流程
枯草芽孢杆菌DB104(枯草芽孢杆菌168的衍生菌株)由于其具有低降解蛋白酶活性和高效的分泌途径,成为一种很受人关注的进化宿主菌,但枯草芽孢杆菌DB104也是和其它枯草芽孢杆菌一样,存在低转化效率(≤103转化子/μg DNA)的缺陷,Vojcic等(2012)经过研究获得了一种较高效率的转化方法,通过在枯草芽孢杆菌感受态阶段改善培养生长条件和组氨酸的浓度、增加感受态阶段的孵育时间和增加转化过程中恢复阶段的孵育时间,使枯草芽孢杆菌DB104的转化效率提高到了~105转化子/μg DNA[25]。
Lu等(2012)通过改善电转化方法的条件分别提高了枯草芽孢杆菌WB800和DB104的转化效率,运用改善后的方法,使得枯草芽孢杆菌WB800的转化效率达到了3.64×105转化子/μg DNA,枯草芽孢杆菌DB104的转化率达到了2.10×105转化子/μg DNA。此转化效率的提高将大大有益于外源基因在枯草芽孢杆菌中的表达、定向进化基因文库构建和野生型枯草芽孢杆菌菌株的转化[26]。
5 枯草芽孢杆菌全基因序列测定及蛋白分泌途径
目前全基因组序列测序成功的枯草芽孢杆菌有很多,全基因组序列测序的成功为人类研究枯草芽孢杆菌的结构和功能机制提供了更好的基础。
最近刚刚公布全基因组序列的枯草芽孢杆菌有:BacillussubtilisATCC 6051a、Bacillussubtilis3NA、BacillussubtilisQB928和Bacillussubtilissubsp.spizizeniiW23等。枯草芽孢杆菌ATCC 6051a(=KCTC 1028/P31K6)是一种广泛用于工业酶制剂的生产菌株,具有很高的分泌效率,Kabisch等[27](2015)公布了枯草芽孢杆菌ATCC 6051a的全基因组序列(Accession No.CP011115),该菌全基因组序列的公布为更好的研究此菌的结构和功能提供了理论依据。枯草芽孢杆菌ATCC 6051全基因序列和作为外源蛋白表达宿主菌已经得到认可,这个野生型菌株与广泛应用于试验的枯草芽孢杆菌168相比显示出许多营养缺陷性,比如不可产生聚酮化合物等。但枯草芽孢杆菌ATCC 6051可以通过遗传学修饰成为优化菌株,在乙偶姻诱导型启动子控制下表达异源蛋白基因[28]。Reuβ等[29](2015)公布了枯草芽孢杆菌3NA的全基因序列(序列登陆号为:CP010314),枯草芽孢杆菌3NA在分批补料发酵时会达到一个高浓度细胞的水平,因此作为一个生产菌株有待于进一步优化,优化后的枯草芽孢杆菌168和W23基因特性的出现更加表明了枯草芽孢杆菌3NA可以成为一个待优化的混合菌株。Yu等[30](2012)完成了枯草芽孢杆菌QB928的全基因组序列测定,并公布在了Genσbank上,序列号为:CP003783。枯草芽孢杆菌QB928全基因序列的成功测定可被广泛应用在枯草芽孢杆菌遗传学研究中。Zeigler(2011)等[31]报道了Bacillussubtilissubsp.spizizeniiW23菌株的全基因序列,此全基因序列的公布强有力地证明了W23是B.subtilisATCC 6633的子代。W23和目前研究的模式菌株B.subtilissubsp.subtilis168同样拥有3.6Mb的核基因,而且核基因次序都是高度保守的;另外,W23基因组有157个不同于B.subtilissubsp.subtilis168的非核基因片段,而B.subtilissubsp.subtilis168基因组有141个不同于W23的非核基因片段。
枯草芽孢杆菌蛋白分泌是指枯草芽孢杆菌表达的蛋白由细胞膜向细胞外运输的过程。枯草芽孢杆菌蛋白分泌途径至少有4种:Sec途径(此途径又称为一般分泌途径,大多数细菌分泌蛋白都通过此转运系统分泌)、Tat途径(又称双精氨酸分泌途径,因分泌蛋白的信号肽中含有两个相邻的精氨酸残基而得名)、ABC转运子途径(主要用于细菌素等分子的输出)和Com分泌途径(与枯草芽孢杆菌感受态的形成有关)[32]。
6 枯草芽孢杆菌作为外源基因表达系统存在的问题及解决方法
枯草芽孢杆菌是一种很重要的可以生产高质量工业酶的革兰氏阳性菌,但运用于工业生产当中有一个很大的障碍:枯草芽孢杆菌自身产生的细胞外蛋白酶可以将外源蛋白降解,这是枯草芽孢杆菌作为外源基因表达系统的最重要缺陷之一。其它缺陷还有:枯草芽孢杆菌表达系统质粒不稳定,一定程度上存在结构型或分离型上的不稳定,在大规模生产中容易丢失或发生结构改变,影响目的蛋白的产率;某些外源基因的表达产物分泌到培养基中会对细胞的生长产生影响;基因对细胞产生毒性时,外源蛋白得不到有效表达。
目前已被确定的枯草芽孢杆菌细胞外蛋白酶有中性蛋白酶A、中性蛋白酶B、枯草杆菌蛋白酶(又称为碱性蛋白酶,包括3种碱性丝氨酸蛋白酶)、金属蛋白酶和杆菌肽F等。枯草芽孢杆菌可以产生细胞外蛋白酶并降解外源蛋白已成为事实,为了克服这一障碍,科学家们通过基因工程手段对枯草芽孢杆菌进行了一些修饰,比如通过基因敲除构建缺失某种或几种细胞外蛋白酶基因的枯草芽孢杆菌菌株;应用缺失突变的方法使染色体上相应的基因失活,构建一个或者多个蛋白酶失活的突变体等。目前构建好的缺失细胞外蛋白酶的枯草芽孢杆菌菌株有:WB600菌株、WB700菌株、WB800菌株和WB800N菌株等。WB600菌株是6个蛋白酶失活的突变株,WB700菌株是7个蛋白酶全失活的突变株,当外源基因在这些突变株中表达时,既提高了产率又增加了稳定性,但这也不是绝对的。Takeko Kodama等(2007)证实在枯草芽孢杆菌后期平稳增长阶段由于AprX泄露到培养基中(可能是由细胞裂解引起的)造成了异源(外源)蛋白的降解[33],因此可以构建缺失AprX基因的菌株;Rabbani等[34](2014)通过同源重组手段使蛋白酶基因aprE失活,从而获得了缺失aprE基因活性的Bacillussubtilis168菌株;B.R.Belitsky等[35](2011)通过使用CodY的突变分析和DNaseⅠ足迹实验的结合,确定了两个与CodY有高亲和力的结合位点与ybgE基因控制子有关。
质粒不稳定和蛋白酶降解目的蛋白使枯草芽孢杆菌转基因表达系统受到制约,目前的解决方法主要有:①利用多个调控基因和诱导的方法控制外源基因的表达;②将克隆基因整合到染色体上,随染色体的复制而复制,后者是目前克隆枯草芽孢杆菌质粒不稳定的一种有效途径[9];③筛选或构建缺陷型蛋白酶菌株。外源基因表达量低的解决办法有改善宿主菌培养条件和优化诱导剂的浓度等。R.F.Li等[36](2015)通过响应面的方法来改善重组体CGA-N46在枯草芽孢杆菌DB1342(p-3N46)的表达条件,结果表明糊精和胰蛋白胨是影响CGA-N46表达的两个关键因素。CodY是革兰氏阳性菌的主调控因子,在枯草芽孢杆菌中,200多个基因包括多肽转运酶、胞内蛋白水解酶和氨基酸降解通路都受CodY调控,但一直以来没有数据显示CodY能够调控胞外蛋白酶,直到G.Barbieri等[37](2015)研究发现当CodY与相应胞外蛋白酶基因的调节区域结合时,CodY可以对Vpr和Mpr两个胞外蛋白酶基因进行负调控调节,因此,目前可以认为CodY是枯草芽孢杆菌全部蛋白有效通路的总调控因子。
7 枯草芽孢杆菌转基因应用及展望
近年来,枯草芽孢杆菌作为转基因表达宿主菌,在分泌外源表达蛋白方面的研究取得了很大的进展,国内外已经成功表达了多种类型的基因[38],例如:Z.B.Guan等[39](2015)首次报道了CotA-laccase在枯草芽孢杆菌WB600中的异源表达,并介绍了重组枯草芽孢杆菌WB600-5在细菌酶的工业化生产方面具有很大的潜能,而且CotA-laccase-ACS系统也有望应用于工业纺织废水的生物学处理中。Q.He[40]等(2015)研究发现在枯草芽孢杆菌使用内蛋白表达系统中可以很好的表达和纯化类似抗菌肽cathelicidin-BF的这种溶解性多肽和蛋白。张漫莉等[41](2013)在枯草芽孢杆菌蛋白酶缺失型菌株WB700中成功表达了纤维素酶EGA基因;李静静[42](2013)成功构建了枯草芽孢杆菌体系诱导表达α-ALDC基因,并比较研究了纯酶的酶学性质,优化了具有工业应用前景的重组枯草芽孢杆菌发酵酶培养基及培养条件。
枯草芽孢杆菌转基因应用产品有核苷类产品、核黄素、微生物制剂/益生菌和工业酶制剂。枯草芽孢杆菌转基因技术在基因工程这一领域里已经被研究的很成熟了,在质粒载体的选择和改进、转化方法的选择和优化及缺失型蛋白酶菌株的构建等方面研究已有很大突破,而且在工业化生产的实践应用中也取得了很显著的成绩。但还需更加深入的了解芽孢杆菌属的其它细菌及枯草芽孢杆菌的结构和功能,从而为枯草芽孢杆菌转基因研究提供更好的理论和研究基础。
[1]Mauriello E M,Duc le H,Isticato R,et al.Display of heterologous antigens on the Bacillus subtilis spore coat using CotC as a fusion partner[J].Vaccine,2004,22(9-10):1177-87.
[2]Abbasi-Hosseini S M,Eftekhar F,Yakhchaii B,et al.Cloning and enhanced expression of an extracellular alkaline protease from a soil isolate ofBacillusclausiiinBacillussubtilis[J].Iran J Biotechnol,2011,9(4):275-80.
[3]宋佳.乙醇发酵相关基因在芽孢杆菌中的表达及分析[D].哈尔滨:哈尔滨工业大学,2006.
[4]王远,高秋强,辛秀娟,等.β-葡萄糖苷酶基因和内切葡聚糖苷酶基因在枯草芽孢杆菌中的表达[J].应用与环境生物学报,2013,19(6):990-996.doi:10.3724/SP.J.1145.2013.00990.
[5]武彩霞.高Lys蛋白基因和高Met蛋白基因在枯草芽孢杆菌中的共表达[D].哈尔滨:东北农业大学,2013.
[6]王建彬.海藻糖合酶基因(AE015451.1)在枯草芽孢杆菌中的表达[D].济南:齐鲁工业大学,2013.
[7]Chen Y,Yan F,Chai Y,et al.Biocontrol of tomato wilt disease byBacillussubtilisisolated from natural environments depends on conserved genes mediating biofilm formation[J].Environ Microbiol,2013,15(3):848-64.
[8]王苇,秦瑶,李爽,等.枯草芽孢杆菌微生态制剂的研究进展[J].中国畜牧兽医,2013,40(11):217-220.
[9]岳敏杰.鸡干扰素α在枯草芽孢杆菌中的表达及活性检测[D].郑州:河南农业大学,2013.
[10]Belda E,Sekowska A,Le Fèvre F,et al.An updated metabolic view of theBacillussubtilis168 genome[J].Microbiol,2013,159(Pt4):757-70.
[11]栾超.利用SUMO融合技术在枯草芽孢杆菌中重组表达抗菌肽cathelicidin-BF及其生物学活性研究[D].杭州:浙江大学,2014.
[12]余小霞,田健,刘晓青,等.枯草芽孢杆菌表达系统及其启动子研究进展[J].生物技术通报,2015,(2):35-44.
[13]Denise K,Andre C,Kai O,et al.The xylA promoter ofBacillusmegateriummediates constitutive gene expression inEscherichiacoli[J].Eng Life Sci,2011,11(5):458-62.
[14]Liu S L,Du K.Enhanced expression of an endoglucanase inBacillussubtilisby using the sucrose-inducible sacB promoter and improved properties of the recombinant enzyme[J].Protein Expr Purif,2012,83(2):164-8.
[15]Lee S J,Pan J G,Park S H,et al.Development of stationary phase-specific autoinducible expression system inBacillussubtilis[J].J Biotechnol,2010,149(1-2):16-20.
[16]Belitsky B R,Barbieri G,Albertini A M,et al.Interactive regulation by theBacillussubtilisglobal regulators CodY and ScoC[J].Mol Microbiol, 2015,97(4):698-716.
[17]Yan J,Zou W,Fang J,et al.Eukaryote-like Ser/Thr protein kinase PrkA modulates sporulation via regulating the transcriptional factor σKinBacillussubtilis[J].Front Microbiol,2015,6:382.
[18] Phanaksri T,Luxananil P,Panyim S,et al.Synergism of regulatory elements in σB- and σa-dependent promoters enhances recombinant protein expression inBacillussubtilis[J].J Biosci Bioeng,2015,pii:S1389-1732(15)00069-9.
[19]Nguyen H D,Nguyen Q A,Ferreira R C,et al.Construction of plasmid-based expression vectors forBacillussubtilisexhibiting full structural stability[J].Plasmid,2005,54(3):241-8.
[20]陈大超.有机磷降解酶基因(opdA)在大肠杆菌与枯草芽孢杆菌中的表达与酶学研究[D].上海:上海海洋大学,2013.
[21]Phan T T,Tran L T,Schumann W,et al.Development of Pgrac100-based expression vectors allowing high protein production levels inBacillussubtilisand relatively low basal expression inEscherichiacoli[J]. Microb Cell Fact,2015,14:72.
[22]Ogawa T,Iwata T,Kaneko S,et al.An inducible recA expressionBacillussubtilisgenome vector for stable manipulation of large DNA fragments[J].BMC Genomics,2015,16:209.
[23]周伦.枯草芽孢杆菌转化体系的建立及应用[D].武汉:华中农业大学,2014.
[24]Zhang X Z,Zhang Y H P.Simple,fast and high-efficiency transformation system for directed evolution of cellulose inBacillussubtilis[J].Microbial Biotech,2011,4(1):98-105.
[25]Vojcic L,Despotovic D,Martinez R,et al.An efficient transformation method forBacillussubtilisDB104[J].Appl Microbiol Biotechnol,2012,94(2):487-93.
[26]Lu Y P,Zhang C,Lv F X,et al.Study on the electro-transformation conditions of improving transformation efficiency forBacillussubtilis[J].Lett Appl Microbiol,2012,55(1):9-14.
[27]Jeong H,Sim Y M,Park S H,et al.Complete genome sequence ofBacillussubtilisstrain ATCC 6051a,a potential host for high-level secretion of industrial enzymes[J].Genome Announc,2015,3(3).
[28]Kabisch J,Thürmer A,Hübel T,et al.Characterization and optimization ofBacillussubtilisATCC 6501 as an expression host[J].J Biotechnol,2013,163(2):97-104.
[29]Reuβ D R,Schuldes J,Daniel R,et al.Complete genome sequence ofBacillussubtilissubsp.Subtilisstrain 3NA[J].Genome Announc,2015,3(2).
[30]Yu C S,Yim K Y,Stephen K W T,et al.Complete genome sequence ofBacillussubtilisstrain QB928,a strain widly used inB.subtilisgenetic studies[J].J Bacteriol,2012,194(22):6308-6309.
[31] Zeigler D R.The genome sequence ofBacillussubtilissubsp.spizizeniiW23:Insights into speciation within theB.subtiliscomplex and into the history ofB.subtilisgenetics[J].Microbiology,2011,157(Pt7):2033-41.
[32]刘晖.纤维素酶基因枯草芽孢杆菌工程菌的构建及其酶学性质的初步研究[D].武汉:华中农业大学,2013.
[33]Kodama T,Endo K,Sawada K,et al.BacillussubtilisAprX involved in degradation of a heterologous protein during the late stationary growth phase[J].J Biosci Bioeng,2007,104(2):135-43.
[34]Rabbani M,Soleymani S,Sadeghi HM,et al.Inactivation of aprE Gene inBacillussubtilis168 by homologus recombination[J].Avicenna J Med Biotechnol,2014,6(3):185-9.
[35]Belitsky B R,Sonenshein A L.Roadblock repression of transcription byBacillussubtilisCodY[J].J Mol Biol,2011,411:729-43.
[36]Li R F,Wang B,Liu S,et al.Optimization of the expression conditions of CGA-N46 inBacillussubtilisDB1342(p-3N46) by response surface methodology[J].Interdiscip Sci,2015.
[37]Barbieri G,Voigt B,Albrect D,et al.CodY regulates expression of theBacillussubtilisextracellular proteases Vpr and Mpr[J].J Bacteriol,2015,197(8):1423-32.
[38]Farhat-Khemakhem A,Ben Farhat M,Boukhris I,et al.Heterologous expression and optimization using experimental designs allows highly efficient production of the PHY US417 phytase inBacillussubtilis168[J].AMB Express,2012,2(1):10-14.
[39]Guan Z B,Shui Y,Song C M,et al.Efficient secretory production of CotA-laccase and its application in the decolorization and detoxification of industrial textile wastewater[J].Environ Sci Pollut Res Int.2015,22(12):9515-23.
[40]He Q,Fu A Y,Li T J.Expression and one-step purification of the antimicrobial peptide cathelicidin-BF using the intein system inBacillussubtilis[J].J Ind Microbiol Biotechnol,2015,42(4):647-53.
[41]张漫莉,耿新伟,王梦婷,等.纤维素酶EGA基因在枯草芽孢杆菌中的表达及其产物性质研究[J].浙江理工大学学报,2013,30(3):389-393.
[42]李静静.高产α-乙酰乳酸脱羧酶重组枯草芽孢杆菌的构建及其发酵优化[D].无锡:江南大学,2013.
[责任编辑:李蓟龙]
河北北方学院青年基金项目(No.Q2014028)
武彩霞(1986-),女,山西大同阳高人,硕士,研究实习员。
Q 812
C
10.3969/j.issn.1673-1492.2015.05.030
来稿日期:2014-09-01
