通过抑制自噬作用增强声动力学疗法诱导的肿瘤细胞凋亡研究
2015-06-09冯晓兰王筱冰
冯晓兰 王 攀 王筱冰
(陕西师范大学生命科学学院,西安 710062)
引言
声动力学疗法(sonodynamic therapy,SDT)是在光动力学疗法(photodynamic therapy,PDT)的基础上,建立和发展起来的一种肿瘤治疗方法[1]。它主要是利用超声对生物组织有较强的穿透作用,且能聚焦于深层组织的肿瘤部位并激活肿瘤组织中特异性富集并长时间滞留的声敏剂,从而杀伤肿瘤细胞和抑制肿瘤组织生长。SDT抗肿瘤有较强的靶向性、安全性和广谱性,而且超声治疗装置简单,造价低廉。因此,SDT研究具有重要的理论意义和潜在的应用前景[2]。
SDT是抗癌研究另辟蹊径的新方法探索,涉及生物、医学、物理和化学诸多领域,目前国内外学者就其实验装置、理化参数、抗肿瘤机理等开展了多学科研究,并取得了一些令人欣慰的进展。尤其是低强度超声可以诱导细胞凋亡引起了国内外学者的关注。2000年,Ashush等首次报道了低强度超声可以诱导人白血病细胞HL-60、K562、U937和M1/2发生凋亡[3]。随后,又有学者对SDT诱导细胞凋亡及相关机制开展了研究[2,4]。本课题组在超声结合卟啉类声敏剂抗肿瘤研究中发现,SDT诱导细胞凋亡具有一定的普遍性,诱发不同肿瘤细胞凋亡的最低用药剂量和超声强度及辐照时间均有所不同,在同等处理条件下,不同细胞受诱导后表现出的凋亡比例和程度亦有差异[5-6]。
自噬是细胞死亡研究领域的新课题,有研究表明自噬既作为一种防御机制来抵御环境变化对细胞造成的损伤,同时也作为一种死亡程序诱导细胞主动性死亡,即II型程序性细胞死亡,它与I型程序性细胞死亡(细胞凋亡)之间有着密不可分的联系[7]。Kessel等在PDT处理L1210细胞研究中发现,PDT在诱导细胞凋亡的同时亦可以引发细胞自噬,但自噬在PDT介导的细胞死亡模式中的具体机制尚不清楚,其可能依赖于光敏剂类型及PDT剂量等[8]。大量研究工作已证实SDT可以诱导细胞凋亡或坏死[4-6],但关于SDT在杀伤肿瘤细胞的同时能否诱导细胞发生自噬方面的报道较少。本研究通过分析在超声结合原卟啉IX(protoporphyrin IX,PpIX)诱导S180细胞死亡过程中,是否存在自噬现象以及自噬在细胞存活中的作用,初步探讨了细胞自噬与细胞凋亡的关系,为SDT抗肿瘤的临床应用提供有价值的实验依据。
1 材料和方法
1.1 材料
1.1.1 细胞培养
S180肿瘤细胞培养于含10%胎牛血清、100 IU/mL 青霉素、100 μg/mL 链霉素、1 mM L-谷氨酰胺的RPMI 1640完全培养基中,在5%的CO2、37℃培养箱及饱和水蒸气条件下常规培养及传代,实验用细胞为对数生长期细胞。
1.1.2 试剂
原卟啉IX钠盐为Sigma公司产品,用去离子水避光溶解,浓度为5.0 mg/mL,过滤除菌,分装于Eppendof管中,-20℃避光保存。
噻唑蓝(MTT)、罗丹明 123(RHO123)、4',6-二脒基-2-苯基吲哚(DAPI)、吖啶橙(AO)、3-甲基腺嘌呤(3-MA)、z-VAD-fmk购自Sigma公司。巴伐洛霉素A1(Ba A1)为Millipore公司产品。LC3和actin抗体为Santa Cruz公司产品。
1.1.3 超声装置
超声换能器由陕西省超声学重点实验室研制,超声功率放大器为美国T&C公司产品(AG-1020)。流式细胞仪为 Millipore公司产品(guava easyCyte8HT),荧光显微成像系统为Nikon E600,酶标仪为Bio-Tek Elx800。
1.2 实验方法
1.2.1 细胞的收集及处理
无菌条件下收集S180培养细胞,调节细胞密度为1×106cells/mL,重悬在无血清的 RPMI1640培养液中。将细胞悬液均匀分装到一次性医用试管中,每管 1 mL,随机分为对照组(Control group,CT),单纯原卟啉 IX组(Protoporphyrin IX alone group,P),超声组(Ultrasound alone group,U),超声结合原卟啉IX组(Protoporphyrin IX combined with Ultrasound group,UP)。P和 UP组细胞加入 PpIX,使其终浓度为1 μg/mL,37℃培养箱中避光孵育45min,使PpIX在S180肿瘤细胞内含量达到最大;U和UP组样品在频率为1.1 MHz、功率为3 W/cm2的超声装置中分别处理60 s。声照处理后,各组细胞重悬到RPMI-1640完全培养基中继续孵育,不同时间点取材进行后续实验操作。
1.2.2 MTT检测细胞毒效应
处理后4 h,MTT法检测各实验组的细胞毒作用,对照组和各处理组细胞接种于96孔培养板中,每孔100 μL细胞悬液,每组6个复孔。将接种后的培养板置于37℃、5%CO2饱和湿度孵箱内培养不同时间,避光条件下每孔加入10 μL MTT母液(5 mg/mL),继续培养4 h后,每孔加入100 μL三联液,37℃孵育17 h,酶标仪检测570 nm处光吸收值(OD值),计算各组细胞相对存活率。细胞相对存活率=(实验组OD/对照组OD)×100%。
1.2.3 线粒体膜电位(MMP)检测
RHO 123能够选择性进入细胞并滞留在膜电位完整的线粒体中,RHO123的荧光强度与线粒体膜电位变化呈正相关。SDT处理后1 h,不同处理组细胞与2 μg/mL的RHO 123在37℃避光孵育20 min后,PBS漂洗3次,然后重悬到Hanks溶液中进行流式细胞仪检测RHO 123的荧光强度(激发波长为488 nm,发射波长为530 nm)。同时,取部分细胞悬液,滴片,荧光显微镜观察,同时采集RHO 123荧光图像和相差图像。
1.2.4 DAPI染色
DAPI是一种DNA结合染料,能够反映细胞核的形态变化。SDT处理后8 h,收集各组细胞,加入终浓度为 4 μg/mL 的 DAPI,室温染色30 min,PBS洗3次,荧光显微镜观察并照相。
1.2.5 吖啶橙染色
吖啶橙是一种荧光染料,其发出的荧光会随着细胞内的pH值变化而变化,利用吖啶橙活细胞染色能够检测细胞自噬现象[9]。在吖啶橙染色的细胞中,胞浆和核仁发亮绿色和暗红色荧光,而酸性细胞器发亮红色荧光,红色荧光的强度与酸性细胞器的酸度和容积成正相关。因此,酸性的自噬泡被吖啶橙染色后可以在荧光显微镜下观察到点状红色斑点。SDT处理后1 h,细胞悬液中加入1 mg/mL的吖啶橙,37℃避光反应20 min,弃染液,荧光显微镜观察并照相。
1.2.6 Western blotting
检测自噬相关蛋白LC3-Ⅰ到LC3-Ⅱ的转化。LC3(微管相关蛋白Ⅰ的轻链3)有两种类型,在自噬发生过程中,LC3由Ⅰ型(18 kDa)向Ⅱ型(16 kDa)转化,LC3-II含量的多少通常用来反映自噬活性的高低。SDT处理后0.5 h,离心收集各组细胞悬液,用100 μL RIPA裂解液冰上裂解1 h,BCA法进行蛋白定量,常规电泳、转膜和封闭后,加LC3抗体(1∶400)并4℃孵育过夜,二抗(1∶5000)室温孵育1 h,X胶片曝光显影,以Actin蛋白为内参。
1.2.7 抑制剂实验
细胞自噬检测中常用3-甲基腺嘌呤(磷脂酰肌醇3激酶的抑制剂,3-MA)特异性抑制自噬体形成;巴伐洛霉素A1(Ba A1)特异性抑制自噬体与溶酶体的融合;细胞凋亡中通常采用Caspase广谱型抑制剂z-VAD-fmk抑制细胞凋亡。实验通过加入自噬抑制剂检测SDT处理后对肿瘤细胞凋亡的影响;同时,加入凋亡抑制剂观察对细胞自噬的影响;初步分析凋亡和自噬应答SDT作用的上下游关系和内在联系。
1.2.8 数据分析
实验结果均表示为平均值±SD(标准差),利用Excel软件对实验数据进行统计学分析,采用单因素方差分析进行显著性检验,P<0.05视为有显著性差异。
2 结果
2.1 MTT检测细胞存活率
图1为MTT检测各组细胞存活率实验结果,从图中可以看出,与对照组相比,单纯PpIX组(1 μg/mL)无明显细胞毒作用(P>0.05),单纯超声组显示出一定的细胞毒作用(P<0.05),其细胞存活率为84.3%,二者联合处理后进一步降低了细胞的存活率,其存活率为59.3%(P<0.01)。

图1 不同处理组细胞存活率检测(*与对照组相比P<0.05,**与对照组相比P<0.01;△△与PpⅨ组相比P<0.01;#与超声组相比P <0.05)Fig.1 Detection of cell survival rate after different treatment(*compared with control,P<0.05;**compared with control,P < 0.01;△△compared with PpⅨ,P <0.01;#compared with ultrasound,P <0.05)
2.2 SDT诱导细胞凋亡检测
采用DAPI染色观察不同处理后4 h时S180肿瘤细胞的细胞核变化情况。从图2可以看出CT组细胞核大多数呈圆球形,DAPI蓝色荧光呈均匀弥散分布;单纯PpIX组与对照组细胞相比,差异不明显;单纯超声组处理后,个别细胞的DAPI荧光染色有所增强;而在超声联合PpⅨ组中,细胞核蓝色荧光增强的细胞数目进一步增多,部分细胞出现核固缩、染色质凝集等现象,呈现出细胞凋亡样形态学变化特征。
2.3 SDT处理后线粒体膜电位(MMP)检测
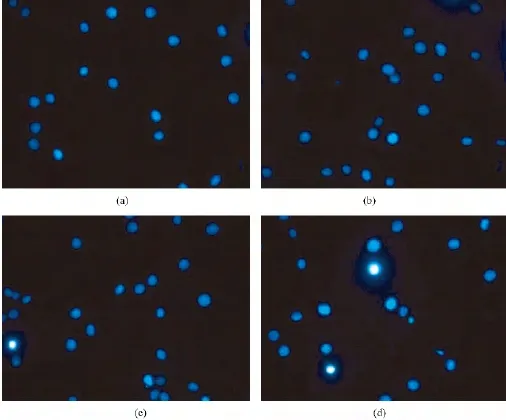
图2 DAPI染色观察不同处理组细胞核损伤。(a)对照组;(b)PpIX组;(c)超声组;(d):超声联合PpⅨ组Fig.2 DAPI staining observed the nucleus damage after different treatment.(a)Control;(b)PpⅨ;(c)Ultrasound;(d)Ultrasound plus PpⅨ
图3主要显示各处理组细胞的线粒体膜电位变化情况。从图中可以看出,对照组细胞中RHO123的平均荧光强度(MFI)为1 309.31;单纯PpⅨ组的MFI为1 215.55(P>0.05);单纯超声组的MFI为1 090.24,与对照组相比,其 MMP明显降低(P<0.05);超声联合 PpⅨ组的 MFI降至971.28,而且与以上3组相比,均有显著性差异(P<0.05)。
2.4 SDT诱导细胞自噬检测
在自噬发生过程中,自噬相关蛋白LC-I到LC3-II的转化与自噬体的形成正相关。图4显示了Western Blotting检测各组细胞处理后LC-I和LC3-II蛋白含量变化,从图中可以看出,单纯PpIX组与对照组的LC3-II条带无明显差异,单纯超声处理组LC-II条带明显加深,与单纯超声组相比,超声联合PpⅨ组LC-II表达进一步增强,提示自噬参与了SDT诱导的S180细胞应答。
2.5 自噬和凋亡抑制剂对SDT诱导的细胞凋亡的变化

图3 不同处理组S180细胞线粒体膜电位变化。(*与对照组相比P<0.05,**与对照组相比P<0.01;△△与PpⅨ组相比P<0.01;#与超声组相比P<0.05)Fig.3 Mitochondrialmembranepotential change after different treatment(*compared with control, P < 0.05;** compared with control,P <0.01;△△ compared with PpⅨ,P<0.01;#compared with ultrasound,P <0.05).
图5为Via-count检测各组细胞存活率与死亡率的实验结果,从图中可以看出,与对照组相比,超声联合PpⅨ组显示了明显的细胞存活降低(60.75%,P<0.01)和细胞损伤的增加(39.25%,P<0.01)。而在超声联合PpⅨ处理前用3-MA预处理组,S180细胞存活明显下降(37.33%,P<0.01),同时损伤的细胞明显增多(62.67%,P<0.01)。同样,在超声联合PpⅨ处理前用Ba A1预处理组,S180细胞存活下降至45.33%(P<0.01),同时损伤的细胞明显增多至54.67%(P<0.01)。两组结果均显示相比于UP,加入自噬抑制剂Ba A1(0.1 μM)和3-MA后,S180有更为明显的细胞受损现象的发生。

图4 Western blot检测S180细胞中LC3-I向LC3-II的转化。(a)对照组;(b)PpIX组;(c)超声组;(d):超声联合PpⅨ组Fig.4 Western blot detected the conversion of LC3-I to LC3-II of S180 cells. (a)Control;(b)PpⅨ;(c)Ultrasound;(d)Ultrasound plus PpⅨ
2.6 自噬和凋亡抑制剂对SDT诱导细胞自噬小泡形成的影响
吖啶橙可以自由穿透细胞膜并聚集在酸性成分内,呈现出红色荧光,通常可以用来检测酸性小泡的形成[9]。从图6可以看出,处理后1 h,与对照组相比,超声联合PpⅨ组细胞内吖啶橙红色荧光显著增强,且这一现象可以被自噬抑制剂Ba A1(0.1 μM)和 3-MA(1.0 mM)所抑制。而细胞凋亡Caspase广谱型抑制剂z-VAD(5 μM)对细胞内酸性自噬小泡的形成影响不明显。同时,抑制剂在所选浓度范围内不会对对照组细胞造成明显损伤。
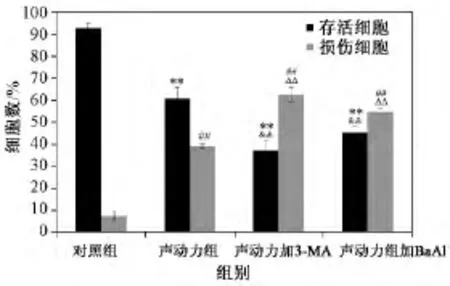
图5 Via-count检测不同处理组S180细胞存活率及死亡率变化(**与对照组相比存活的细胞数P<0.01;##与对照组相比死亡的细胞数P<0.01;δδ与声动力组相比存活的细胞数;△△与声动力组相比死亡的细胞数P<0.01)Fig.5 Viability of S180 cells as assessed by the Guava Viacount after ultrasound combined with 1 μg/mL PpIX(** Viable cells compared with control,P <0.01;##Damage cells compared with control,P<0.01;δδViable cells compared with SDT,P <0.01;△△Damaged cells compared with SDT,P <0.01)
2.7 自噬和凋亡抑制剂对SDT诱导细胞自噬蛋白LC3表达的影响

图6 吖啶橙活体细胞染色检测处理后S180细胞胞浆自噬小泡(上为对照组,下为声动力组)。(a)未加抑制剂;(b)3-甲基腺嘌呤;(c)巴伐洛霉素A1;(d)Caspase广谱型抑制剂Fig.6 Acridine orange staining detected autophagy vesicles of living cell S180 after different treatment(The upper line is control,the bottom line is with sonodynamic therapy).(a)No inhibitor;(b)3-MA;(c)Ba A1;(d)z-VAD-fmk
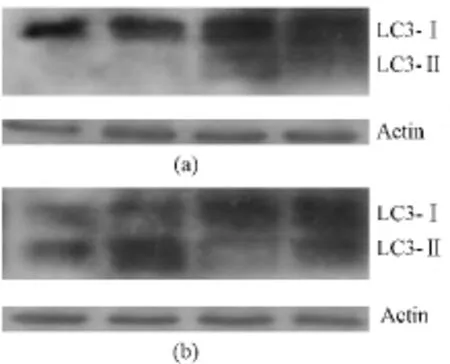
图7 Western blotting检测不同抑制剂对LC3蛋白表达影响(蛋白条带从左至右:未加抑制剂组,3-甲基腺嘌呤组,巴伐洛霉素A1组,Caspase广谱型抑制剂组)。(a)对照组;(b)声动力组Fig.7 Western blotting test of different inhibitors on LC3 protein expression(The protein band(from left to right)are no inhibitor,3-MA,Ba A1,z-VAD-fmk).(a)Control group;(b)SDT treatment group
图7显示,超声联合PpⅨ处理后1 h,LC3-II蛋白条带可以被3-MA有效抑制,但不会被Ba A1所抑制;相反,无论是对照组还是UP处理组,Ba A1稍微增加了LC3-II蛋白表达,这一结果可能与Ba A1阻止了自噬体和溶酶体的融合,导致胞浆内大量自噬体积聚有关[10]。然而,Caspase抑制剂z-VAD并没有明显改变LC3-II的表达水平。
2.8 自噬和凋亡的抑制剂对SDT诱导S180细胞线粒体膜电位变化的影响
图8显示,超声联合PpⅨ处理后1 h,自噬抑制剂3-MA和Ba A1均增强了UP引发的线粒体膜电位下降。UP和UP+3-MA处理组细胞形态严重变形,线粒体RHO123荧光染色下降。在UP+Ba A1处理组中,线粒体RHO123荧光染色下降,细胞膜表面出现泡状突起,呈现细胞凋亡样结构特征。UP+z-VAD处理组与单独UP处理组相比,细胞内线粒体水平变化不明显,提示线粒体膜电位下降可能是Caspase活化的上游事件。
2.9 自噬和凋亡的抑制剂对SDT诱导细胞凋亡的影响
超声联合PpⅨ处理后8 h,采用DAPI染色观察不同处理组细胞核形态变化。图9显示相差显微镜和DAPI荧光染色结果:对照组细胞形态结构完整,DAPI蓝色荧光呈均匀弥散分布。超声联合PpⅨ组细胞DAPI染色增强且细胞形态严重变形。超声联合PpⅨ处理前用3-MA预处理组,S180细胞形态极度形变,同时展示缩小或变大的细胞核。超声联合PpⅨ前用Ba A1预处理组,有更多的细胞显示凋亡细胞核变化特征并伴随有染色质凝集成半月形出现。超声联合PpⅨ前用z-VAD预处理能部分抑制凋亡细胞核典型特征的出现。
3 讨论和结论
细胞自噬是细胞胞浆和细胞器被双层膜包被的自噬小体吞噬,并由自噬溶酶体降解消化的过程[11]。自噬的主要作用是应付饥饿或环境刺激以保护细胞生存。但最近的研究表明,自噬在一定条件下被激活可以促进细胞死亡[12]。许多研究还证明细胞自噬和凋亡之间存在相互作用[7,13]。然而,细胞自噬究竟是促进细胞生存还是死亡,目前还没有一致的结论,因为不同学者在不同实验条件下得到的结果不同。自噬作为细胞抗癌研究领域的新课题,已成为不同抗癌疗法研究细胞应答的热点[14]。

图8 荧光显微镜观察自噬和凋亡抑制剂对SDT处理后S180细胞线粒体膜电位变化(上为罗丹明123荧光图像,下为相差图像。图片中箭头所指细胞的放大图见该图的右上角)。(a):对照组;(b):声动力组;(c):声动力加3-甲基腺嘌呤;(d):声动力加巴伐洛霉素A1;(e)声动力加Caspase广谱型抑制剂Fig.8 Fluorescence microscopy observed mitochondrial membrane potential changed after SDT treatment through adding autophagy and apoptosis inhibitor(The upper line is Rho 123,the bottom line is phase.The cell in the upper right corner of a image is the magnified one indicated by a arrow in the same image).(a)Control;(b)Sonodynamic therapy;(c)SDT+3-MA;(d)SDT+Ba A1;(e)SDT+z-VAD-fmk.

图9 荧光显微镜观察自噬和凋亡抑制剂对SDT处理后S180细胞DAPI染色结果(上为DAPI荧光图像,下为相差图像。图片中箭头所指细胞的放大图见该图的右上角)。(a):对照组;(b):声动力组;(c):声动力加3-甲基腺嘌呤;(d):声动力加巴伐洛霉素A1;(e):声动力加Caspase广谱型抑制剂。Fig.9 Fluorescence microscopy observed DAPI staining results after SDT treatment through adding autophagy and apoptosis inhibitor(The upper line is Rho 123,the bottom line is phase.The cell in the upper right corner of a image is the magnified one indicated by a arrow in the same image).(a):Control;(b):Sonodynamic therapy;(c)SDT+3-MA;(d)SDT+Ba A1;(e)SDT+z-VAD-fmk.
本研究主要探讨频率为1.1 MHz、输出功率为3 W/cm2的超声,联合1 μg/mL PpⅨ作用于 S180肿瘤细胞后细胞的应答效应。MTT实验结果显示在此SDT参数下,单纯PpIX无明显细胞毒效应,单纯超声产生一定的细胞毒性作用,而两者的协同作用产生明显抗肿瘤效应,使细胞存活率下降了近40%。细胞凋亡是抗肿瘤研究中有效的细胞死亡方式之一。其中,线粒体在细胞凋亡中发挥重要作用,线粒体膜电位下降被认为是细胞凋亡早期的一个标志性事件。声敏剂PpIX在肿瘤细胞主要分布于线粒体[5],本研究结果显示SDT处理后,细胞的凋亡特征如线粒体膜电位下降、染色质凝集、膜起泡等现象非常明显,提示 PpIX-SDT可能诱导了S180细胞线粒体依赖性凋亡途径的发生。在自噬发生过程中,LC3Ⅱ型通过LC3Ⅰ型的转化而增加,可作为自噬发生的一个半定量方法[11]。Western blotting检测SDT处理后4 h,与CT组比较,UP组LC3Ⅰ向LC3Ⅱ的转化显著增加,提示自噬亦可能参与了SDT诱导的S180细胞应答效应。
以上研究结果提示,PpIX-SDT处理可以诱导S180细胞发生凋亡和自噬。细胞自噬与凋亡的相互作用已被很多研究证实,它们具有相同的作用分子,也可以同时存在于同一个细胞中[11]。本研究利用自噬和凋亡的抑制剂研究自噬在SDT诱导肿瘤细胞死亡中的作用。首先,通过加入两种自噬抑制剂3-MA和Ba A1,检测了S180细胞经SDT处理后细胞的存活和损伤情况。BaA1作为H+-ATPase的抑制剂,它通过阻止自噬体和溶酶体的融合将细胞自噬阻止在晚期阶段[10]。Via-count结果显示BaA1能够有效地加剧SDT处理后的S180细胞的损伤。同样加入3-MA后(PI3K的抑制剂,可通过抑制自噬体的形成将细胞自噬阻止在早期阶段),细胞存活急剧下降,伴随着细胞损伤明显增加,说明了抑制细胞自噬后,细胞受到了更为严重的损伤,这可能是通过抑制自噬作用增强了SDT诱导的S180肿瘤细胞发生了凋亡。随后通过吖啶橙活细胞染色观察自噬体的形成,结果表明SDT处理组S180细胞胞浆内出现大量AVOs,且这一现象可以被Ba A1抑制。但实验中发现Ba A1并不能阻止LC3的剪切,相反,却轻微增加了LC3-II水平。3-MA通过抑制自噬体的形成将细胞自噬阻止在早期阶段,可以明显降低LC3-II蛋白条带。凋亡抑制剂z-VAD对吖啶橙AVOs染色和LC3剪切均没有明显影响。研究提示在本实验SDT参数下处理S180细胞所诱导的自噬体的形成,可能是其引发细胞凋亡的上游事件。为研究自噬在SDT应答效应中的作用,实验进一步检测了线粒体膜电位变化和染色质凝集等,结果表明早在SDT作用后1 h,自噬抑制剂就增强了SDT对线粒体膜电位的损伤;同时,Caspase抑制剂不能抑制线粒体膜电位变化水平,提示线粒体膜电位的下降有可能发生在Caspase上游或者不依赖于Caspase的活化。
总之,本研究结果表明,自噬可能参与了SDT诱导的S180细胞死亡,且自噬特异性抑制剂可以抑制自噬体的形成,从而增强SDT诱导的细胞凋亡。此研究结果丰富了SDT诱导细胞的死亡模式,并且为如何通过干预细胞自噬活性增强SDT抗肿瘤疗效提供有价值的实验设想。
[1]Yumita N,Nishigaki R,Umemura K,et al.Hematoporphyrin as a sensitizer of cell-damaging effect of ultrasound[J].Jpn J Cancer Res,1989,80(3):219 -222.
[2]Bai WK,Shen E,Hu B.The induction of the apoptosis of cancer cell by sonodynamic therapy:a review [J].Chin J Cancer Res,2012,24(4):368-373.
[3]Ashush H,Rozenszajn LA,Blass M,et al.Apoptosis induction of human myeloid leukemic cells by ultrasound exposure[J].Cancer Res,2000,60(4):1014 -1020.
[4]Tachibana K,JR Feril LB,Ikeda-dantsuji Y.Sonodynamic therapy[J].Ultrasonics,2008,48(4):253 -259.
[5]Wang XB,Liu QH,Mi N,et al.Sonodynamically induced apoptosis by protoporphyrin IX on hepatoma-22 cells in vitro[J].Ultrasound Med Biol,2010,36(4):667 -676.
[6]张静,汤薇,王攀,等.线粒体凋亡通路在声动力学疗法诱导肿瘤细胞凋亡中的作用[J].中国超声医学杂志,2010,26(2):113-116.
[7]Boya P,Gonzalez-polo RA,Casares N,et al.Inhibition of macroautophagy triggers apoptosis[J].Mol Cell Biol,2005,25(3):1025-1040.
[8]Kessel D,Vicente MG,JR Reiners JJ.Initiation of apoptosis and autophagy by photodynamic therapy[J].Autophagy,2006,2(4):289-290.
[9]Paglin S,Hollister T,Delohery T,et al.A novel response of cancer cells to radiation involves autophagy and formation of acidic vesicles[J].Cancer Res,2001,61(2):439 -444.
[10]Yamamoto A,Tagawa Y,Yoshimori T,et al.Bafilomycin A1 prevents maturation of autophagic vacuoles by inhibiting fusion between autophagosomes and lysosomes in rat hepatoma cell line,H-4-II-E cells[J].Cell Struct Funct,1998,23(1):33 -42.
[11]Klionsky DJ,Emr SD.Autophagy as a regulated pathway of cellular degradation[J].Science,2000,290(5497):1717 -1721.
[12]Tasdemir E,Galluzzi L,Maiuri MC,et al.Methods for assessing autophagy and autophagic cell death [J].Methods Mol Biol,2008,445:29-76.
[13]Maiuri M C,Zalckvar E,Kimchi A,et al.Self-eating and selfkilling:crosstalk between autophagy and apoptosis[J].Nat Rev Mol Cell Biol,2007,8(9):741-52.
[14]Kondo Y,Kanzawa T,Sawaya R,et al.The role of autophagy in cancer development and response to therapy[J].Nat Rev Cancer,2005,5(9):726 -734.
