多糖及多糖衍生物/泊洛沙姆温敏水凝胶的制备及其性能研究*
2015-06-09胡亦清赖欣宜罗嘉浩曾春莲傅超萍冯子乐曲海洪章戴荣康贤通张黎明杨立群
胡亦清,赖欣宜,罗嘉浩,龙 茜,曾春莲, 傅超萍,冯子乐, 曲海洪,章戴荣,康贤通,张黎明,杨立群
(1.中山大学化学与化学工程学院∥聚合物复合材料及功能材料教育部重点实验室∥新型聚合物材料设计合成与应用广东省普遍高校重点实验室∥广东省高性能树脂基复合材料重点实验室,广东 广州 510275;2. 广州市亿福迪医疗器械有限公司,广东 广州501670)
多糖及多糖衍生物/泊洛沙姆温敏水凝胶的制备及其性能研究*
胡亦清1,赖欣宜1,罗嘉浩1,龙 茜1,曾春莲1, 傅超萍1,冯子乐1, 曲海洪2,章戴荣2,康贤通2,张黎明1,杨立群1
(1.中山大学化学与化学工程学院∥聚合物复合材料及功能材料教育部重点实验室∥新型聚合物材料设计合成与应用广东省普遍高校重点实验室∥广东省高性能树脂基复合材料重点实验室,广东 广州 510275;2. 广州市亿福迪医疗器械有限公司,广东 广州501670)
为了改善泊洛沙姆温敏水凝胶的性能,用5种不同化学结构的多糖及多糖衍生物与泊洛沙姆制备温敏水凝胶,研究这些多糖的化学结构对水凝胶性能的影响。结果表明多糖及多糖衍生物与泊洛沙姆在接近体温(34~37 ℃)时形成水凝胶,有利于实现可注射使用的目的。两亲性多糖衍生物/泊洛沙姆温敏水凝胶的稳定性更高,体现出更强的剪切变稀性质,缓释疏水性药物—强的松的时间更长,这些性质可能与两亲性海藻酸钠衍生物和两亲性壳聚糖衍生物与泊洛沙姆之间存在疏水相互作用力有关。5种温敏水凝胶体均表现出促进成骨细胞增殖生长的性能,在骨关节组织具有一定的应用前景。
多糖;多糖衍生物;泊洛沙姆;温敏水凝胶;强的松
水凝胶是一种三维立体、以化学键或物理交联作用形成的亲水性聚合物网络,它既有液体的运动性和流动性,又具有固体的形稳性[1]。一些药物分子能与亲水性聚合物共同形成水凝胶,起到缓释药物的作用[1-2]。由于多糖来源于自然界,安全无毒,具有非常好的生物相容性和降解性,因此,以多糖为基质的水凝胶备受关注[2-3]。近年来在注射给药系统以及组织工程等领域,一些具有温度敏感性的水凝胶(温敏水凝胶)引起人们的广泛研究[4-5],它在室温下为具有良好流动性的液体,而当温度升高至接近体温时则转变为水凝胶,这些特性使得温敏水凝胶在实现可注射使用方面具有较好应用前景。
泊洛沙姆(Poloxamers)是一种聚氧乙烯-聚氧丙烯-聚氧乙烯(PEO-PPO-PEO)三嵌段共聚物(图1a),由于PPO、PEO嵌段比例及不同相对分子质量的不同,目前研究较多的是泊洛沙姆407和泊洛沙姆188[6]。泊洛沙姆的特性是[6-7]:①水溶性良好,毒性低;②具有反向可逆热胶凝性质,即低温(4~10 ℃)时为液体,当温度升高至室温或体温时形成水凝胶,温度降低时又转变成可流动液体状;③独特的疏水内核-亲水外壳结构使泊洛沙姆通过疏水相互作用可用于包裹疏水性药物。所以,泊洛沙姆温敏水凝胶被广泛用于黏膜给药、经皮给药和注射给药系统,不仅给药方便,且能实现缓释药物,提高药物生物利用度[6-8]。然而,泊洛沙姆在实际应用中也存在一些问题,例如泊洛沙姆407对浓度有很大的依赖性,其浓度为15.0%~30.0%时,在15~45 ℃可形成半固体水凝胶,但随着浓度升高,胶凝化温度下降,这就使泊洛沙姆407的应用受到了一定限制[7,9]。
针对上述问题,本工作使用不同化学结构的多糖及多糖衍生物(图1b-1f)与泊洛沙姆制备温敏水凝胶,研究这些多糖的化学结构对水凝胶性能的影响,包括凝胶化温度和时间、水凝胶的稳定性和剪切变稀行为、缓释药物的性能以及对成骨细胞生长的影响。
1 实验部分
1.1 主要原料及试剂
泊洛沙姆407(P407,德国BASF公司), 泊洛沙姆188(P188,德国BASF公司), 强的松(Prednisone,纯度98%,阿拉丁试剂上海有限公司), 海藻酸钠(AR,广州化学试剂厂),普鲁兰多糖(上海晶纯生化科技股份有限公司),羧甲基壳聚糖(AR,广州化学试剂厂)。其它试剂均为化学纯。
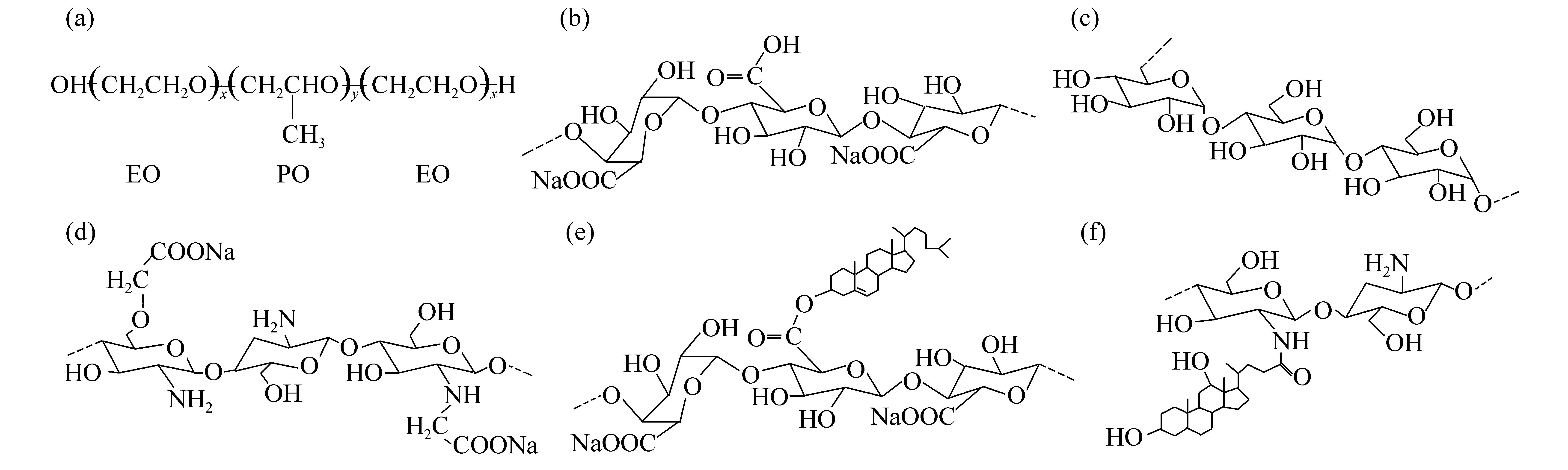
图1 泊洛沙姆、多糖及其衍生物的化学结构Fig.1 Chemical structures of poloxamer, polysaccharides and their derivatives(a) 泊洛沙姆; (b) 海藻酸钠; (c) 普鲁兰; (d) 羧甲基壳聚糖; (e) 两亲性海藻酸钠衍生物; (f) 两亲性壳聚糖衍生物
1.2 两亲性海藻酸钠生衍物的合成
参考我们以前的工作[10-12],准确称取1.00 g海藻酸溶于35 mL无水二甲亚砜(DMSO)中,称取0.40 g胆固醇溶于2 mL氯仿,称取0.24 gN,N’-二环己基碳二亚胺和0.14 g 的4-(N,N’-二甲胺基)吡啶溶于15 mL无水 DMSO中,将该两种溶液分别缓慢滴加至上述海藻酸溶液中,于室温反应24 h。反应结束后,滴加5倍体积无水乙醇,离心弃去上清液,沉淀用热乙醇洗涤3次,加入蒸馏水搅拌溶解,用NaHCO3溶液(w=4%)中和,透析3d,冷冻干燥24h后得到产物,命名为CSAD。
1.3 两亲性壳聚糖衍生物的合成
参考以前的工作[12-14], 准确称取1.00g的壳聚糖溶于40mL乙酸(φ=1%),滴加4 6mL无水乙醇。称取0.85g脱氧胆酸溶于8mL无水乙醇,称取0.60g二亚胺盐酸盐溶于6mL无水乙醇,将该两种溶液分别缓慢滴加至上述壳聚糖溶液中,于室温反应24h。反应结束后,用乙醇/氨水混合溶液(V(乙醇)/V(氨水)=7/3)调节反应体系的pH值至中性,滴加5倍体积无水乙醇,离心弃去上清液,沉淀用乙醇洗涤3次,加入蒸馏水搅拌溶解,透析3 d,冷冻干燥24 h后得到产物,命名为DA-Chit。
1.4 多糖及其衍生物/泊洛沙姆温敏水凝胶的制备及其流变性能测试
1.4.1 多糖及其衍生物/泊洛沙姆温敏水凝胶的制备 称取15~90 mg多糖或多糖衍生物置于血清瓶中,加入1 mL PBS缓冲溶液(pH=7.0),室温搅拌溶解24 h。称取泊洛沙姆(100~300 mg P407和30~60 mg P188)加入上述多糖衍生物多糖或多糖溶液(ρ为15~90mg/mL,V为1~3 mL),4 ℃搅拌溶解24 h,将装有多糖及多糖衍生物/泊洛沙姆混合液的血清瓶置于水浴中,缓慢加热升温,采用倒置瓶颈法判断测定凝胶化温度和凝胶化时间。
1.4.2 流变性能 动态应变扫描:将水凝胶样品平铺在行板之间,调节板间距为1.0 mm,固定应变为0.5%,固定频率为1.0 rad/s,温度为凝胶化温度,应变范围0.1%~100%,测定储能模量(G′)和损耗模量(G″)随应变变化的曲线。
稳态剪切黏度测定:将样品水凝胶平铺在行板之间,板直径为25 mm,调节板间距为1.0 mm,固定应变为0.5%,测试温度为37 ℃,测试频率范围由0.1 rad/s向100 rad/s变换过程中,测定表观黏度与频率的关系图线。
1.5 制备负载药物的多糖及其衍生物/泊洛沙姆温敏水凝胶及其药物释放行为
1.5.1 制备负载药物的多糖及其衍生物/泊洛沙姆温敏水凝胶 参照1.4.1制备多糖及其衍生物/泊洛沙姆混合体系,缓慢滴加入4 mL强的松/四氢呋喃溶液(m(强的松)/V(四氢呋喃)=1/1),4 ℃搅拌溶解24 h,将体系置于50 ℃水浴装置中,搅拌约24 h,挥发四氢呋喃,制得负载药物的多糖及其衍生物/泊洛沙姆温敏水凝胶。载药量定义为强的松与多糖及其衍生物/泊洛沙姆质量的百分比。
1.5.2 药物释放行为 强的松工作曲线的制定:以φ=10%DMSO/PBS(pH7.4)混合溶液为溶剂,配制一系列不同的强的松溶液,通过UV-vis光谱法制定强的松的工作曲线为公式(1)所示,检测波长为243nm,仪器为紫外可见/近红外分光光度计(PE-Lambda750;PerkinElmer,Massachusetts,Waltham,U.S.A) 。
A=0.065+52.95ρ(R2=0.999)
(1)
式中,A为强的松在波长为243 nm处的吸光度,ρ为强的松的质量浓度(mg/mL)。
药物释放行为:25 ℃量取1mL上述各种载药多糖及其衍生物/泊洛沙姆混合溶液,装入透析袋(截流相对分子质量为8 000~14 400),于37 ℃形成水凝胶后置于400mLDMSO/PBS(pH7.4)溶液(φ=10%),与不同的时间间隔点移取2mL透析袋外的溶液,同时补加相同体积的溶液。将取出的溶液通过UV-vis光谱法测定其在波长为243nm的吸光度,通过公式(1)计算溶液中强的松浓度,通过公式(2)计算其强的松的累积释放率
(2)
式中,mt为t时刻溶液释放出的药物质量,m为负载的药物总质量。
1.6 多糖及其衍生物/泊洛沙姆温敏水凝胶对成骨细胞生物学性能的影响

2 结果与讨论
2.1 多糖及其衍生物/泊洛沙姆温敏水凝胶的制备及其性能
2.1.1 多糖及其衍生物/泊洛沙姆水凝胶的制备及其温敏性 为了改善泊洛沙姆对浓度的依赖性(即随着浓度升高胶凝化温度下降),本工作在泊洛沙姆中加入了海藻酸钠、普鲁兰、羧甲基壳聚糖、两亲性海藻酸钠衍生物以及两亲性壳聚糖衍生物。通过倒置瓶颈法测试发现,由于这些多糖及其衍生物的加入,使得泊洛沙姆混合体系的凝胶化温度控制在34~37 ℃(见表1),接近体温,有利于实现可注射使用的目的。
从图1a中可看出泊洛沙姆为含有羟基的线性链高分子,而海藻酸钠、普鲁兰和羧甲基壳聚糖中含有羟基、羧酸基团以及氨基(图1:b-d),所以,在凝胶化温度下,泊洛沙姆与这些多糖可能通过氢键、静电相互作用以及范德华力等分子间相互作用形成水凝胶。值得注意的是,两亲性海藻酸钠衍生物和两亲性壳聚糖衍生物除含有上述多糖的基团外,还含有疏水性胆固醇基团和脱氧胆酸基团(图1:e-f)。在凝胶化温度下,两亲性多糖衍生物/泊洛沙姆体系的凝胶化时间均比多糖/泊洛沙姆体系的短,这可能是由于两亲性多糖衍生物的疏水基团与波洛沙姆的疏水链段存在疏水相互作用力,使得发生凝胶化的时间缩短。

表1 多糖及其衍生物/泊洛沙姆温敏水凝胶的性能比较
1)A:海藻酸钠/泊洛沙姆,B:普鲁兰/泊洛沙姆,C:羧甲基壳聚糖/泊洛沙姆,D:CSAD/泊洛沙姆,E:DA-Chit/泊洛沙姆;
2)倒置瓶颈法测定;
3)倒置瓶颈法测定,指凝胶化温度下测定的凝胶化时间
2.1.2 多糖及其衍生物/泊洛沙姆温敏水凝胶的粘弹性及稳定性 图2为凝胶化温度附近的动态应变扫描曲线,由图2可见,当应变分别低于17%和6%时CSAD/泊洛沙姆和海藻酸钠/泊洛沙姆体系的G'均高于G″,即弹性模量大于粘流模量,表现出水凝胶的特性。
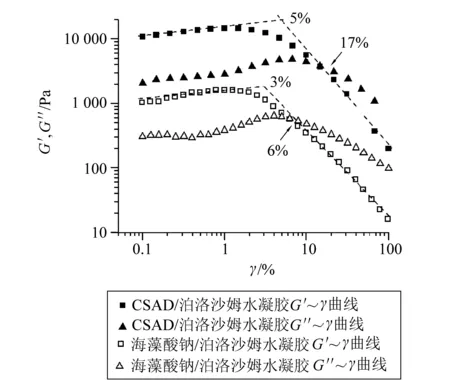
图2 水凝胶的动态应变扫描曲线(37 ℃)Fig.2 Oscillatory frequency sweep curves
根据文献报道[15-16],水凝胶的G'数值在一定应变范围保持恒定,当应变增加至某一数值时,G'开始下降,此时的屈服应变即为临界应变,被认为是水凝胶内部最微弱键开始断裂的临界应变点。这一特殊性质反应了水凝胶的脆性(即水凝胶的稳定性)。图2显示,CSAD/泊洛沙姆和海藻酸钠/泊洛沙姆水凝胶的临界应变分别为5%和3%,表明此时水凝胶的结构被破坏,并且CSAD /泊洛沙姆水凝胶稳定性更好。这可能是因为两亲性海藻酸钠衍生物的疏水基团(胆固醇基团)能与泊洛沙姆形成疏水相互作用,使得它们形成的水凝胶更加稳定,水凝胶结构更难被破坏。
从图3可看出,两种两亲性多糖衍生物/泊洛沙姆水凝胶在37 ℃分别静置2 d和4 d后均能保持均一的体系(未出现相分离现象)。但是,其它3种水凝胶静置不同时间后均出现了不同程度的相分离。这些结果进一步证明两亲性多糖衍生物/泊洛沙姆水凝胶具有更好的稳定性。

图3 温敏水凝胶37 ℃静置2 d(a)和4 d(b)Fig.3 Different sensitive hydrogels kept at 37 ℃ for two days (a) and four days (b)A:CSAD/泊洛沙姆水凝胶;B:DA-Chit/泊洛沙姆水凝胶;C:普鲁兰/泊洛沙姆水凝胶;D:羧甲基壳聚糖/泊洛沙姆水凝胶;E:海藻酸钠/泊洛沙姆水凝胶
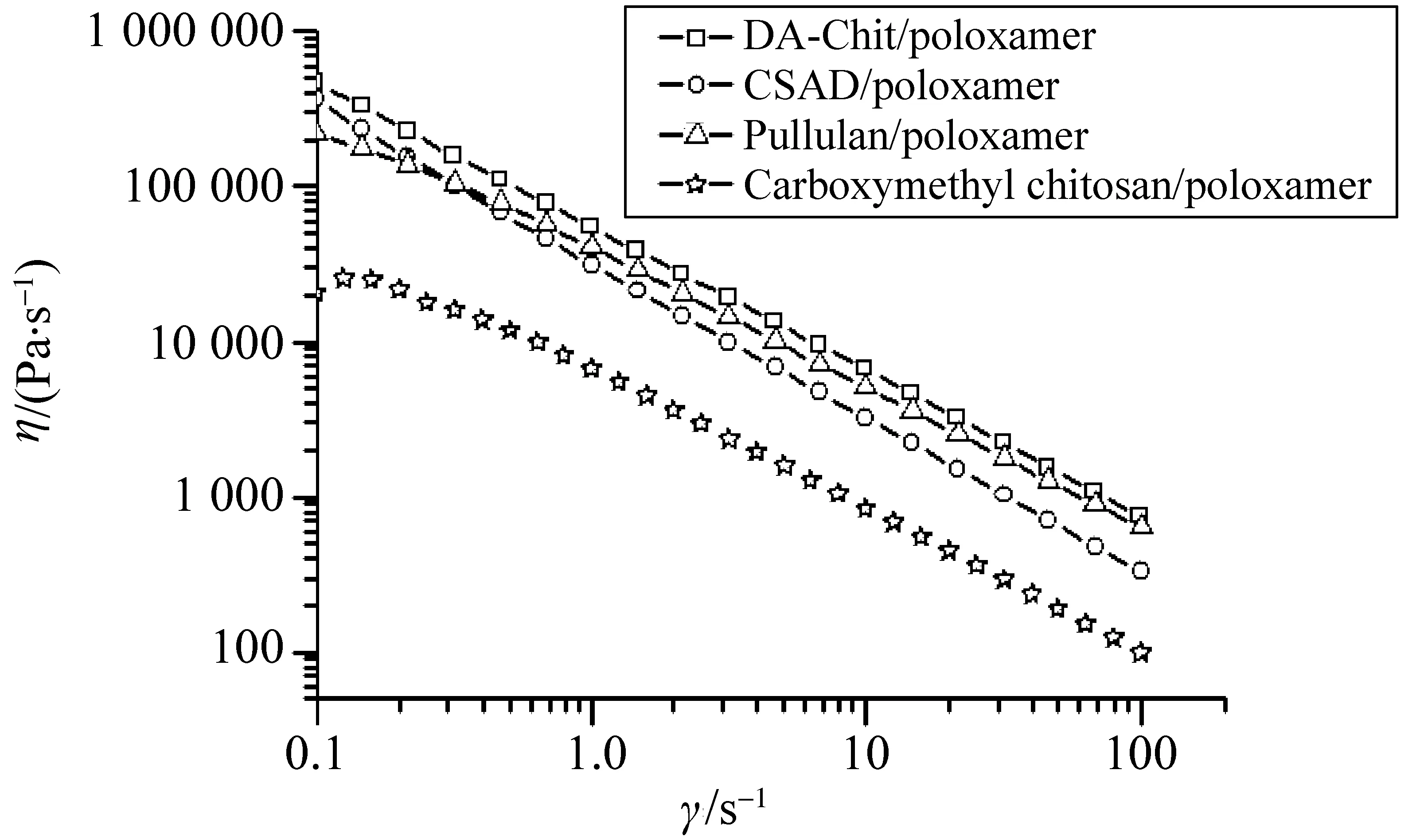
图4 多糖及其衍生物/泊洛沙姆温敏水凝胶的稳态剪切黏度曲线(37 ℃)Fig.4 Steady-shear viscosity curves of the hydrogels composed of polysaccharide/poloxamer and amphiphilic polysaccharide derivative/poloxamer (37 ℃)
2.1.3 多糖及其衍生物/泊洛沙姆温敏水凝胶的剪切变稀行为 当温变水凝胶被注射到体内后,由于各组织器官的运动(如关节等),水凝胶的黏度将可能发生变化。如图4所示,在剪切力作用下,多糖及其衍生物/泊洛沙姆温敏水凝胶的粘度急剧下降,体现出剪切变稀的特性,因此它们都属于非牛顿流体中的假塑性流体。根据文献分析[17],这是由于多糖及其衍生物与泊洛沙姆相互缠结的链段在剪切力作用下被解散的缘故。
根据稳态流变理论的Ostwald-de Waele幂律方程(公式2)[3,18],计算出多糖及其衍生物/泊洛沙姆温敏水凝胶的相关参数列于表2。可看出2种两亲性多糖衍生物/泊洛沙姆水凝胶和普鲁兰/泊洛沙姆水凝胶的K值较接近,并高于羧甲基壳聚糖/泊洛沙姆水凝胶的K值,表明前3种水凝胶的稠度更大。另外这四种水凝胶的n值不断增加,根据文献分析[3],该结果说明它们分子链缠结程度越来越低,剪切变稀性质不断减弱。相比之下,两亲性多糖衍生物/泊洛沙姆水凝胶的n值更小,这可能是由于两亲性多糖衍生物的疏水基团与泊洛沙姆分子之间存在疏水相互作用,使得分子链缠结程度较高,体现出更强的剪切变稀性质。
(2)
式中,η为稳态剪切黏度,γ为剪切速率,n为流动特性指数,K为稠度指数。

表2 37 ℃多糖及其衍生物/泊洛沙姆温敏水凝胶的K值、n值和线性相关系数R2
1)A:CSAD/泊洛沙姆水凝胶;B:DA-Chit/泊洛沙姆水凝胶;C:普鲁兰/泊洛沙姆水凝胶;D:羧甲基壳聚糖/泊洛沙姆水凝胶
2.2 多糖及其衍生物/泊洛沙姆温敏载药水凝胶体外释放药物的行为
强的松具有抗炎、抗过敏、抑制结缔组织增生等作用,但它几乎不溶于水,所以,本工作用强的松作为疏水性药物的模型化合物,研究多糖及其衍生物/泊洛沙姆温敏载药水凝胶体外释放药物的行为,释放液为DMSO/PBS (pH 7.4)溶液(φ=10%)。体外释放曲线如图5所示,它们缓释强的松的时间列于表1,可看出这些水凝胶均能起到缓释强的松的作用。两种两亲性多糖衍生物/泊洛沙姆水凝胶缓释强的松的时间最长,可能是由于两亲性多糖衍生物中的疏水基团与疏水性强的松之间存在疏水相互作用的缘故。相比之下,羧甲基壳聚糖/泊洛沙姆水凝胶缓释强的松的时间比普鲁兰/泊洛沙姆水凝胶和海藻酸钠/泊洛沙姆水凝胶的长,可能是由于羧甲基壳聚糖与强的松之间存在较强的相互作用力。
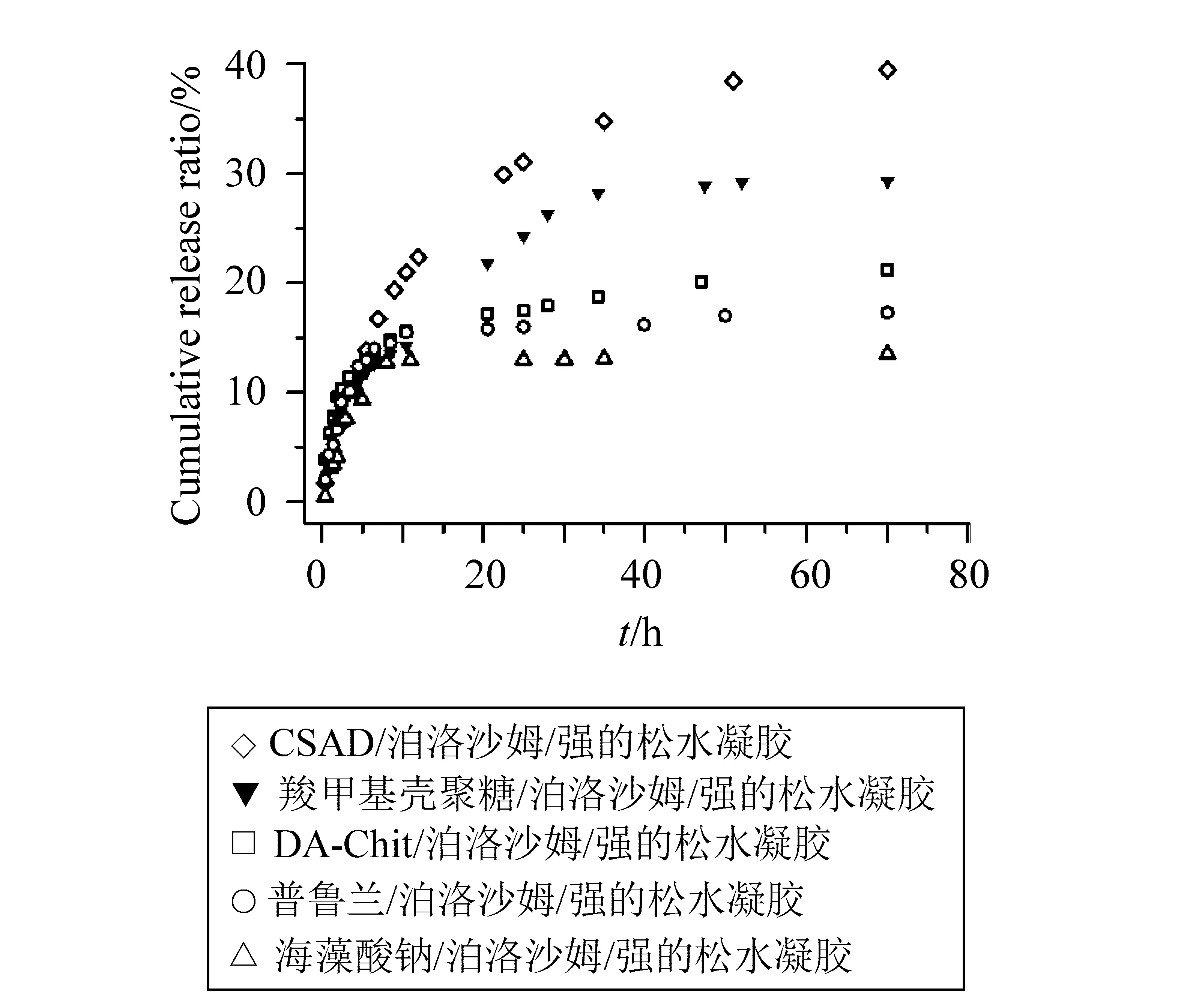
图5 37 ℃多糖及其衍生物/泊洛沙姆温敏载药水凝胶在DMSO/PBS (pH 7.4)溶液中(φ=10%)体外释放强的松的曲线Fig.5 In vitro release profiles of prednisone from the hydrogels composed of polysaccharide/poloxamer and amphiphilic polysaccharide derivative/poloxamer hydrogels in the DMSO/PBS (pH 7.4) solution (φ=10%) at 37 ℃
2.3 多糖及其衍生物/泊洛沙姆温敏水凝胶对成骨细胞生长的影响
为了探讨多糖及其衍生物/泊洛沙姆温敏水凝胶在骨关节组织的应用前景,本工作进一步研究了它们对成骨细胞生长的影响。图6a为大鼠成骨细胞培养1d后的照片,大部分大鼠成骨细胞贴壁后呈梭形生长。培养3d后,由于细胞的增殖,大鼠成骨细胞呈多角形。这些细胞形态与文献报道的大鼠成骨细胞形态一致[19]。
大鼠成骨细胞与多糖及其衍生物/泊洛沙姆温敏水凝胶培养后,细胞形态均有所改变,见图6。以CSAD/泊洛沙姆水凝胶于37 ℃共同培养3d后为例(图6c),可看出大鼠成骨细胞在水凝胶中的形态发生了较大变化,这可能是由于水凝胶的受限空间引起大鼠成骨细胞的形态发生了改变。
图7是大鼠成骨细胞与多糖及多糖衍生物/泊洛沙姆水凝胶于37 ℃共同培养1、3和7d后,通过CCK-8法检测的细胞增殖情况。各水凝胶组的光密度值均随着时间的增长而升高,说明多糖及多糖衍生物/泊洛沙姆温敏水凝胶体表现出促进成骨细胞增殖生长的性能,其中普鲁兰/泊洛沙姆水凝胶组增值效果最高,DA-Chit/泊洛沙姆水凝胶组和CSAD/泊洛沙姆水凝胶组次之。
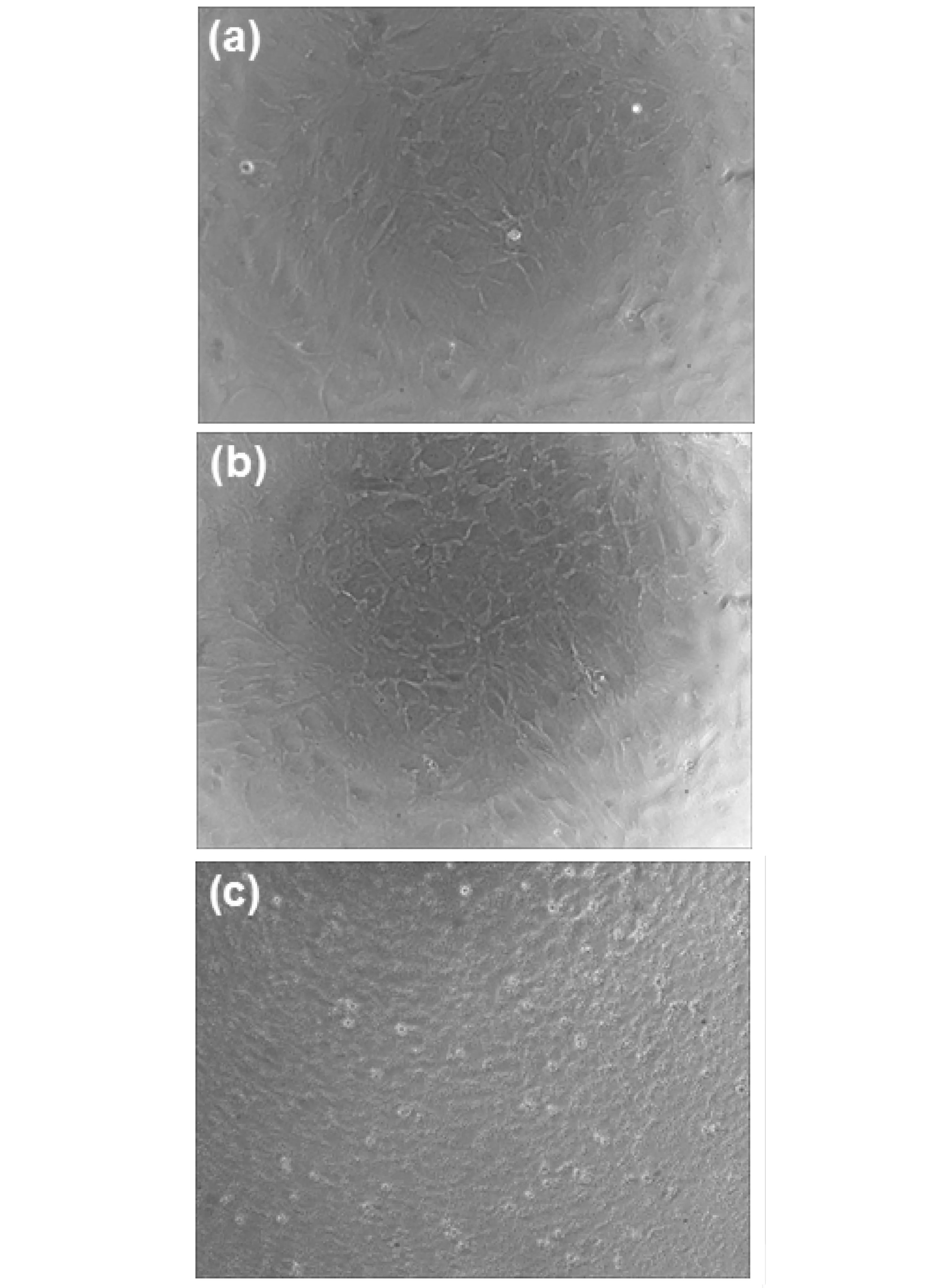
图6 37 ℃大鼠成骨细胞在不同培养时间的照片(×100)Fig.6 Photos of osteoblasts of normal rats following incubation time at 37 ℃ (×100)(a) 大鼠成骨细胞培养1 d后; (b) 大鼠成骨细胞培养3 d后;(c) 大鼠成骨细胞与CSAD/泊洛沙姆水凝胶培养3 d后

图7 大鼠成骨细胞与多糖及其衍生物/泊洛沙姆温敏水凝胶于37 ℃共同培养后的细胞增殖分析(P <0.05)Fig.7 Proliferation of osteoblasts of normal rats in the different hyrogels following being incubated at 37 ℃(P <0.05)
3 结 论
泊洛沙姆与五种不同结构的多糖及多糖衍生物形成温敏水凝胶,它们的凝胶化温度(34~37 ℃)接近体温,有利于实现可注射使用的目的。相比之下,两亲性多糖衍生物与泊洛沙姆的凝胶化时间较短,两亲性多糖衍生物/泊洛沙姆温敏水凝胶的稳定性更高,体现出更强的剪切变稀性质,缓释强的松的时间更长,这些性质可能与两亲性海藻酸钠衍生物和两亲性壳聚糖衍生物与泊洛沙姆之间存在疏水相互作用力有关。5种多糖及多糖衍生物/泊洛沙姆温敏水凝胶体均表现出促进成骨细胞增殖生长的性能,在骨关节组织具有一定的应用前景。
[1]HAMIDIM,AZADIA,RAFIEIP.Hydrogelnanoparticlesindrugdelivery[J].AdvancedDrugDeliveryReviews, 2008, 60: 1638-1649.
[2]YANGL,LANY,GUOH,etal.Ophthalmicdrug-loadedN,O-carboxymethyl chitosan hydrogels: synthesis,invitroandinvivoevaluation [J]. Acta Pharmacologica Sinica, 2010, 31: 1625-1634.
[3] SONG F, ZHANG L M, LI N N, et al. In situ crosslinkable hydrogel formed from a polysaccharide-based hydrogelator [J]. Biomacromolecules, 2009, 10: 959-965.
[4] XUAN J J. BALAKRISHNAN P, OH D H, et al. Rheological characterization andinvivoevaluation of thermosensitive poloxamer-based hydrogel for intramuscular injection of piroxicam [J]. International Journal of Pharmaceutics, 2010, 395: 317-323.
[5] WANG D, CHENG D, GUAN Y, et al. Thermoreversible hydrogel forinsitugeneration and release of HepG2 spheroids [J]. Biomacromolecules, 2011, 12: 578-584.
[6] 金璐燕,李娟. 泊洛沙姆407在制剂中的应用进展[J].药学与临床研究,2009,17(3): 231-234.
[7] 周巧云,张朝晖,潘俊芳,等. 泊洛沙姆为载体的疏水性药物新剂型研究进展[J]. 中国现代应用药学,2011,28(4): 315-319.
[8] 王玮,叶放,周建平.泊洛沙姆407原位凝胶作为药物载体的研究进展[J]. 中国新药杂志,2009,18(8): 699-704.
[9] 李欣宇,朱照静,程安媛. 地塞米松磷酸钠温度敏感原位凝胶的特性研究[J].药学学报,2008,43(2): 208-213.
[10] YANG L, ZHANGB, WEN L, et al. Amphiphilic cholesteryl grafted sodium alginate derivative: Synthesis and self-assembly in aqueous solution [J]. Carbohydrate Polymers, 2007, 68: 218-225.
[11] YU Z, LI H, ZHANG L M, et al. Enhancement of phototoxicity against human pancreatic cancer cells with photosensitizer-encapsulated amphiphilic sodium alginate derivative nanoparticles [J]. International Journal of Pharmaceutics, 2014, 473: 501-509.
[12] LI H, YU Z, WANG S, et al. Protection of photoactivity of photosensitizers by amphiphilic polysaccharide micelles [J]. Chinese Journal of Polymer Science, 2014, 32: 1413-1418.
[13] LI H, YU Z, WANG S, et al. Photosensitizer-encapsulated amphiphilic chitosan derivative micelles: Photoactivity and enhancement of phototoxicity against human pancreatic cancer cells [J]. Journal of Photochemistry and Photobiology B: Biology, 2015, 142: 212-219.
[14] 周怀胜,蓝育青,程良正,等.两亲性壳聚糖衍生物负载及缓释醋酸曲安奈德的性能[J]. 中国组织工程研究与临床康复, 2010, 14(29): 5371-5374.
[15] CHO J, HEUZEY M C, BGIN A, et al. Physical gelation of chitosan in the presence of β-glycerophosphate: The effect of temperature [J]. Biomacromolecules, 2005, 6: 3267-3275.
[16] SONG F, ZHANG L M. Enzyme-catalyzed formation and structure characteristics of a protein-based hydrogel [J]. The Journal of Physical Chemistry B, 2008, 112: 13749-13755.
[17] YANG L, KUANG J, LI Z, et al. Amphiphilic cholesteryl-bearing carboxymethylcellulose derivatives: self-assembly and rheological behaviour in aqueous solution [J]. Cellulose, 2008, 15: 659-669.
[18] CANCELA M A, ALVAREZ E, MACEIRAS R. Effects of temperature and concentration on carboxymethylcellulose with sucrose rheology [J]. Journal of Food Engineering, 2005,71: 419-424.
[19] 唐昭,陈治清. 大鼠成骨细胞体外培养的研究[J]. 华西口腔医学杂志,1997, 15(1): 70-72.
Preparation and Properties of Temperature Sensitive Hydrogels Composed of Polysaccharides and Their Derivatives/Poloxamers
HUYiqing1,LAIXinyi1,LUOJiahao1,LONGXi1,ZENGChunlian1,FUChaoping1,FENGZile1,QUHaihong2,ZHANGDairong2,KANGXiantong2,ZHANGLiming1,YANGLiqun1
(1. School of Chemistry and Chemical Engineering∥Key Laboratory of Polymer Composite and Functional Materials of Ministry of Education∥Design and Synthesis of New polymer Materials and the Key Laboratory of General University of Guangdong Province∥Key Laboratory of High Performance Resin Matrix Composite Materials in Guangdong Province, Sun Yat-sen University, Guangzhou 510275, China; 2. Guangzhou Infumedi Medical Instrument Limited Company, Guangzhou 501670,China)
To improve the property of poloxamer hydrogels, temperature sensitive hydrogels were prepared from poloxamer and five kinds of polysaccharides as well as their derivatives with different chemical structures in this work. The effect of the chemical structures of polysaccharides and their derivatives on the hydrogel properties was investigated. The result indicated that the polysaccharides and their derivatives could form the hydrogels with poloxamer at the temperature (34~37 ℃) near human beings’ temperature, which is advantageous for the injection application. The amphiphilic polysaccharide derivative/poloxamer hydrogels exhibited higher stabilities, stronger shear thinning behaviours, longer time for releasing hydrophobic drug of prednisone. These properties are probably related to the hydrophobic interactions between the amphiphilic polysaccharide derivatives and poloxamer. Five kinds of temperature sensitive hydrogels all exhibited the property for promoting the growth of osteoplasts, showing the potential application in the osseous junction’s tissues.
polysaccharide; polysaccharide derivative; poloxamer; temperature-sensitive hydrogel; prednisone
10.13471/j.cnki.acta.snus.2015.06.019
2015-05-23 基金项目:国家自然科学基金资助项目(21244005);广东省部产学研结合资助项目(2012B091100356)
胡亦清(1994年生),男;研究方向:天然高分子生物医用功能材料;通讯作者:杨立群; E-mail:yanglq@mail.sysu.edu.cn
O632
A
0529-6579(2015)06-0104-07
