真武胶囊安全性评价研究*
2015-06-01岳园园李晓天张玉静
申 安,袁 洋,岳园园,张 颖,李晓天,张玉静
(1.焦作市食品药品检验所,河南 焦作 454001; 2.大连医科大学附属第一人民医院,辽宁 大连 116000; 3.郑州大学药学院,河南 郑州 450000)
真武胶囊安全性评价研究*
申 安1,袁 洋2,岳园园3,张 颖3,李晓天3,张玉静3
(1.焦作市食品药品检验所,河南 焦作 454001; 2.大连医科大学附属第一人民医院,辽宁 大连 116000; 3.郑州大学药学院,河南 郑州 450000)
目的:对真武胶囊的安全性进行研究。方法:取40只KM小鼠进行急性毒性试验。将小鼠随机分为对照组和真武胶囊组2组,每组20只。真武胶囊组给予真武胶囊生药粉57.14g/(kg·d),对照组给予羧甲基纤维素钠(CMC-Na)0.4 g /(kg·d),灌胃给药,1d 2次,上、下午各1次,给药间隔约为6 h,给药期限为1 d。给药后观察动物反应,连续观察15 d。另取SD大鼠160只进行长期毒性试验。将大鼠随机分为对照组(CMC-Na 0.05 g/kg),真武胶囊低剂量(1.71g/kg)、中剂量(3.20 g/kg)、高剂量(5.97 g/kg)组4组,灌胃给药,1 d 1次,每周给药6 d,连续给药90 d。观察一般状况,并检测血液学指标、血液生化学指标,对心脏、气管、肺和胃组织进行病理学检查。结果:急性毒性试验中所有动物均未出现明显的毒性反应,观察期结束后对全部动物进行剖检,肉眼观察各脏器无明显异常。长期毒性试验在给药后的观察期内实验动物一般状况良好,血液学指标、各脏器组织等均未出现与药物相关的毒性反应。结论:真武胶囊具有较好的安全性。
真武胶囊/药效学;安全性;毒性试验;动物模型;小鼠
真武汤出自《伤寒论》,由附子、生姜、茯苓、白术、白芍组成,是为表证过汗伤阳、少阴病阳虚水泛病证而设的名方[1]。本研究采用新的配方比例首次将真武汤改为胶囊剂型,按照《药品注册管理办法》新药技术要求,对真武胶囊做临床前安全性评价。
1 材 料
1.1 动 物
急性毒性试验用动物:经检疫合格的SPF级KM小鼠40只,雌雄各半,雄性体质量18.8~24.6g,雌性体质量18.0~22.5 g,由河南省实验动物中心提供,实验动物生产许可证号为SCXK(豫)2010-0002,实验动物质量合格证号为1019164。长期毒性试验用动物:经检疫合格的SPF级SD大鼠160只,雌雄各半,雄性体质量112.0~141.3g,雌性体质量122.5~153.7g,由北京维通利华实验动物技术有限公司提供,实验动物生产许可证号为SCXK(京)2012-0001,实验动物质量合格证号11400700022526。
1.2 药品与试剂
真武胶囊,每粒胶囊含0.4 g胶囊粉,每克胶囊粉相当于8.75 g生药,由某制药股份有限公司提供,批号130506。羧甲基纤维素钠(CMC-Na),由国药集团化学试剂有限公司提供,批号F20090113。
2 方法与结果
2.1 急性毒性试验
2.1.1 动物分组与给药
将40只KM小鼠随机分为对照组和真武胶囊组2组,每组20只,雌雄各半。真武胶囊组给予真武胶囊生药粉57.14 g/(kg·d),对照组给予CMC-Na 0.4 g /(kg·d),均灌胃给药,1 d 2次,上、下午各1次,给药间隔约为6 h ,给药期限为1 d。
2.1.2 检测指标
观察给药后动物的一般状况,称量体质量,记录动物中毒的表现和特点、毒性反应出现和消失时间,以及动物的死亡时间,并连续观察15 d。
2.1.3 结 果
在给药后的观察期内,所有动物均未出现明显的毒性反应,动物无一例死亡。真武胶囊组动物的体质量与对照组对比,差别无统计学意义。观察期结束后对全部动物进行剖检,肉眼观察各脏器无明显异常。
2.2 长期毒性试验
2.2.1 动物分组与给药
将160只SPF级SD大鼠,随机分为对照组(CMC-Na 0.05 g/kg)、真武胶囊低剂量(1.71 g/kg)、中剂量(3.20 g/kg)、高剂量(5.97 g/kg)组4组,每组40只,雌雄各半[2]。均灌胃给药,1 d 1次,每周给药6 d,连续给药90 d。
2.2.2 检测指标
每天进行一般状况观察,每周称量2次体质量,并于给药90 d时进行血液学、血清生化学以及病理学检查。病理检查根据镜检记录进行分析[3-5]。
2.2.3 统计学方法
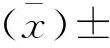
2.2.4 结 果
一般状况及体质量:各用药组大鼠的一般状况良好,未见明显与药物相关的毒性症状。各用药组大鼠的体质量与对照组对比,差别无统计学意义。
给药90 d时各组雄性大鼠血液学指标对比:与对照组对比,真武胶囊粉高剂量组RBC水平降低(P<0.01)、HGB水平降低(P<0.05)、PLT增高(P<0.05),真武胶囊粉中剂量组RBC水平降低(P<0.05),但以上指标均在正常值范围内,且未见与给药剂量及进程的相关性。各用药组其余指标与对照组比较差别无统计学意义(P>0.05)。见表1。


组 别剂量/(g·kg-1·d-1)RBC/(1012·L-1)HGB/(g·L-1)PLT/(109·L-1)WBC/(109·L-1)NEU/%LYM/%对照组0.0512.25±1.90174.10±25.04678.30±322.177.06±3.6117.018±5.2863.59±12.65真武胶囊高剂量组52.210.37±1.07**153.44±8.83*965.11±134.77*5.23±1.3215.66±3.7663.38±12.72真武胶囊中剂量组28.011.52±1.31*166.30±17.71922.00±323.555.40±2.1418.02±5.5766.04±11.83真武胶囊低剂量组15.011.92±0.89165.60±12.61832.50±251.437.98±3.0414.94±4.3172.86±7.39
注:与对照组对比,*P<0.05,**P<0.01。
给药90 d时各组雄性大鼠血清生化学指标对比:与对照组对比,真武胶囊粉高剂量组TP升高(P<0.05),但在正常值范围内,且未见与给药剂量及进程的相关性。各用药组其余指标与对照组比较(P>0.05)。见表2。
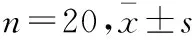

组 别剂量/(g·kg-1·d-1)ALT/(U·L-1)AST/(U·L-1)ALP/(U·L-1)GGT/(U·L-1)TP/(g·L-1)ALB/(g·L-1)TBiL/(mmol·L-1)对照组0.0545.44±8.01112.60±19.4996.69±37.291.17±0.3069.78±4.3633.41±3.804.64±0.51真武胶囊高剂量组52.242.64±4.39107.50±22.44105.92±14.401.08±0.2665.53±5.97*31.31±4.124.27±0.55真武胶囊中剂量组28.041.73±4.19108.10±15.07102.00±14.251.15±0.3168.23±1.1632.58±2.634.63±0.48真武胶囊低剂量组15.043.96±7.45105.70±15.87108.38±7.571.19±0.3170.21±5.2032.82±3.984.47±0.50
注:与对照组对比,*P<0.05。
给药90 d时各组雌性大鼠血液学指标对比:与对照组对比,真武胶囊粉高剂量组RBC水平降低(P<0.05),HGB水平降低(P<0.05),但二者均在正常值范围内,且未见与给药剂量及进程的相关性。各用药组其余指标与对照组比较(P>0.05)。见表3。
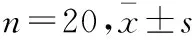
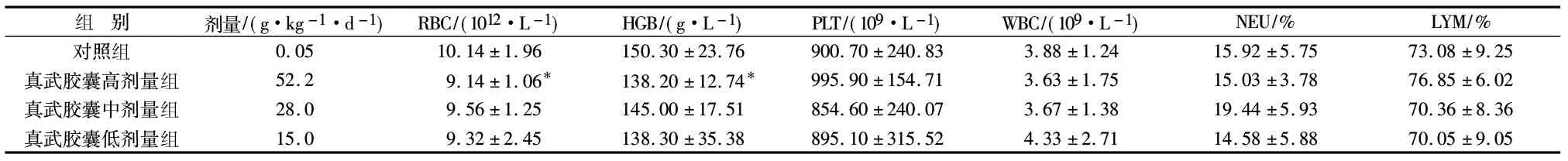
组 别剂量/(g·kg-1·d-1)RBC/(1012·L-1)HGB/(g·L-1)PLT/(109·L-1)WBC/(109·L-1)NEU/%LYM/%对照组0.0510.14±1.96150.30±23.76900.70±240.833.88±1.2415.92±5.7573.08±9.25真武胶囊高剂量组52.29.14±1.06*138.20±12.74*995.90±154.713.63±1.7515.03±3.7876.85±6.02真武胶囊中剂量组28.09.56±1.25145.00±17.51854.60±240.073.67±1.3819.44±5.9370.36±8.36真武胶囊低剂量组15.09.32±2.45138.30±35.38895.10±315.524.33±2.7114.58±5.8870.05±9.05
注:与对照组对比,*P<0.05。
给药90 d时各组雌性大鼠血清生化学指标对比:与对照组对比,真武胶囊粉高剂量TP升高(P<0.05),但在正常值范围内,且未见与给药剂量及进程的相关性。各用药组其余指标与对照组比较差别无统计学意义(P>0.05)。
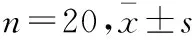

组 别剂量/(g·kg-1·d-1)ALT/(U·L-1)AST/(U·L-1)ALP/(U·L-1)GGT/(U·L-1)TP/(g·L-1)ALB/(g·L-1)TBiL/(mmol·L-1)对照组0.0543.1±5.70102.70±9.18103.10±14.421.22±0.2869.41±3.5332.94±2.484.43±0.60真武胶囊高剂量组52.245.69±3.76106.40±10.54110.57±12.841.34±0.2765.07±5.25*32.76±3.653.88±0.62真武胶囊中剂量组28.045.00±5.92107.80±9.52105.23±15.411.17±0.2469.08±4.8832.27±3.444.31±0.37真武胶囊低剂量组15.043.92±4.61101.92±9.55104.46±11.461.31±0.2375.37±8.4633.57±2.494.45±0.77
注:与对照组TP对比,真武胶囊高剂量组 *P<0.05。
病理检查结果:动物组织器官未出现与药物相关的毒性反应,高剂量组大鼠心脏、气管、肺和胃的病理切片见图1~4。大鼠心肌纤维条纹清晰,无变性、坏死。气管黏膜、黏膜下层和外膜结构清楚。肺终末支气管与肺泡组织结构清晰,肺泡壁与肺泡腔内均无炎性细胞浸润。胃黏膜皱襞清楚,被覆上皮完整,未见溃疡、增生等改变。
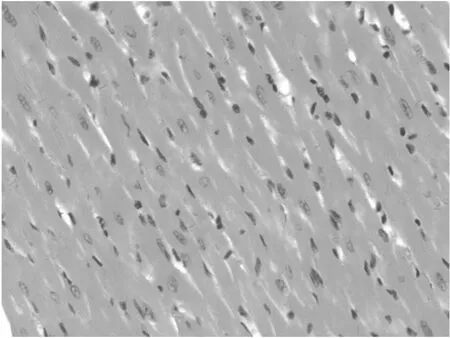
图1 心脏的病理切片(HE染色,×40)
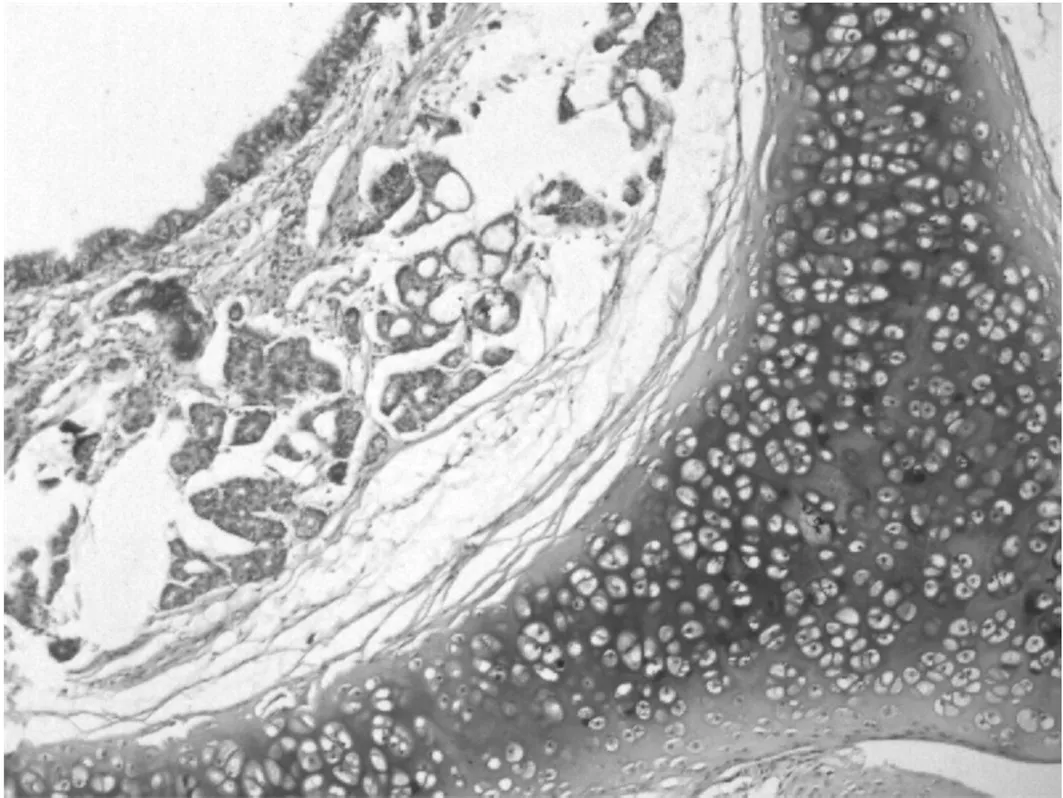
图2 气管的病理切片(HE染色,×10)
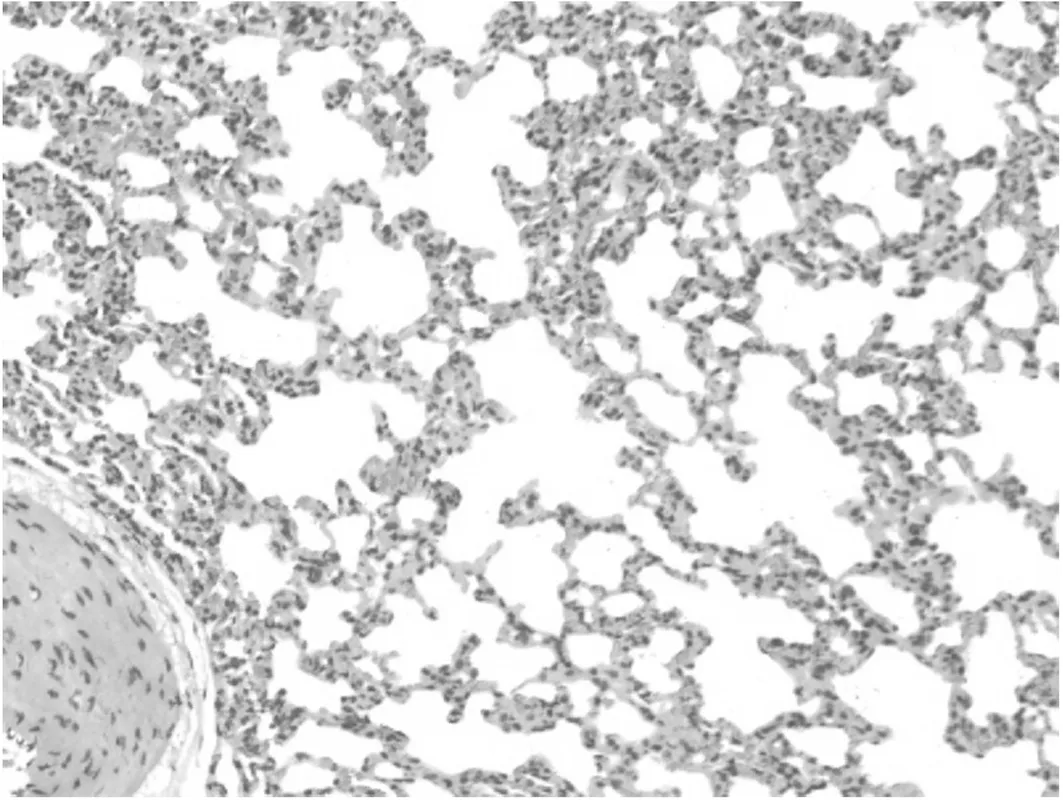
图3 肺的病理切片(HE染色,×20)
图4 胃的病理切片(HE染色,×10)
3 讨 论
真武胶囊是在传统真武汤(由附子、生姜、茯苓、白术、白芍组成)的基础上,进一步完善药物组方、改变剂型而研制出的药物,与真武汤的治疗作用一致,但较真武汤有服用方便、药物稳定性好等优点。为了预测受试物可能引起的临床不良反应,为临床试验中解毒或解救措施提供参考,笔者进行了急性毒性试验和长期毒性试验。急性毒性试验所获得的信息对重复给药毒性试验的剂量设计和药物临床试验起始剂量的选择具有重要参考价值,并对了解其毒性靶器官和初步阐明药物的毒性作用具有重要意义。在本实验条件下,一天内灌胃给予小鼠57.14 g /kg真武胶囊生药粉(相当于拟用临床剂量的104.1倍),所有动物均未发现明显的毒性反应。长期毒性试验可以用来推测第一次临床试验的起始剂量,为后续临床试验提供安全剂量范围以及为临床不良反应监测及防治提供参考。本实验条件下,用真武胶囊粉给SD大鼠连续灌胃90 d,高剂量相当于真武胶囊生药粉52.2 g/(kg·d) ,相当于临床用量的85.3倍,各项检测指标均未出现明显的剂量及时间依赖性。
本研究结果显示:真武胶囊组动物均未发现明显的毒性反应,各项血液学和血清生化学指标变化也未见明显剂量及时间依赖性,各组织器官未发现异常。表明真武胶囊具有良好的安全性,但其具体临床安全性还有待于进一步研究。
[1]王均宁,刘更生.真武汤的药理研究与临床应用[J].中成药,1998,20(11):45-46.
[2]国家药品监督管理局.药物重复给药毒性试验技术指导原则[S].北京:国家食品药品监督管理总局药品评审中心,2014:53-59.
[3]袁伯俊, 廖明阳, 李波.药物毒理学试验方法与技术[M].北京:化学工业出版社, 2007.
[4]孙劲,徐元宏.SD大鼠常见血液学检测指标参考范围的建立[J].临床输血与检验,2008,10(3):253-255.
[5]邓雯,陈莉莉,刘晶,等.SPF级SD大鼠血液学及血清生化指标正常值探讨[J].毒理学杂志,2010,24(2):174-175.
(编辑 陶 珠)
1001-6910(2015)08-0061-04 ·实验研究·
R286
B
10.3969/j.issn.1001-6910.2015.08.30
李晓天,教授,博士后,lixt@zzu.edu.cn
河南省科技攻关项目(13210231241)
2015-04-22;
2015-06-23
