藻胆体与类囊体膜之间的能量传递研究进展
2015-05-30冯小亭臧晓南张学成袁定阳赵炳然谭炎宁
冯小亭 臧晓南 张学成 袁定阳 赵炳然 谭炎宁
摘 要:藻胆体是蓝藻及红藻主要的捕光天线,可以将吸收的光能传递给类囊体膜。该文首先对蓝藻及红藻藻胆体中各藻胆蛋白组分的能量传递规律,及藻胆体与类囊体膜之间能量传递机制进行了概述,认为能量传递效率与各蛋白组分的相对位置及其相互之间的光谱匹配程度有关;能量传递需要多种机制的共同参与,只是所占比例不同;状态转换不是在极端的实验条件下才发生的,而在日常条件下就可以发生。此外,还概述了藻胆体或藻胆蛋白与高等植物类囊体膜之间的能量传递,认为藻胆体或藻胆蛋白与高等植物类囊体之间能发生能量传递,不同的藻胆蛋白与高等植物类囊体之间的传递效率有所不同。最后对建立高效的植物光能传递系统的研究方向提出了展望。
关键词:藻胆体 藻胆蛋白 类囊体膜 高等植物 能量传递
中图分类号:Q945 文献标识码:A 文章编号:1672-3791(2015)09(c)-0245-07
Advances in Energy Transfer Between Phycobilisomes and Thylakoid Membrane
Feng Xiaoting1 Zang Xiaonan* Zhang Xuecheng1 Yuan Dingyang2 Zhao Bingran2 Tan Yanning2
(1.Key Laboratory of Marine Genetics and Breeding, Ministry of Education, College of Marine Life Sciences,Ocean University of China,Qingdao Shandong,266003,China;2.Key Laboratory of China National Hybrid Rice,China National Hybrid Rice Research and Development Center,Changsha Hunan,410125,China)
Abstract:Phycobilisomes are the major light-harvesting antenna of cyanobacteria and Rhodophyta which can absorb and deliver light energy to the thylakoid membrane. In this paper, law of energy transfer of phycobiliproteins components of Phycobilisomes and mechanisms of energy transfer between phycobilisomes and thylakoid membrane are summarized firstly. It is concluded that the efficiency of energy transfer is related to the relative position of the phycobiliprotein components and the degree of spectral match among them. It is needed several mechanisms of energy transfer to participate their energy transfer, only with different proportion among them. State transition does not only occur under extreme experimental conditions, but it can occur under routine conditions. In addition, an overview of the energy transfer between phycobilisomes or phycobiliprotein and thylakoid membrane of higher plants are summarized. It is belived that energy can be delivered from phycobilisomes or phycobiliprotein to thylakoid membrane of higher plants. Different phycobiliprotein shows different efficiency of energy transfer. In the end, the prospects for the future establishment of efficient energy systerm of high plant are put forward.
Key Words:Phycobilisomes;Phycobiliprotein;Thylakoid Membrane;High Plants;Energy Transfer
红藻(Rhodophyta)及蓝藻(Cyanobacteria)的光合器是藻胆体-类囊体膜构成的复合体。其中藻胆体(phycobilisome,简称 PBS)是连接蛋白与藻胆蛋白组装而成,与类囊体膜的细胞质面相连,是主要的捕光天线系统,能捕获500~650 nm的光,吸收光谱恰好与叶绿素互补,使得藻类植物在几乎整个可见光区都有光吸收[1]。藻胆体中色素蛋白的空间位置排布和能量匹配的优化,使得总的能量传递效率接近100%,最终将能量传递到类囊体膜进行光合作用。藻类在植物进化序列中处于光合细菌和高等植物之间,与高等植物的光合器相似,具有相似的光合作用机能。然而高等植物的捕光天线系统是类囊体膜内的叶绿素,吸收光谱在430~440 nm以及670~680 nm的两段区域,反应中心没有藻胆体这样的捕光天线,因此不能利用500~650 nm的光。
随着新技术的不断发展,藻胆体内部及其与类囊体膜间的特殊的能量传递规律越来越多的被人们所认识[2],而且由于藻胆体可以捕获高等植物所不能获取的光能,对藻胆体或者藻胆蛋白与高等植物光合膜之间能量传递也引起人们的兴趣。该文主要对藻胆体与类囊体膜之间能量传递进行了概述,并对以后的研究方向提出了展望。
1 藻类藻胆体和类囊体膜的结构
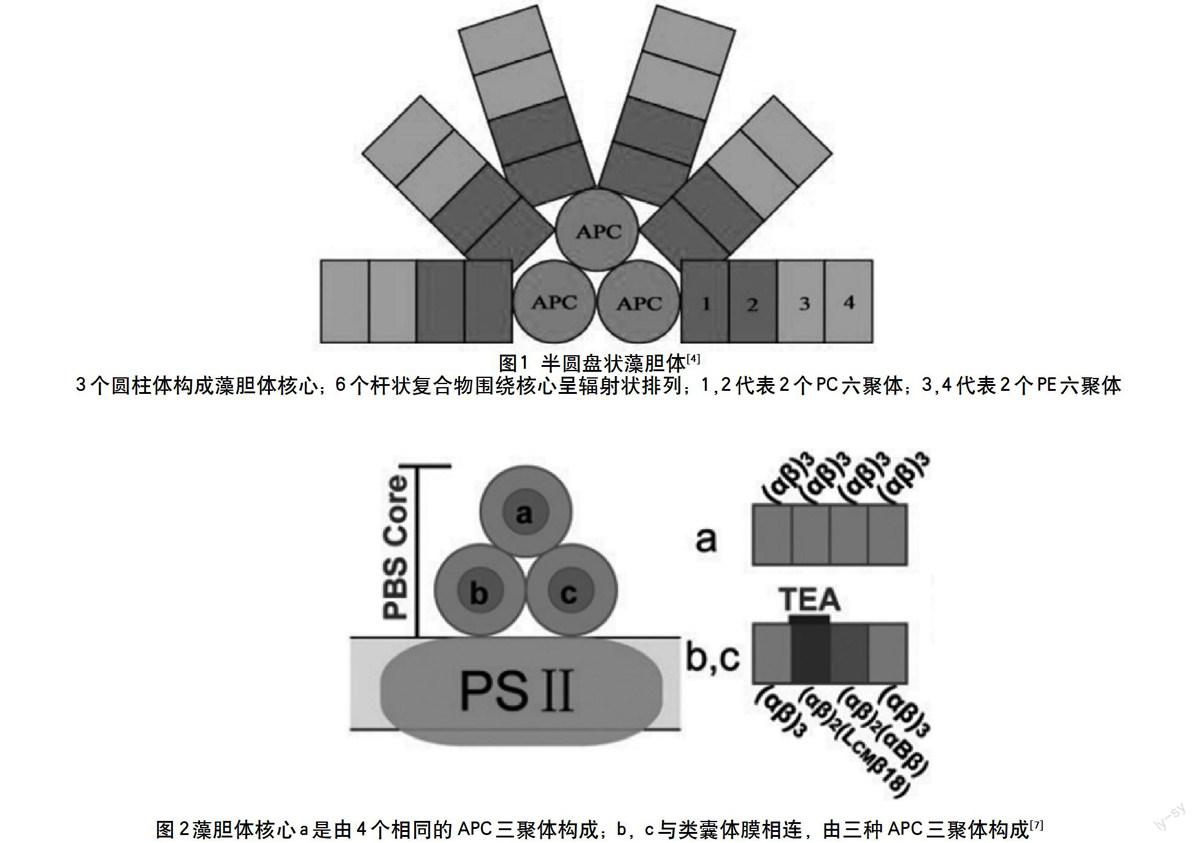
藻胆体主要由杆和核组成的,通过连接多肽组装。其中杆由藻红蓝蛋白(PEC),藻红蛋白(PE),藻蓝蛋白(PC)构成,但是藻红蓝蛋白和藻红蛋白并非存在于每一种藻类内,在一些种类中,藻红蓝蛋白和藻红蛋白的表达量是受到调节的。连接多肽与别藻蓝蛋白(APC)构成藻胆体核心。藻胆体的类型有4种,包括束状、半盘状、半椭球状以及双圆筒状,其中最常见的是半盘状藻胆体(如图1),主要存在于大部分蓝藻和一些单细胞的红藻中[3]。这种藻胆体主要由棒状复合物和核心复合物构成,核心复合物常由3个圆柱体组成,6个棒状复合物在同一平面内辐射排列在核心复合物上(如图2)[4]。核心复合物中含有3种别藻蓝蛋白三聚体(如图2):APC(αβ)3、(αβ)2 (αBβ)、(αβ)2 (LCMβ18) (αβ为别藻蓝蛋白的2种亚基,LCM为藻胆体末端的一种连接蛋白),且三聚体(αβ)2 (αBβ)与(αβ)2 (LCMβ18)被认为是PBS终端能量受体。经基因突变发现,藻胆体中ApcE、ApcF、ApcA、ApcD等蛋白均与能量传递有关[5]。
与高等植物类囊体膜相似,藻类类囊体膜上存在着3个重要的复合体:PSⅠ、PSⅡ和细胞色素b6f复合体,通过几个低分子量的载体连接。PSⅡ以二聚体的形式与藻胆体结合,结合比例为2∶1[6]。由于2个拷贝的ApcE位于藻胆体核心的内侧,所以,PSⅡ与藻胆体核心的中间部分结合;而且PSⅡ细胞质面较为平坦,因此,藻胆体核心与之结合较紧密。然而,PSⅠ是以单体和三聚体形式存在,与PSⅠ结合的ApcD,位于藻胆体核心的外围,PSⅠ细胞质面有3个亚基突起,因此,PSⅠ与藻胆体核心部分的外围结合时不如,PSⅡ紧密。FNR和PsaF亚基是藻胆体和PSⅠ相连的桥梁,FNR蛋白的N端与杆末端连接蛋白CpcD同源,位于2个底部杆上,PsaF是PSⅠ的亚基,是跨膜螺旋状蛋白。细胞色素b6f复合体也是由多亚基组成,与PSⅠ,PSⅡ等复合体共同组成光合作用传递链的功能单位[3]。
2 藻胆体各组分的能量传递
早期,人们在蓝藻中通过简单的光谱技术,得知其藻胆蛋白组成及能量传递途径为:C-藻红蛋白→C-藻蓝蛋白→别藻蓝蛋白→别藻蓝蛋白B→叶绿素a[8,9]。皮秒级时间分辨三维谱图直观地显示出R-藻蓝蛋白的藻红胆素发色团向藻蓝胆素发色团的能量传递;与C-藻蓝蛋白光谱对比,R-藻蓝蛋白独特的色团组成使其更有效地捕获与传递光能[10]。然而随着研究的深入,研究者发现藻胆体内部能量传递途径并非单一。乔木等从发菜中分离到的红色蛋白Rx(吸收峰520 nm处)能将吸收的光能分别传递给藻蓝蛋白和别藻蓝蛋白及其他物质最终以785 nm的荧光发射出来[11]。Gingrich和Lundell[12]等分别报道了在藻胆体的“核心复合物”中存在着两种能量终端受体:αAPB和LCM。Su等[13]报道了集胞藻apcA缺失突变型中光能可由藻蓝蛋白直接传给叶绿素a,Zhao等[14]也证实了这种能量传递模式。路荣昭等[15]在蓝藻的藻胆体在不同浓度的磷酸缓冲液解离过程中荧光发射光谱实验中得出藻胆体中存在2种C-藻蓝蛋白:一种与别藻蓝蛋白相连;另一种与末端发射体相连,藻胆体的光能传递的途径为:
赵福利等[16-18]人工合成了二元复合物R-PE/R-PC,R-PE/APC,R-PC/APC以及三元复合物R-PE/ R-PC/APC,通过时间分辨荧光光谱以及多指数拟合的方法对数据进行了详细的处理和分析,研究结果表明能量在R-PE和R-PC之间的传递时间同R-PE和APC,R-PC和APC之间的传递时间基本上相等的;并且R-PC到APC进行能量传递时没有其他通道,但是发现能量可以通过2个通道从R-PE直接传递到APC,同时也可以经过R-PC传递到APC,R-PC作为能量传递的中间受体,在实际的体系中其作用是通过竞争的机制实现的。由此可见,藻胆体内部能量传递途径并非单一的,随着外界条件的变化传递途径会做出相应调整。
为了进一步研究藻胆体各组分与类囊体膜之间的能量传递效率,Li等[19]分离纯化了蓝藻(Spirulina platensis)的藻胆蛋白及类囊体膜,并对不同藻胆蛋白与类囊体膜进行了重组,发现藻红蛋白不能将能量传递到类囊体膜,藻蓝蛋白和别藻蓝蛋白都可将能量传递给类囊体,但是后者的能量传递效率高于前者。可见能量传递不仅与供体和受体的相对位置有关,而且同受体与供体光谱的匹配程度有关。
3 藻胆体与自身类囊体膜的能量传递
关于藻胆体与类囊体膜能量传递一直存在争议,以往一致认为藻胆体只与PSⅡ直接相连,可以将藻胆体吸收的光能传递给PSⅡ[20],然后PSⅡ将激发能传递给PSⅠ。但是有研究发现藻胆体也可以将能量有效地传递给PSⅠ[21],藻胆体核心特殊组分ApcD对藻胆体向PSⅠ进行能量有效地传递是必不可少的[22,23]。近来发现Synechocystis sp.PCC 6803含有2种类型的藻胆体:CpcG1-藻胆体和CpcG2-藻胆体。CpcG1-藻胆体同普通藻胆体一样,CpcG2-藻胆体缺乏藻胆体核心。CpcG2将CpcG2-PBS锚定在类囊体膜上,两种藻胆体的能量传递是相互独立的[24]。通过低温荧光光谱发现CpcG2-藻胆体优先将光能传递给PSⅠ,经纯化发现CpcG2-藻胆体与PSⅠ直接相连[25]。
进一步研究发现,状态转换调节光能在PSⅠ和PSⅡ之间进行合理分配起重要作用,使得光合作用效率达到最大值[26]。状态转换存在状态1和状态2两种状态。在状态1时藻胆体易于结合PSⅡ,相反,在状态2时,易于结合PSⅠ。状态转换是通过光和氧化还原剂诱导的。蓝藻、红藻所处的环境隨着时间的变化而变化,如,接受的光照强度,光质等条件的变化,当这些条件改变时,能量传递系统会做出相应调整使能量传递及分配达到最佳状态,因此,光状态转换不是在实验条件(极端条件)下才发生的,而是自然界中普遍存在的适应环境变化的机制。
状态转换的发生主要与藻胆体与光反应中心能量传递有关,结合近年来的研究,藻胆体与光反应中心能量传递可以总结为3种类型:能量溢出模型、藻胆体流动模型、并行连接模型。光诱导的状态转换依赖于藻胆体移动机制,而由氧化还原诱导的状态转换靠藻胆体移动与溢出机制同时参与[27]。
能量溢出模型指的是能量的传递途径是按藻胆体-PSⅡ-PSⅠ顺序进行的,由PSⅡ将能量传递给PSⅠ。多种红藻的延迟荧光光谱表明多于50%的PSⅡ将激发能传递给PSⅠ,并且随着藻红蛋白量的增加,能量从PSⅡ向PSⅠ溢出的机制会占主导地位,这是快速适应环境的机制[28]。Li等还发现能量溢出尤其容易发生在光照到黑暗转变中,因为PSⅠ三聚体易被诱导分解为单体,这就增加了PSⅠ与PSⅡ相遇的可能性,易于能量溢出到PSⅠ[29]。Zhang等[30]研究证明蓝藻PSⅠ在高浓度的H+条件时,单聚体形成增多,三聚体减少,PSⅠ与PSⅡ相遇机会增多,发生能量溢出。以上比较容易解释能量溢出发生的机制:当蓝藻细胞经过光到黑暗条件的转变,类囊体膜基质侧的H+ 浓度升高,使得PSⅠ单体间的作用力变为排斥力,PSⅠ由三聚体变成单聚体,产生能量由PSⅡ溢出到PSⅠ的现象。陈李萍[31]提出了一种能量溢出的新途径,能量由PSⅠ三聚体向PSⅡ二聚体反向传递。2012年,Xu等[32]也发现了一个新的能量传递机制-反向能量溢出(inverse spillover)。将蓝藻藻胆体及光系统组分进行连续的蓝光照射后,77K荧光检测表明,能量从PSⅠ传递到PSⅡ。但是PSⅠ的能量水平低于PSⅡ,因此,这种反向能量溢出机制至今还没得到证明。
藻胆体移动模型即三元复合物模型(PSⅠ-PBS-PSⅡ),该模型认为能量在PSⅠ和PSⅡ之间的分配份额是靠藻胆体在复合物中的精确位移来调节的。通过甜菜碱固定藻胆体后,发现光状态转化不再发生,证明藻胆体移动是状态转换的前提。运用光漂白后荧光恢复(FRAP)技术直接而有效地观察到蓝藻藻胆体可以在类囊体膜表面快速移动[33]。Shuzhen Yang等[34]根据时间变化的荧光涨落(time-dependent fluorescence fluctuation),首次观察到蓝藻Synechocystis sp.PCC6803在光状态转换中藻胆体的移动,藻胆体移动的快慢与幅度与光强度有关。Sarcina等利用Synechococcus sp.PCC7942类囊体膜的特殊结构,得出了影响藻胆体扩散系数的3种因素:膜脂成分、温度、藻胆体大小。Xu等[35]进行了在光状态转换过程中藻胆体的动力学研究,发现所有藻胆体表现出集体移动的现象,通过藻胆体移动来调节能量在PSⅠ与PSⅡ之间能量的有效传递。在状态1时,藻胆体与PSⅡ亲和力高于PSⅠ,而在状态2时,PSⅡ与PSⅠ的比例下降,推测PSⅡ可能存在磷酸化的共价修饰[36],被修饰的PSII无法与藻胆体结合,这一部分藻胆体就与PSⅠ结合,因此,PSⅠ的荧光量子产率提高。
第三种能量传递模型称为并行连接模型,是指藻胆体与2种光系统(PSⅠ和PSⅡ)并行连接,能量可由藻胆体并行传递给类囊体膜上的PSⅠ和PSⅡ。例如:与在室温条件下的荧光强度相比,在0 ℃时PSII的荧光强度下降,别藻蓝蛋白(APC)的荧光强度却升高,PSⅠ增加,藻蓝蛋白(PC)荧光强度却减少,推测PSⅡ与APC末端发射体部分解偶联,PSⅠ与藻胆体杆PC更有效偶联在一起[37],能量可以由藻胆体杆直接传递到PSI。
目前认为藻胆体移动模型与能量溢出模型是最基本的模型。藻胆体移动与能量溢出两种机制在光合作用中所占的比例根据所处条件的变化而变化。Zhang Rui等[38]认为在高于膜脂相变温度时,藻胆体流动机制占65%,能量溢出占35%。当低于相变温度时,藻胆体流动占95%,温度越低,藻胆体流动所占比例越大。Ma等[39]发现与在充气的培养基中培养蓝藻相比,静态培养时PSⅡ的活性下降,抑制了由PSⅡ向PSⅠ的能量传递途径。
4 藻胆体或藻胆蛋白与高等植物类囊体之间的能量传递
人们在研究蓝藻及红藻的藻胆体与其类囊体膜之间的能量传递机制的同时,依据藻胆体中能量传递的一般模式(藻红蛋白→藻蓝蛋白→别藻蓝蛋白→叶绿素a),探索了藻胆蛋白与高等植物类囊体膜之间的能量传递情况。用戊二醛交联法使红藻(Porphyridium cruentum)的藻胆体与甲藻(Gymnodinium sp.)、菠菜(Spinach)的类囊体膜形成复合体,经吸收光谱与荧光光谱发现藻胆体与类囊体膜相互之间能发生能量传递[40]。仵小南,曾呈奎等[41]以螺旋藻、紫菜、多管藻为实验材料,提取它们的藻胆蛋白,将藻红蛋白和藻蓝蛋白分别与青菜(Brassica chinensis) 、菠菜的类囊体膜进行温育,用几种特定波长的光激发,检测不到685 nm的荧光。但是发现只有以上各组中补充加入别藻蓝蛋白时,藻红蛋白和藻蓝蛋白才能将光能传递给青菜的类囊体。而任何一种藻胆蛋白与菠菜类囊体温育,激发时,都可以检测到685 nm的荧光,但是发出的荧光强度不同,别藻蓝蛋白最强,藻蓝蛋白次之,藻红蛋白最弱。并且别藻蓝蛋白加入温育体系后会使荧光强度增强。从而得出青菜与菠菜类囊体膜之间具有结构差异以及别藻蓝蛋白在能量传递中具有承前启后的作用,这与藻胆体中各组分能量传递规律相一致。容寿榆[42]等以嗜热蓝藻优雅粘囊藻(Myxosarcina concinna Printz)的藻胆体与菠菜PSⅡ进行重组,通过光谱技术与放氧活性测定,结果表明两者之间能进行能量传递。愈国强等[43]提取了藻藍蛋白并且制备了含叶绿素a的脂质体-人工模拟类囊体膜,用负电荷表面活性剂DHP,正电荷表面活性剂DODACA在一定范围内来改变膜上的电荷的电性及电量,测定了藻蓝蛋白和人工类囊体膜不同情况下的吸收光谱和低温荧光光谱,研究二者之间能量传递,发现静电作用引起能量传递效率的变化。
5 展望
根据能量传递的研究进展,可以得到以下结论:(1)藻胆体中各藻胆蛋白组分在能量传递中起着重要作用,能量传递的效率不仅与各组分的位置有关,还同它们相互之间光谱的匹配程度有关。各组分在能量传递中的贡献会随着外界环境变化而改变,随着环境的变化传递路径会做出相应调整;藻胆体与类囊体膜之间的能量传递不总是单一机制发挥作用,而是多种机制共同参与,只是所占的比例不同;(2)藻胆体与类囊体膜之间的能量传递规律为探索藻胆体与高等植物类囊体之间的能量传递提供了一定的理论基础。藻胆蛋白能够将吸收的光能传递给高等植物的类囊体PSⅡ;不同高等植物类囊体结构略有差别,因此,藻胆蛋白与高等植物类囊体的光能传递效率有所差别;不同的藻胆蛋白向高等植物类囊体光能传递效率不同。
随着藻胆体各组分在光能傳递中的作用逐渐清晰,人们发现藻胆蛋白是可以将能量传递给高等植物类囊体。藻胆体能够吸收500~650 nm的黄绿色光,而高等植物缺乏藻胆体不能吸收这部分光,人们设想如果将藻胆体或藻胆蛋白与高等植物类囊体组合到一起,将有可能扩大高等植物的光吸收范围,提高光合作用效率,从而达到提高作物产量的目的。有人期望用转基因技术将藻胆蛋白转到经济作物或没有藻胆蛋白的经济海藻中去,构成新的光反应系统。目前,利用基因工程手段对藻胆蛋白体外重组进行组合生物合成的研究越来越多。美国加州大学Glaszer与其合作者发表了重要论文和专利[44],首次实现了具有捕光功能的集胞藻(Synechocystis sp.PCC 6803)藻蓝蛋白α亚基在大肠杆菌(E-scherichia coli)中的异源表达,证明了藻胆蛋白生物合成相关酶在E.coli中是可以表达的,而且各组分在异源细胞中可以实现自我组装,随后又成功表达了具有荧光活性的藻红蓝蛋白。杨雨[45]在体外成功合成了具有光学活性的别藻蓝蛋白α亚基。关翔宇等[46]首次实现了在大肠杆菌中利用一个载体完成多个基因的组合生物合成,提供了一种方便高效表达和纯化光学活性藻胆蛋白的新策略。于平等[47]同样将5个基因构建于一个表达载体,成功表达了极大螺旋藻的藻蓝蛋白α亚基。刁红丽等[48]通过大肠杆菌体内重组获得了具有光学活性的重组色素蛋白PCB-ApcA和PCB-CpcA,吸收光谱、荧光光谱以及锌电泳均表明,藻蓝胆素与脱辅基蛋白形成了正确的共价连接。苏平等[49]以鱼腥藻PCC7120为材料,应用体外重组和大肠杆菌体内重组的方法对ApcE、CpcB、PecB以及APC各亚基的生物合成进行了研究,其中利用脱辅基蛋白ApcE和ApcE(1-240) (含有蛋白ApcE氨基端的240个氨基酸)与PCB的体外重组时,通过多种实验方法证明ApcE(1-240)与PCB的连接是正确的共价连接,显示了特征藻胆蛋白的性质。Tang等[50]成功构建了最小的水溶性的色素结合单位,由ApcE((1-240)/Δ87-130) (在ApcE(1-240)的基础上去掉87-130位的氨基酸)和α-R-藻蓝蛋白RpcA(能结合4种不同的藻胆色素)在大肠杆菌内表达形成融合蛋白。ApcE((1-240)/Δ87-130)在不需要裂合酶的情况下,仍具有自我催化结合藻胆色素能力。这两种组分的色素结合区可以同时结合藻蓝胆素,也可同时结合藻红胆素,融合蛋白的吸收光谱和荧光光谱接近天然藻胆体。Avijit Biswas等[51]表达出光学活性别藻蓝蛋白亚基,发现ApcE的N端区域具有色素裂合酶的活性。衣俊杰等[52]分别实现了钝顶螺旋藻(Arthrospira platensis FACHB314)藻蓝蛋白α亚基和β亚基在体外的自催化重组,并且比较了不同藻蓝胆素裂合酶功能。发现α亚基和β亚基均可以在无裂合酶情况下,与藻蓝胆素进行自催化结合;另外在α亚基和β亚基在与不同裂合酶组合表达时产生藻蓝蛋白的荧光强度不同,其中α、β亚基(带有其自身启动子),裂合酶CpcE/F均存在时,表达的蛋白最接近天然藻蓝蛋白,且荧光强度最强。基于以上策略的成功,在高等植物及其他物种体内形成新的光反应系统具有极为乐观的前景。
参考文献
[1] Mullineaux Conrad W.Phycobilisome-reaction centre interaction in cyanobacteria[J].Photosynth.Research,2008,95(2-3):175-182.
[2] G Dong,F Liu X,Liu,et al.Significant energy transfer from CpcG2-phycobilisomes to photosystem I in the cyanobacterium Synechococcus sp.PCC 7002 in the absence of ApcD-dependent state transitions[J]. FEBS Letters, 2012,586(16):2342-2345.
[3] HN Su,B B Xie,X Y Zhang,et al.The supramolecular architecture,function,and regulation of thylakoid membranes in red algae:an overview[J].Photosynth. Res.,2010,106(1-2):73-87.
[4] MacColl R.Allophycocyanin and energy transfer[J]. Biochimica et Biophysica Acta,2004,1657(2):73-81.
[5] Yuichiro Shimada,Tohru Tsuchiya,Seiji Akimoto,et al. Spectral properties of the CP43-deletion mutant of Synechocystis sp.PCC 6803[J].Photosynth Res.2008,98(1):303-314.
[6] Ana Arteni,Lu-Ning Liu,Thijs Aartsma,et al.Structure and organization of phycobilisomes on membranes of the red alga Porphyridium cruentum[J].Photosynth.Res.,2008,95(2-3):169-174.
[7] Gao X,Zhang N,Wei T D,et al.Crystal structure of the N-terminal domain of linker LR and the assembly of cyanobacterial phycobilisome rods[J].Molecular Microbiology,2011,82(3):698-705.
[8] Bryant D A,Guglielmi G,Marsac N T,et al.The structure of Cyanobacterial phycobilisome:a Model[J].Arch, Microbiol.1979,123(2):113-127.
[9] MacColl R.Gyanobacterial phycobilisome[J].J.Struct. Chem.1998,124:311-334.
[10] 张建平,谢洁,赵井泉,等.多管藻中R-藻蓝蛋白能量传递途径及动力学[J].生物物理学报,2001,17(4):767-772.
[11] 乔木,邓志瑞,朱自安,等.发菜中红色蛋白的研究[J].北京理工大学学报,2007,27(8):728-739.
[12] Gingrich C J,Lundell D J,Glazer A N.Core substructure in Cyanobacterial phycobilisome[J].J.Cell. Biochem.,1983,22(1):1-14.
[13] Su X,Fraenkel P G,Bogorad L.Excitation energy transfer from phycocyanin to chlorophyll in an apcA-defective mutant of Synechocystis sp.PCC 6803[J].J.Biol. Chem.,1992,267(32):22944-22950.
[14] Zhao J Q,Xie J,Zhang J P,Xie Jie,et al.Energy transfer from C-phycocyanin to chlorophyll a in Triton X-100 reverse micelles[J].Colloids and Surfaces B: Biointerfaces,1998,11(1):9-14.
[15] 路荣昭,李凤平,顾天青,等. 嗜热蓝藻层理鞭枝藻藻胆体在解离过程中荧光发射光谱和光能传遞的研究[J].生物物理学报,1996,12(3):494-498.
[16] 赵福利,赵继全,张景民,等.红藻藻胆体内部蛋白间的能量传递研究I——人工合成R-PE/R-PC/APC复合物内的能量传递[J].中山大学学报:自然科学版,1998,37(6):62-66.
[17] 赵福利,赵继全,张景民,等.红藻藻胆体内部蛋白间的能量传递研究Ⅱ—— 人工合成复合物R-PE/R-PC以及R-PE/APC内的能量传递[J].中山大学学报:自然科学版,19 99,38(2):28-32.
[18] 赵福利,赵继全,张景民,等.红藻藻胆体内部蛋白间的能量传递研究III——人工合成复合物R-PC/ APC内的能量传递[J].中山大学学报:自然科学版,1999,38(4):20-23.
[19] Ye Li.Studies on Energy Transfer between Phycobiliproteins and Thylakoid Complex[J].Advanced Materials Research,2012,1464(343):748-752.
[20] Xiang Gao,Tian-DiWei,Nan Zhang,et al. Molecular insights into the terminal energy acceptor in cyanobacterial phycobilisome[J].Molecular Microbiology,2012,85(5):907-915.
[21] Andreas Busch,Jon Nield,Micheal Hippler.The composition and structure of photosystem I associated antenna from Cyanidioschyzon merolae[J].Plant J.,2010,62(5):886-897.
[22] Kumiko Kondo,Conrad W.Mullineaux,Masahiko.ikeuchi.Distinct roles of CpcG1-phycobilisome and CpcG2-phycobilisome in state transitions in a cyanobacterium Synechocystis sp.PCC6803[J].Photosynth.Res.,2009,99:217-225.
[23] Dong C X,Tang A H,Zhao J D,et al.ApcD is necessary for ef cient energy transfer from phycobilisomes to photosystem I and helps to prevent photoinhibition in the cyanobacterium Synechococcus sp.PCC 7002[J]. Biochim.Biophysica.Acta,2009,1787(9):1122-1128.
[24] Deng G P, Liu F,Liu X W,et al. Significant energy transfer from CpcG2-phycobilisomes to photosystem I in the cyanobacterium Synechococcus sp.PCC 7002 in the absence of ApcD-dependent state transitions[J].FEBS Letters,2012,586(16):2342-2345.
[25]Kuniko Koudo,Mitsunori Katayama,Masahiko Lkeuchi.Specific Interaction Between CpcG2-Phycobilisome and Photosystem I[B].Photosynthesis,2008.
[26] Zhang R,Li H,Xie J,et al.Estimation of relative contribution of “mobile phycobilisome”and “energy spillover”in the light-dark induced state transition in Spirulina platensis[J].Photosynth. Res.,2007,94(2-3):315-320.
[27] Li Donghui,Xie Jie,Zhao Jingquan,et al.Light-induced excitation energy redistribution in Spirulina platensis cells:“spillover ”or“mobile PBSs”[J].Biochim.Biophys.Acta,2004,1608(2-3):114-121.
[28]Makio Yokono,Akio Murakani,Seiji Akimoto.Excitation energy transfer between photosystem II and photosystem I in red algae:Larger amounts of phycobilisome enhance spillover[J].Biochim.Biophys.Acta,2011,1807(7):847-853.
[29] Li Heng, Li Donghui,Yang Shuzhei,et al.The state transition mechanism-simply depending on light-on and -off in Spirulina platensis[J].Biochim.Biophys. Acta,2006,1757(11):1512-1519.
[30] Zhang Rui, Xie Jie, Hu Chang chao,et al. Hydrogen ions could directly regulate the oligomerization state of photosystem I in intact Spirulina platensis cells[J].Chin Sci Bull,2008,53(2):317-320.
[31] 陳李萍.蓝藻状态转换分子调控机理研究[D].上海师范大学生命与环境科学学院,2009.
[32] Xu Xiu ling,Zhang Rui,Xie Jie,et al.New mechanism revealed for light-state transition in cyanobacterium Arthrospira platensis according to 77-K fluorescence kinetics[J].Chemical Biology,2012,57(11):1261-1265.
[33] Ma W,Wei L,Wang Q.The response of electron transport mediated by active NADPH dehydrogenase complexes to heat stress in the cyanobacterium Synechocystis 6803[J].Sci. China C Life Sci.,2008,51(12):1082-1087.
[34] Shuzhen Yang,Rui Zhang,Changchao H,et al.The dynamic behavior of phycobilisome movement during light state transitions in cyanobacterium Synechocystis sp.PCC6803[J]. Photosynth Res,2009,99(2):99-106.
[35] Xiu Ling Xu,Shuzhen Yang Jie Xie,et al. Kinetics and dynamics for light state transition in cyanobacterium Spirulina platensis cells[J].Biochemical and biophysical research communications,2012,422(2):233-237.
[36] 刘贤德,马为民,沈允钢.植物光合机构的状态转换[J].植物生理与分子生物学学报,2006,32(2):127-132.
[37] D Li.Probing connection of PBS with the photosystems in intact cells of Spirulina platensis by temperature-induced fluorescence fluctuation[J].Biochim.Biophys.Acta,2003,1557(2):35-40.
[38] Zhang Rui, Li Heng, Xie Jie,et al.Estimation of relative contribution of “mobile phycobilisome”and “energy spillover” in the light-dark induced state transition in Spirulina platensis[J]. Photosynth. Res.,2007,94(2-3):315-320.
[39] Weimin Ma,Liping Chen,Lanzhen Wei,et al. Excitation energy transfer between photosystems in the cyanobacterium Synechocystis sp. 6803[J].J.Lumin.,2008,128(9):546-548.
[40] B.H.Zhu,G.C.Wang,C.K.Tseng Interaction between Phycobilisomes from Porphyridium cruentum and Thylakoid Membranes from Gymnodinium sp. or Spinach[J].Russian Journal of Plant Physiology,2005,52(3):288-293.
[41] Wu X N,Zhou B C,Zeng C K. Excitation energy transfer in vitro between phycobiliproteins and thylakoid photosystem of higher plants[J].Chin.J.Oceanol. Limnol.,1992,10(4):340-346.
[42] 容寿榆,俞国强,单晓亮,等. 蓝藻藻胆体与菠菜光系统颗粒之间的能量传递[J].植物学报,1998,40(7):622-626.
[43] 俞国强,张辉,容寿榆. 藻蓝蛋白与含叶绿素a脂质体之间的能量传递[J].植物学报,1999,41(1):60-64.
[44] Tooley A J,Cai Y A,Glazer A N.Biosynthesis of a fluorescent cyanobacterial C-phycocyanin holo-a subunit in a heterologous host[J].PNAS,2001,98(19):10560-10565.
[45] Yang Y,Ge B S,Guan X Y,et al.Combinational biosynthesis of a ?uorescent cyanobacterialholo-a-allophycocyanin in Escherichia coli[J].Biotech.Lett.,2008,30(6):1001-1004.
[46] 關翔宇.藻蓝蛋白组合生物合成及蓝藻连接多肽生物进化研究[D].中国海洋大学海洋生命学院,2008.
[47] 于平,陆伟宏,励建荣.基于途径工程的极大螺旋藻藻蓝蛋白α亚基的生物合成农业生物技术学报,2010,18(3):501-507.
[48] 刁红丽,周婷,赵开弘.集胞藻ApcA和CpcA的体内生物重组研究武汉理工大学学报,2011,33(4):43-46.
[49] 苏平.蓝藻藻蓝蛋白和变藻蓝蛋白生物合成的研究[D].华中科技大学,2008.
[50] Tang K, Zeng X L,Yang Y. A minimal phycobilisome:Fusion and chromophorylation of the truncatedcore-membrane linker and phycocyanin[J]. Biochimica et Biophysica Acta, 2012,1817(7):1030-1037.
[51] Avijit Biswas,Yasmin M,Vasquez,et al.Dragomani,Biosynthesis of Cyanobacterial Phycobiliproteins in Escherichia coli:Chromophorylation efficiency and specificity of all bilin lyases from Synechococcus sp.PCC 7002[J].Applied and environmental microbiology,2010,76(9):2729-2739.
[52] 衣俊杰. 螺旋藻藻蓝蛋白的自催化重组及藻蓝胆素裂合酶功能比较研究[D].中国海洋大学海洋生命学院,2010.
