槟榔多糖的抗氧化活性及其对细胞内氧化损伤抑制作用的研究
2015-05-30唐敏敏等
唐敏敏等
摘 要 研究了槟榔多糖粗提物(ASP)的抗氧化活性及其对人皮肤成纤维细胞(HSF)内氧化损伤的抑制作用。结果表明:利用超声波辅助法提取的槟榔子多糖经初步去杂质后,具有良好的1,1-二苯基-2-三硝基苯肼(DPPH·)清除能力、二价铁螯合能力和三价铁还原力。在对HSF细胞内氧化损伤的抑制作用研究中,当过氧化氢(H2O2)处理浓度为150 μmol/L、ASP添加浓度为20 μg/mL时,HSF细胞存活率上升至93.15%,与对照组差异不显著(p<0.05);当短波紫外线照射强度为100 μW/cm2、照射时间为3.5 h、ASP添加量为20 μg/mL 时,HSF细胞存活率上升至82.92%,与对照组差异不显著(p<0.05)。因此,ASP具有抑制H2O2和短波紫外线处理对HSF细胞造成的氧化损伤的作用。
关键词 槟榔多糖;抗氧化;抗细胞内氧化损伤
中图分类号 S792.91 文献标识码 A
Abstract The in vitro antioxidant activities and protective effects on human skin fibroblasts(HSF) of crude polysaccharides from Areca catechu L. seed were evaluated. The initially purified ASP had good DPPH radical scavenging acitivity,ferrous ions chelating capacity and strong reducing power. Cell culture results indicated that HSF(damaged by H2O2 or UV C) treated with ASP exhibited better cellular morphology and higher cell variability compared with the negative control group,and the protective effects were stronger with a supplemented ASP dose in the experimental range.
Key words Polysaccharides from Areca catechu L. seed;Antioxidant activities;Protective effects
槟榔(Areca catechu L.)是棕榈科槟榔属植物,为多年生常绿乔木,广泛分布于中非、南亚和东南亚等国家。中国也是重要的槟榔产地之一,主要集中在海南、台湾、广东等省份。槟榔果中含槟榔油、生物碱、多酚、色素等多种化学物质,具有泻气消水、杀虫去积[1]、抑菌消炎[2]、杀精抑排卵[3]、保护肝脏[4]等药理作用,入药历史悠久。
槟榔是海南省热带作物中仅次于橡胶的第二大经济作物。然而中国的槟榔加工技术水平目前处于初级加工阶段,缺乏高附加值产品,严重影响了槟榔产业的收益。另一方面,有关于槟榔致癌的研究报道[5],即对槟榔的褒贬看法不一。因此,探索槟榔的功能成分及其生理活性,科学地评价槟榔的生理功能作用,对促进槟榔产业的可持续发展具有重要意义。
多糖是广泛存在于动物、植物和微生物中的一类碳水化合物,因其具有独特的物理化学特性和生物活性而越来越受到人们的关注和重视。迄今为止,大量研究结果表明多糖具有广泛的药理活性,如免疫调节[6]、抗肿瘤[7]、防紫外线[8]、降低血糖血脂、抗氧化、抑制溃疡、造血[9]等。目前,关于槟榔活性成分的研究主要集中在生物碱、多酚、色素等方面,而关于槟榔多糖的研究鲜有报道。
笔者主要研究ASP的体外抗氧化活性及其对人体皮肤成纤细胞内氧化损伤的抑制作用,以期为槟榔的精深加工提供理论支持。
1 材料与方法
1.1 材料
1.1.1 植物材料及预处理 5月龄的槟榔(Areca catechu L cv. Reyan No.1)果实摘自中国热带农业科学院椰子研究所槟榔种质基地,去壳后的种子经冷冻干燥后,保存于干燥器中备用(1个月内使用)。
1.1.2 药品和试剂 1,1-二苯基-2-三硝基苯肼(DPPH·)、Ferrozine试剂购自Sigma公司;高糖改良杜氏伊格尔培养基(DMEM)、胎牛血清购自浙江天杭生物科技有限公司;其他分析纯试剂均购自国药集团化学试剂有限公司。
1.1.3 主要仪器设备 超声波细胞破碎仪(型号:XO-650D)均购自南京先欧仪器制造有限公司;紫外可见分光光度计、二氧化碳培养箱(型号:WJ-1851)均购自上海三腾仪器有限公司;全自动荧光免疫分析仪(型号:VarioskanFlash)购自赛默飞世尔科技(中国)有限公司。
1.2 方法
1.2.1 ASP的制备 将干燥的槟榔种子磨碎,过200目筛后置于烧杯中,加入15倍体积的蒸馏水,于超声波细胞破碎仪内进行多糖提取,提取超声波功率为400 W,提取时间为8 min,于9 000 r/min条件下离心10 min,重复提取2次(在冰浴条件下提取以保持提取系统的温度在55 ℃以下);合并上清液,通过真空旋转蒸发将其浓缩至原来体积的1/4,加入4倍体积的无水乙醇沉淀过夜;所得到的沉淀用无水乙醇、丙酮和乙醚进行清洗,加入少量的去离子水进行冻干后得到ASP,于-20 ℃保存备用。
1.2.2 槟榔多糖抗氧化能力测定 (1)ASP对DPPH·的清除率测定:参照文献[10]的方法,分别吸取2 mL不同浓度的ASP溶液与等体积的0.14 mmol/L的DPPH无水乙醇溶液于试管中,混匀,室温下暗处放置30 min后,在517 nm波长下测定吸光值。以水溶性维生素C(Vc)作阳性对照。DPPH自由基清除率按照下列公式计算:
清除率/%=(1-Asample 517/Acontrol 517)×100
(2)ASP对三价铁离子的还原力测定:参照文献[11]的方法,稍有改动。于0.5 mL不同浓度的ASP溶液中分别加入1 mL pH为 6.8的0.2 mol/L磷酸缓冲液和 2 mL 1%的铁氰化钾溶液,混匀,于50 ℃水浴中反应20 min;加入1 mL 10%的三氯乙酸溶液终止反应后,加入0.5 mL 0.1%的三氯化铁显色,稳定10 min;于700 nm波长下测定吸光值。吸光值越大,还原力越强。以Vc作阳性对照。
(3)ASP对二价铁离子螯合力测定:参照文献[11]的方法,略有改动。分别于1 mL 不同浓度的ASP溶液中加入0.1 mL 300 μmol/L的二氯亚铁溶液,反应30 s后,加入 0.1 mL 5 mmol/L Ferrozine 溶液,混匀后室温反应10 min,于562 nm处测定吸光值。以乙二烯四乙酸二钠(EDTA-2Na)作阳性对照。
螯合率/%=(1-Asample 562/Acontrol 562)×100
1.2.3 ASP对HSF细胞内氧化损伤的保护作用 (1)HSF的培养:将HSF细胞培养于含10%胎牛血清的DMEM高糖培养基中,培养条件为5%CO2,温度37 ℃,饱和湿度。
(2)对过氧化氢诱导的HSF细胞内氧化损伤的保护作用:采用文献[12]的方法,稍有改动。当细胞处于对数生长期时,用0.25%的胰酶消化后再用吸管吹打成单细胞悬液,以1×104个/mL的密度接种于96孔板中,过夜培养。实验分为对照组、阴性对照组、ASP保护组。对照组:不做任何处理,培养24 h;阴性对照组:用含终浓度为150 μmol/L 的H2O2培养基培养24 h;ASP保护组:用含150 μmol/L H2O2及不同浓度ASP(5、10、20 μg/mL)的培养基培养24 h。培养结束后,采用MTT法测定细胞存活率。
(3)对短波紫外线诱导的HSF细胞内氧化损伤的保护作用:采用文献[13]的方法,稍有改动。当细胞处于对数生长期时,用0.25%的胰酶消化后再用吸管吹打成单细胞悬液,以2×105个/mL的密度接种于35 mm的细胞培养皿中,过夜培养。实验分为正常对照组、阴性对照组、ASP保护组(ASP添加浓度分别为5、10、20 μg/mL)。实验分组后,吸除各细胞培养皿中的培养液,用PBS冲洗一次后加入700 μL PBS覆盖底面以避免干燥。阴性对照组和ASP保护组于18 W紫外灯下照射3.5 h,照射强度为100 μW/cm2;正常对照组不经过紫外照射。紫外照射结束后,采用MTT法测定各组细胞存活率。
(4)细胞存活率的测定:采用MTT法[12],略有改动。待分组处理的细胞结束培养后,加入5 mg/mL的MTT 20 μL,于37 ℃孵育4 h,吸除上清液,加150 μL DMSO,振荡10 min,使结晶物充分融解,于550 nm波长下测定各孔吸光度(A)。假设正常对照组的细胞存活率为100%。
细胞存活率/%= Asample/Acontrol×100
1.3 数据分析
体外抗氧化活性试验设3个重复,细胞存活率实验设8个重复,实验结果表述用平均值±标准偏差,采用 SPSS 16.0中的Duncan 法进行显著性分析,用Excel 2007作图。
2 结果与分析
2.1 ASP的体外抗氧化作用
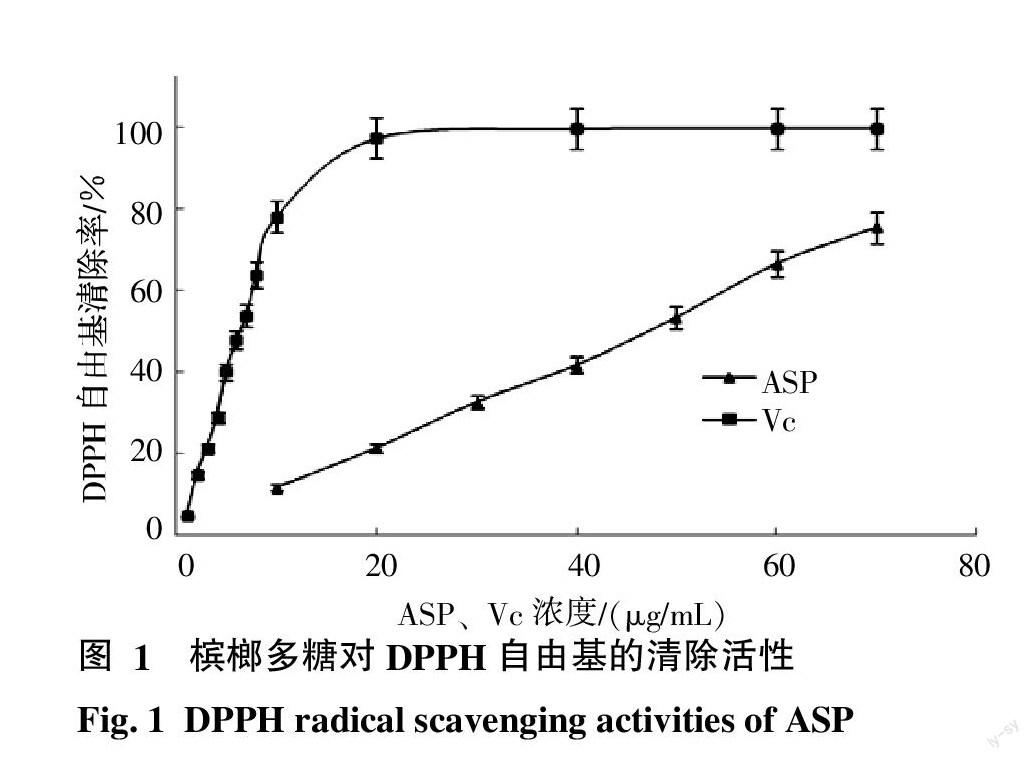
2.1.1 对DPPH·的清除活性 如图1所示,ASP对DPPH自由基的清除率随着浓度的增加而逐渐升高,而Vc的浓度为20 μg/mL时,DPPH自由基清除率基本达到100%。通过线性回归分析可知,在0~70 μg/mL 浓度范围内,ASP对DPPH·的清除率与浓度呈线性正相关(y=1.08x+0.24,R2=0.998 0);在0~7 μg/mL范围内,Vc对DPPH·的清除率与浓度也呈线性正相关(y=8.27x+2.94,R2=0.994 9)。ASP的EC50值为46.26 μg/mL,换算成Vc当量为 0.12 μg/mL,说明ASP对DPPH·的清除能力良好。
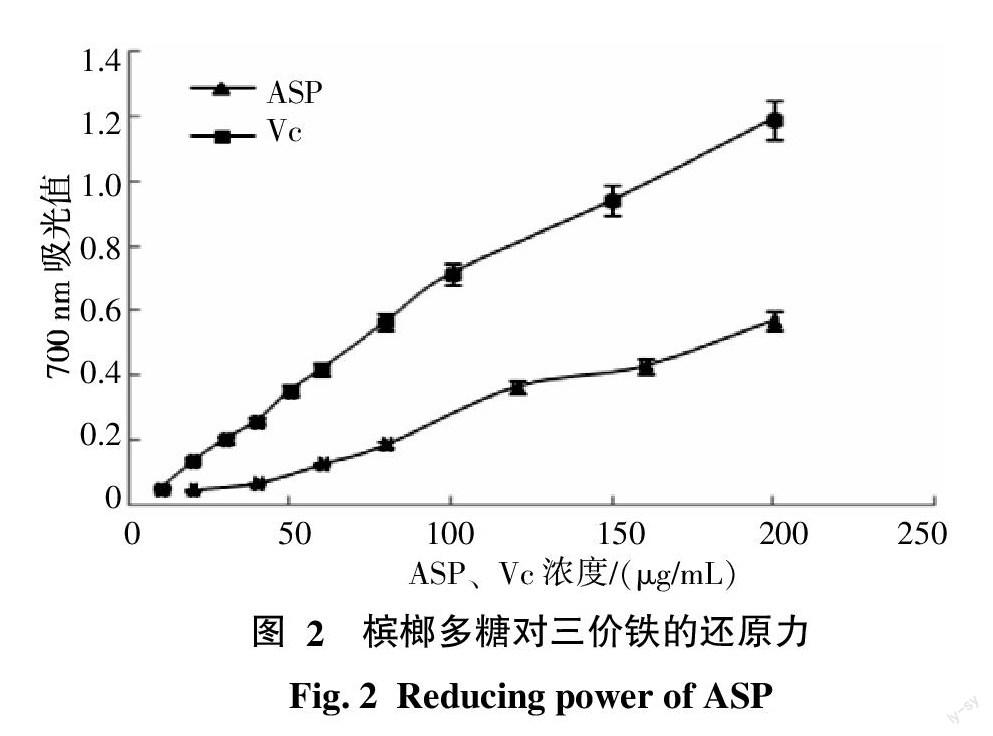
2.1.2 对三价铁的还原力 如图2所示,在实验测定范围内,ASP和Vc对三价铁的还原力均具有浓度依赖性,随着浓度的升高而逐渐增强。通过线性回归分析,得到两者对三价铁还原力的线性浓度范围分别为0~200、0~100 μg/mL,线性公式分别为y=0.003 1 x+0.056 5、y=0.007 3 x+0.018 2,R2分别为0.994 9、0.998 6。实验结果表明ASP具有一定的三价铁还原能力。
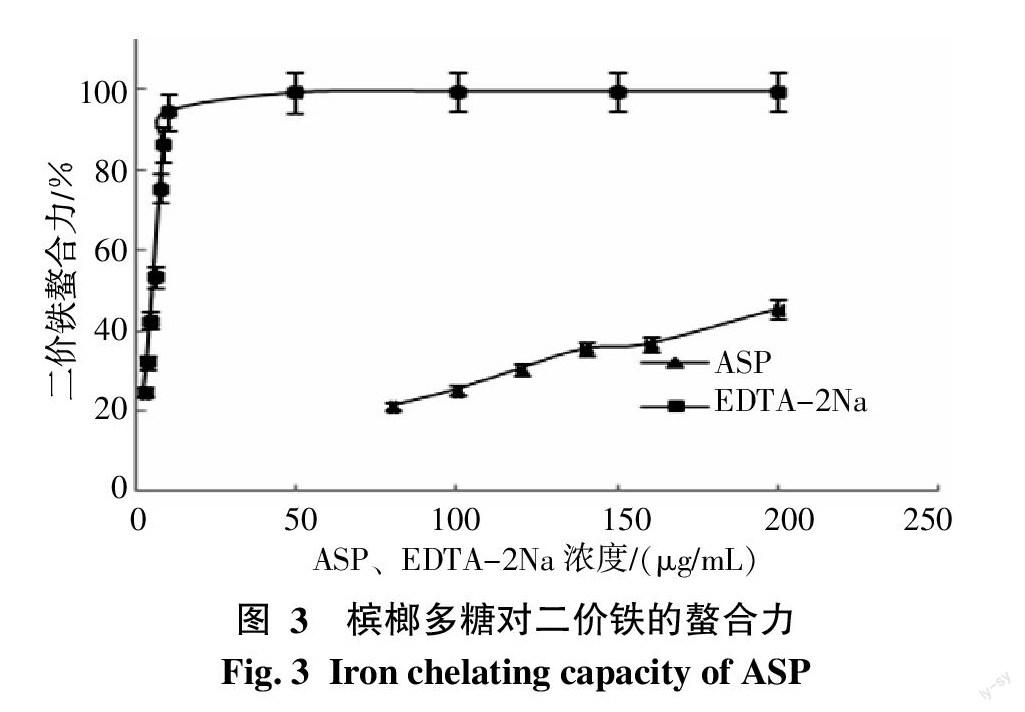
2.1.3 二价铁离子螯合力 图3列出了ASP和EDTA-2Na对二价铁离子的螯合能力。在实验测定范围内,二价铁离子的螯合能力随ASP浓度的增加呈线性升高趋势,线性公式为y=0.390 9x+11.772(R2=0.994 9)。而在0~9 μg/mL范围内,EDTA-2Na对二价铁离子的螯合能力也与其浓度呈正相关(y=10.451 0x+8.495 4,R2=0.997 4)。通过计算得出,ASP的EC50值为97.79 μg/mL,换算成EDTA-2Na当量为 0.04 μg/mL。
2.2 ASP对HSF 细胞内氧化损伤的保护作用
2.2.1 对过氧化氢诱导的HSF 细胞内氧化损伤的保护作用 为建立H2O2对HSF细胞的氧化损伤模型,采用150 μmol/L的H2O2处理HSF细胞24 h,结果如图4所示。在倒置显微镜下,正常的人皮肤成纤维细胞为梭状,细胞形态规则、饱满。阴性对照组的细胞被H2O2损伤,形态发生变化,逐渐变圆、皱缩;而经ASP保护后,损伤的形态逐渐恢复正常,当ASP浓度为20 μg/mL时,被损伤细胞已接近正常细胞的形态(图4-A)。细胞存活率实验结果表明,用H2O2处理HSF细胞24 h后细胞存活率明显降低,仅为正常对照组的48.21%,而添加ASP能明显提高被H2O2损伤的HSF细胞的存活率,而且与ASP浓度呈现量效关系。ASP的添加浓度为5 μg/mL时,细胞存活率为69.68%,显著高于阴性对照组(p<0.05);当ASP的浓度分别增加至10、20 μg/mL时,细胞存活率均增长至80%以上(图4-B),并且与对照组无显著差异(p<0.05)。这表明ASP可以抑制H2O2诱导的HSF细胞内氧化损伤。
2.2.2 对短波紫外线诱导的HSF细胞内氧化损伤的保护作用 采用短波紫外线诱导细胞内氧化损伤,研究ASP对HSF细胞的保护作用,结果如图5所示。由图5-A可知,ASP可以在一定程度上保护短波紫外线处理的HSF细胞微观形态。在细胞存活率实验中,经短波紫外线照射的HSF细胞存活率降低至正常组的48.18%。当ASP添加量为20 μg/mL时,HSF细胞存活率上升至82.92%,与正常对照组无显著性差异(p<0.05);而低浓度(5、10 μg/mL)ASP不能显著改善存活率(图5-B)。结果表明一定浓度的ASP可以抑制短波紫外线诱导的HSF细胞内氧化损伤。
3 讨论与结论
活性氧代谢失调是自由基大量产生的主要途径。自由基生物学研究认为,许多疾病的发生与自由基导致的大分子功能障碍如蛋白质修饰、脂质过氧化以及DNA损伤等有关[14]。目前有多种方法均可评价某种化学成分是否具有抗氧化性。本研究通过DPPH自由基清除能力、二价铁螯合力、三价铁还原力的强弱对ASP的体外抗氧化能力进行了评价,发现其具有良好的抗氧化活性,这与其他多种植物中多糖的研究结果比较一致[15-17]。有研究表明,还原力的强弱与抗氧化剂中含有的还原酮有关,因为还原酮可以贡献氢自由基,打破原有的自由基链,进而发挥抗氧化作用;还原酮还可以与一些过氧化物的前体发生反应,阻止过氧化反应的进行[18]。二价铁离子螯合能力则与分子结构中含有的-OH、-SH、-COOH、-PO3H2、CO、-NR2、-S-和-O-等官能团有关,因此可以推断ASP中含有以上一种或几种官能团。
H2O2和紫外辐射是重要的氧化应激源,进入人体后,可打破内部的氧化-还原平衡,超氧阴离子自由基、羟基自由基、氮氧自由基和单线态氧等活性氧大量表达,引起脂质过氧化、DNA损伤等,进而导致机体病变[19]。在细胞存活率实验中,ASP能够改善HSF细胞形态、显著提高细胞存活率,有效地抑制H2O2和短波紫外线对该类细胞造成的氧化损伤。经分析可知,ASP能够抑制细胞内的氧化损伤可能与槟榔多糖具有良好的抗氧化性有关。另一方面,多糖及其复合物的生物活性大多与其化学组成、分子量、官能团的位置、糖苷键的类型及提取分离的方法等因素有关[19],所以关于ASP的结构及其发挥抗氧化作用的机理还需要进一步深入研究。
参考文献
[1] 张渝渝, 杨大坚, 张 毅. 槟榔的化学及药理研究概况[J]. 重庆中草药研究, 2014(1): 37-41, 44.
[2] Khan S, Mehmood M H, Ali A N A, et al. Studies on anti-inflammatory and analgesic activities of betel nut in rodents[J]. Journal of Ethnopharmacology, 2011, 135(3): 654-661.
[3] Shrestha J, Shanbhag T, Shenoy S, et al. Antiovulatory and abortifacient effects of Areca catechu(betel nut) in female rats[J]. Indian Journal of Pharmacology, 2010, 42(5): 306-311.
[4] Pithayanukul P, Nithitanakool S, Bavovada R. Hepatoprotective potential of extracts from seeds ofAreca catechuand nutgalls of Quercus infectoria[J]. Molecules, 2009, 14(12): 4 987-5 000.
[5] Li W C, Lee P L, Chou I, et al. Molecular and cellular cues of diet‐associated oral carcinogenesis-with an emphasis on areca-nut-induced oral cancer development[J]. Journal of Oral Pathology & Medicine, 2014, DOI: 10. 1111/jop. 12171.
[6] Wijesekara I, Pangestuti R, Kim S K. Biological activities and potential health benefits of sulfated polysaccharides derived from marine algae[J]. Carbohydrate Polymers, 2011, 84(1): 14-21.
[7] Zong A Z, Cao H Z, Wang F S. Anticancer polysaccharides from natural resources: A review of recent research[J]. Carbohydrate Polymers, 2012, 90(4): 1 395-1 410.
[8] Widel M, Krzywon A, Gajda K, et al. Induction of bystander effects by UVA, UVB, and UVC radiation in human fibroblasts and the implication of reactive oxygen species[J]. Free Radical Biology and Medicine, 2014, 68: 278-287.
[9] Jin M, Zhao K, Huang Q, et al. Isolation, structure and bioactivities of the polysaccharides from Angelica sinensis (Oliv.)Diels: A review[J]. Carbohydrate Polymers, 2012, 89(3): 713-722.
[10] Liu D M, Sheng J W, Li Z J, et al. Antioxidant activity of polysaccharide fractions extracted from Athyrium multidentatum (Doll.)Ching[J]. International Journal of Biological Macromolecules, 2013, 56: 1-5.
[11] Jiang C X, Xiong Q P, Gan D, et al. Antioxidant activity and potential hepatoprotective effect of polysaccharides from Cyclina sinensis[J]. Carbohydrate Polymers, 2013, 91(1): 262-268.
[12] Giampieri F, Alvarez-Suarez J M, Mazzoni L, et al. Polyphenol-rich strawberry extract protects human dermal fibroblasts against hydrogen peroxide oxidative damage and Improves mitochondrial functionality [J]. Molecules, 2014, 19(6): 7 798-7 816.
[13] Widel M, Krzywon A, Gajda K, et al. Induction of bystander effects by UVA, UVB, and UVC radiation in human fibroblasts and the implication of reactive oxygen species[J]. Free Radical Biology and Medicine, 2014, 68: 278-287.
[14] 张桂芝, 耿 莎, 杨海燕, 等. 植物抗氧化成分的研究进展[J]. 食品科学, 2008, 28(12): 551-553.
[15] Zhang Z F, Lü G Y, Pan H J, et al. Antioxidant and hepatoprotective potential of endo-polysaccharides from Hericium erinaceus grown on tofu whey[J]. International Journal of Biological Macromolecules, 2012, 51(5): 1 140-1 146.
[16] Wu G H, Hu T, Li Z Y, et al. In vitro antioxidant activities of the polysaccharides from Pleurotus tuber-regium (Fr.) Sing.[J]. Food Chemistry, 2014, 148: 351-356.
[17] Fan J L, Wu Z W, Zhao T H, et al. Characterization, antioxidant and hepatoprotective activities of polysaccharides from Ilex latifolia Thunb[J]. Carbohydrate Polymers, 2014: 101, 990-997.
[18] Kong F L, Zhang M W, Liao S T, et al. Antioxidant activity of polysaccharide-enriched fractions extracted from pulp tissue of Litchi Chinensis sonn[J]. Molecules, 2010, 15(4): 2 152-2 165.
[19] 宗万松. 环境氧化应激诱发蛋白质(多肽)氧化损伤评价新方法的研究[D]. 济南: 山东大学, 2011.
