南昌地区女性宫颈细胞中人乳头瘤病毒感染基因型的回顾分析
2015-05-10梁华余艺萍蓝毓红付向春刘春菊李玮婷杨军平
梁华,余艺萍,蓝毓红,付向春,刘春菊,李玮婷,杨军平
(江西中医药大学附属医院检验科,江西 南昌330006)
目前全球每年约有27万例女性死于宫颈癌,宫颈癌已经成为女性第二常见的恶性肿瘤,其发病率仅次于乳腺癌[1],人乳头瘤病毒(HPV)感染是宫颈癌发生的必要条件,研究证实99%的宫颈癌病例与生殖系统HPV感染有关[2]。HPV是一种微小的双链闭环DNA病毒,迄今为止已经发现200多种基因型,其中50多种与生殖道感染相关[3]。目前,HPV基因分型检测作为临床筛检宫颈癌的有效方法,已经受到越来越多的关注[4]。而对于不同种族不同地区不同感染人群来说HPV亚型分布也会存在差异,明确在某特定区域HPV的感染率及型别分布差异能为该地区宫颈癌防治和流行病学调查提供依据,同时对开发HPV疫苗也能发挥积极的指导意义。本研究回顾分析了2014年1月到2015年6月在本院妇科门诊就诊的患者宫颈细胞HPV基因分型检测结果,以了解该地区HPV感染率、21种基因型分布与年龄的关系。
1 材料与方法
2014年1月至2015年6月本院妇科门诊就诊的2659例女性,年龄16~84岁,平均年龄40.5±10.3岁。
1.1 仪器与试剂 PE9600型PCR扩增仪为美国PE公司产品,HybriMax医用核酸分子快速杂交仪为广东凯普公司自主研发。HPV-DNA基因组提取试剂盒、PCR扩增试剂盒和核酸分子快速杂交试剂盒(21种基因型)均为广东凯普公司产品。
1.2 方法
1.2.1 标本采集与保存 标本采集在非月经期,1天内禁性生活,3d内禁阴道用药或冲洗。先以扩阴器暴露宫颈,用棉拭子将宫颈口过多的分泌物擦去。采用专用的宫颈脱落细胞采集器中的宫颈刷伸入宫颈口处,顺时针旋转3~5周以获取足量的上皮细胞样本,再将宫颈刷头部放入装有细胞保存液的样本管中,在管口处将多余的刷柄折断,旋紧样本管盖,做好标记,立即送检,或置于-20℃冰箱保存待检。
1.2.2 DNA提取 将带有刷头的样本管在漩涡振荡器上充分振荡混匀后,吸取0.5ml细胞保存液于Eppendorf离心管中,14000r/min离心1min,吸弃上清液,留下管底细胞。向每管加入0.4ml细胞裂解液A,充分振荡混匀后放入100℃金属浴中15 min,取出后再依次加入0.4ml细胞裂解液B,轻柔混匀后,14000r/min离心5min,小心吸弃上清液,待管底沉淀晾干,最后向每管加入60μl无菌双蒸水,混匀后,14000r/min离心3min,取上清液作为PCR反应的DNA模板。
1.2.3 PCR扩增 按照扩增试剂盒说明书配置PCR反应混合液,每管加入上述提取的待检DNA模板1.0μl,同时设置阳性对照品、H2O(阴性对照),点动离心,立即放入PCR扩增仪进行扩增反应。PCR循环参数为:95℃预变性9min,进入循环部分,95℃变形 20s,55℃退火 30s,72℃延伸 30 s,共40个循环,最后72℃5min,扩增结束,产物放4℃保存。
1.2.4 导流杂交 杂交前需将PCR产物放入PCR仪中95℃变性至少5 min,立即取出放入冰盒中冰浴至少2 min,从而使扩增后的双链产物变性为单链DNA后才能与杂交膜上的单链探针进行杂交。打开杂交仪,调好温度,依次放好金属板、分隔膜、杂交膜、硅胶圈、分割室、压扣盖,将变性好的PCR产物依次全部加入到上述杂交仪内,按照凯普公司提供的导流杂交步骤进行杂交操作。
1.3 统计学处理 使用SPSS13.0进行统计学分析,阳性率的比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 HPV基因型分布 在2659例患者中,共有708例检出HPV基因,阳性率为26.60%;鉴于这708例患者中或存多重感染基因亚型的情况,故统计出HPV总阳性计数为970例,总阳性率为36.48%;其中812例为高危型HPV,阳性率为30.53%;158例为低危型HPV,阳性率为5.94%。本研究中21种HPV基因型别均有检出,其中高危型HPV从高到低前五位依次为 HPV52、HPV16、HPV58、HPV39和HPV53型;低危型HPV前三位依次为HPV81、HPV6和HPV11型,见表1。
2.2 不同年龄组HPV基因型分布 从表1可以看出,低危型HPV阳性率<20岁组(20.0%)、≥65岁组 (12.5%)、60~<65 岁组 (7.55%) 和 20~<30 岁组(6.64%)居前四位;高危型HPV阳性率<20岁组(46.67%)、 ≥65 岁 组 (45.83%)、20 ~<30 岁 组(35.25%)、50~<60 岁组 (32.99%) 和 40~<50 岁组(29.0%)居前五位。另外,无论在高危型HPV还是低危型HPV阳性者中,均以20~<30岁年龄组最高(276例和52例);在高危型HPV阳性者中,<20岁组、20~<30 岁组、30~<40 岁组、40~<50 岁组、50~<60岁组、≥65岁组共6个年龄组最常见的基因型为HPV52型,在低危型HPV阳性者中,20~<30 岁组、30~<40 岁组、40~<50 岁组、50~<60 岁组共4个年龄组最常见的基因型为HPV81型。从各年龄组总阳性率来看,差异均无统计学意义 (P<0.05)。
2.3 单一HPV和多重HPV的感染分布 本研究同时探讨了在708例HPV阳性感染者中,单一感染与多重感染以及在各年龄组的分布。从表2可以看出,单一感染 (74.86%)明显高于多重感染(25.14%)。多重感染中以二重感染居多(19.07%),其次为三重感染(3.95%);在各年龄组别中,≥65岁组多重感染比率最高,达到20.83%(P<0.05),其次为20~<30岁组(8.17%),除外≥65岁组,其他各组之间互相比较,差异均无统计学意义(P>0.05)。见表2。
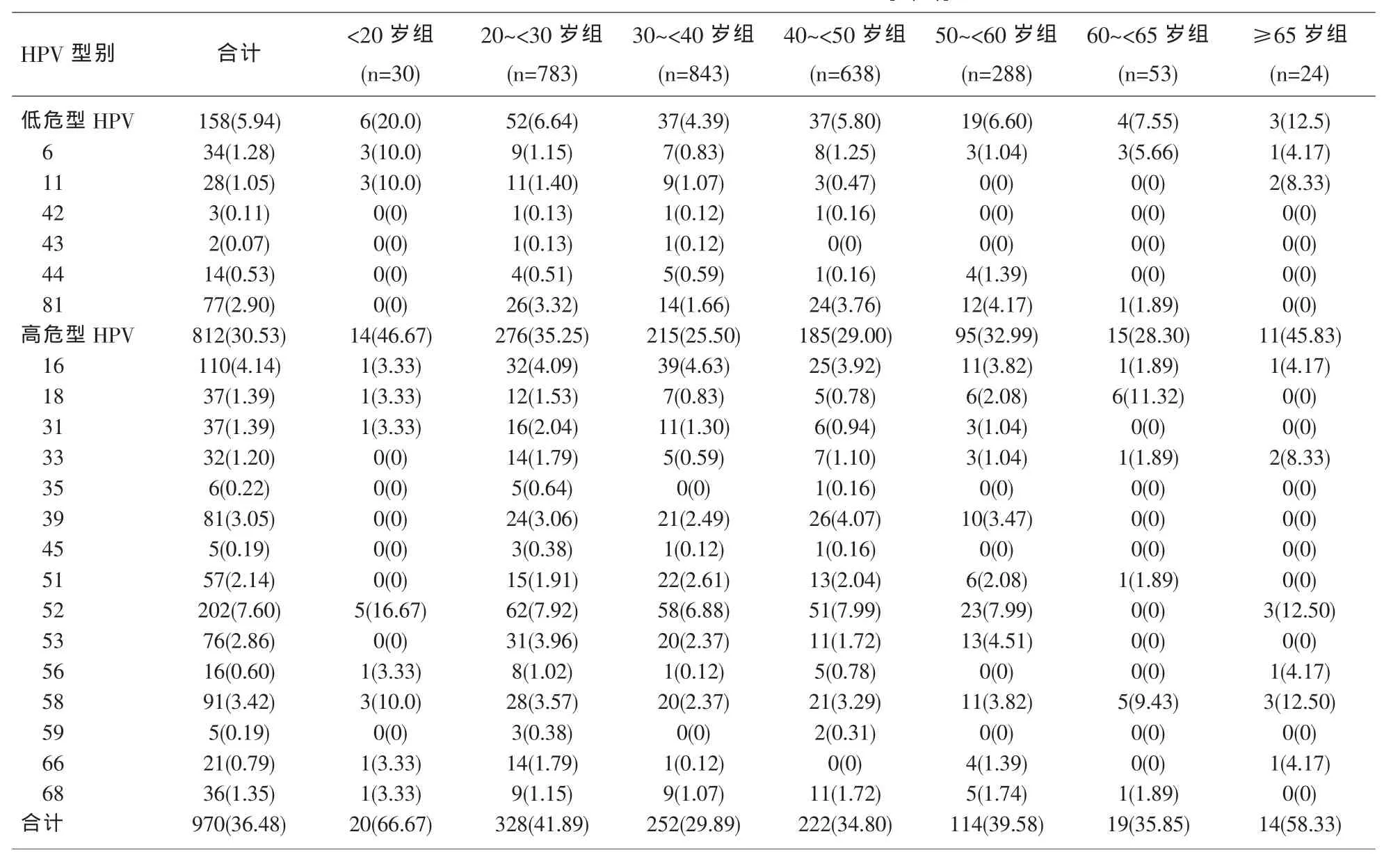
表1 708名HPV感染者HPV基因型及其年龄分布[n(%)]
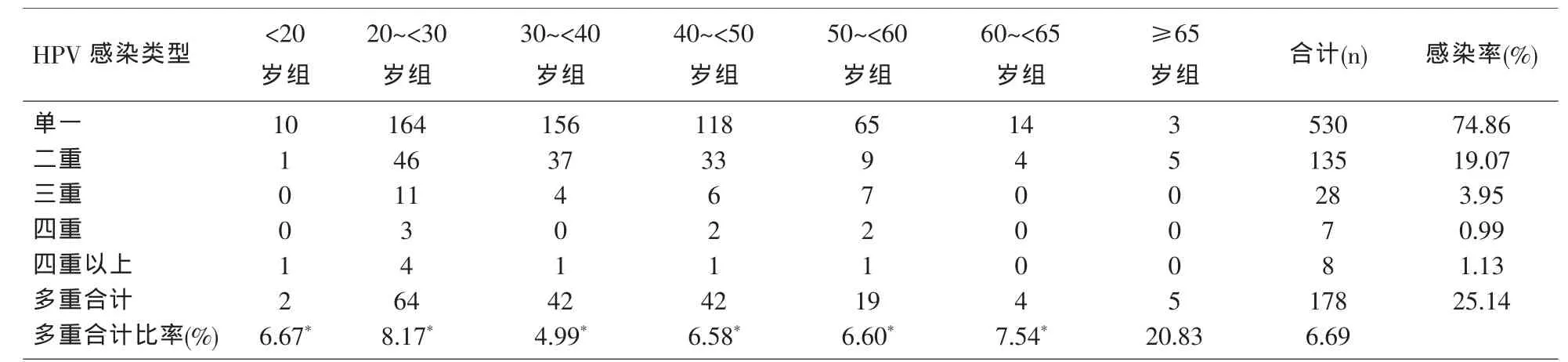
表2 708名HPV感染者单一感染和多重感染结果及其年龄分布
3 讨论
根据致宫颈癌和癌前病变的相关性,HPV可以分为高危型(high-risk)和低危型(low-risk),高危型HPV持续感染是女性宫颈癌发病的重要诱因。美国阴道镜和宫颈病理学会(ASCCP)建议,HPV基因分型检测可以作为HPV DNA阳性但细胞学阴性人群的分流管理工具,同时它还可以了解区域内HPV流行状况,为宫颈癌疫苗的研发和效果评估提供数据支撑。而HPV疫苗对疫苗病毒型别相关的宫颈癌前病变的保护效果几乎可达100%[2]。同时,不同地区感染的HPV基因型别有所不同。本研究显示,南昌地区HPV阳性率为26.60%,其中高危型HPV阳性率为30.53%,低危型HPV阳性率为5.94%,表明女性感染高危型HPV远远高于感染低危型HPV,故应加强本地高危型HPV感染监控。本地区居前六位的基因型依次为HPV52、16、58、39、81、53, 而国外报道的多以 16 或 18 型为主[5],其疫苗研制也主要针对这两个型别[6];这个结果与吴玉萍等在2005年报道统计的江西省宫颈癌患者 HPV 主要型别为 HPV16、58、33、31、18、66有较大差异[7],与王其国等[8]报道的山东某三县区 HPV 感染分布(HPV16、18、58、31、52)有较大差别,与邻近的衡阳地区相比(HPV16、52、58、81、53、18)同样存有较大差异[9],即便与同省的鹰潭地区相比(HPV52、43、58、16、6、56)结果也有较大的不同[10],但与方丽娟等报道的江西地区HPV感染型别(HPV52、16、58、33、53)基本一致[11],这可能与受检人群样本的差异性和检测方法不同造成。浙江的一项研究[12]则显示,该地区前三位HPV感染型别依次为HPV52、16、58型,与本研究结果相似,而一项福建的研究[13]表明,HPV52和33型是该地区最常见的型别,北京的一项研究[14]则显示高危型HPV感染以HPV58、16、52为主,均与HPV16是世界范围最常见感染型别且无地域差异的说法不一致。可见,感染HPV的任何基因型在人群和地域方面都有可能存在较大的差异。
HPV感染因年龄不同亦有所差异。本地区无论高危型HPV还是低危型HPV感染,<20岁组和≥65岁组比率为最高,各年龄组阳性率随年龄增长呈“U”型分布。另外,无论在高危型HPV还是低危型HPV阳性者中,均以20~<30岁年龄组最高(276例和52例)。这也符合我国宫颈癌发病年龄分布和呈现年轻化趋势的特点。在高危型患者中,有6个组别最常见基因型为HPV52型,而高危型HPV病毒持续感染是导致宫颈癌和癌前病变的直接原因。因此,早期积极开展HPV的感染检测和宫颈癌早期防治具有十分重要的意义。
本研究同时表明,HPV单一感染比例远高于多重感染。多重感染比例(25.14%)略高于衡阳地区HPV多重感染比例[9],主要以二重感染居多。在各个年龄组均可以检见多重感染的病例,虽然≥65岁组多重感染比率最高,但以20~<30岁年龄组多重感染阳性者最高。这可能与统计的阳性例数偏少有关。在所有多重感染病例中,最多的一例共检出了 8种 HPV 基因型, 分别为 HPV6、11、16、52、53、58、39、81型,这在国内外均比较少见。至于多重感染是否会增加罹患宫颈癌的发病率,目前尚有争议。杨晓华[15]等认为多重感染危险更大,更容易导致宫颈病变。
总之,宫颈癌的防控是一个系统工程,加强对HPV感染的筛查,以了解不同地区不同HPV感染基因型别的分布情况,为防治HPV相关疾病提供基础流行病学资料和我国疫苗研制提供重要的依据。
[1]尹一兵.分子诊断学[M].北京:高等教育出版社,2007:213-214.
[2]Ronco G,Segnan N.HPV testing for primary cervical cancer screening[J].Lancet,2007,370(9601):1740-1742.
[3]De Villiers EM.Human papillvirus infection in skin cancer[J].Biomed Phannacother,1998,52(1):26-33.
[4]Arbyn M,Snijders PJ,Meijer CJ,et al.Which high-risk HPV assays fulfil criteria for use in primary cervical cancer screening[J].Clin Microbiol Infect,2015,5:S1198.
[5]Mendoza LP,Arbiza J,Paez M,et al.Distribution of human papillomavirus genotypes in Paraguayan women according to the severity of the cervical lesion[J].JMed Virol,2011,83(8):1351-1357.
[6]Franco EL,Cuzick J.Cervical cancer screening following prophylactic human papillomavirus vaccination[J].Vaccine,2008,26(3):A16-23.
[7]吴玉萍,陈裕隆,李隆玉,等.宫颈癌患者人乳头瘤病毒(HPV)主要型别及其感染研究[J].病毒学报,2005,21(4):269-273.
[8]王其国,蔺国祥,杨文东,等.相邻三县区妇女感染人乳头瘤病毒分子流行病学分析[J].实验与检验医学,2013,31(4):317-319.
[9]曹清香,高红,唐清,等.衡阳地区女性感染21种型别人乳头瘤病毒现状分析[J].国际检验医学杂志,2014,35(14):1830-1832.
[10]朱红英,占葆娥,陈飞燕,等.鹰潭地区女性宫颈HPV感染率及其基因分型特点[J].国际检验医学杂志,2014,35(11):1419-1421.
[11]方丽娟,袁水斌,王刚,等.江西地区人乳头瘤病毒感染分型检测的研究[J].实验与检验医学,2013,31(2):181-182.
[12]Ye J,Cheng XD,Chen XJ,et al.Prevalence and risk profile of cervical human papillomavirus infection in Zhejiang province,south-east China:a population-based study[J].Virol J,2010,7:66-76.
[13]Wu DM,Cai L,Huang M,et al.Prevalence of genital human papillomavirus infection and genotypes among women from Fujian province,PR China[J].Eur JObstet Gynecol Reprod Biol,2010,151(1):86-90.
[14]曾昭瑛,李亚娜,苏建荣.1294例女性高危型人乳头瘤病毒基因分型结果回顾性分析[J].国际检验医学杂志,2015,36(6):796-800.
[15]杨晓华,秦晓红,夏凤英,等.成都农村地区女性宫颈HPV感染基因型别分布状况[J].中国医疗前沿,2012,7(3):82-83.
