射频消融联合肝动脉栓塞治疗巨大肝血管瘤的效果评价
2015-05-10宋晶晶赵中伟涂建飞纪建松高君
宋晶晶 赵中伟 涂建飞 纪建松 高君
·非血管介入·
射频消融联合肝动脉栓塞治疗巨大肝血管瘤的效果评价
宋晶晶 赵中伟 涂建飞 纪建松 高君
目的 探讨射频消融(RFA)联合肝动脉栓塞(TAE)治疗巨大肝血管瘤(直径≥10 cm)的可行性、安全性及有效性。方法 收集我院2007年10月—2015年5月期间,经TAE序贯RFA治疗15例患者15个巨大肝血管瘤的临床资料。回顾性分析其一般资料、RFA治疗策略、消融相关并发症、完全消融率、消融灶直径变化及复发情况等。结果 所有患者均成功完成RFA联合TAE治疗。TAE后血管瘤的平均直径从(13.0±2.2)cm缩小至(7.1±2.0)cm。RFA治疗后,14个血管瘤(93.3%)获得完全消融。RFA治疗后1个月,消融灶平均直径缩小至(6.1±2.0)cm;6个月后缩小至(4.9±1.6)cm。15例患者中,4例患者发生了6个消融相关并发症;根据Dindo-Clavien分级,均属轻微并发症(I级)。结论 RFA联合TAE治疗巨大肝血管瘤是安全、有效的;TAE可有效阻断血管瘤血供,使瘤体缩小,降低后续RFA治疗的难度,减少消融相关并发症。
血管瘤; 肝脏; 巨大; 射频消融; 栓塞
肝血管瘤是最常见的肝脏良性肿瘤[1-3]。多数肝血管瘤体积小且无临床症状,无需特殊治疗[3]。但若肝血管瘤直径≥5 cm,瘤体有继续增大趋势,或伴有临床症状,则需要积极治疗[4-5]。外科手术是治疗肝血管瘤最有效的方法,但手术创伤大、风险高,并发症的发生率(31.5%)和死亡率(3%)均较高[4-5]。
近年来,射频消融(radiofrequency ablation, RFA)越来越多地应用于肝血管瘤的临床治疗中,显示了其疗效确定、微创、安全等优点以及良好的应用前景[6-10]。RFA治疗大肝血管瘤(直径5~9.9 cm)的文献逐年增多,结论也较一致:认为RFA可以作为治疗大肝血管瘤的首选方案之一[6-10]。但RFA治疗巨大肝血管瘤(直径≥10 cm)的报道较少,且结论也不尽一致[9-10]。由于巨大肝血管瘤血供丰富,RFA治疗时需要较长的消融时间;消融相关并发症,尤其是溶血相关并发症的发生概率也随之增大[8-10]。因此,如能在RFA治疗前使巨大肝血管瘤瘤体缩小,就可解决消融相关并发症过多的问题。
经导管动脉栓塞(transcatheter arterial embolization,TAE)曾被尝试性地应用于肝血管瘤的治疗。但是,由于TAE后栓塞血管再通,导致肝血管瘤治疗后复发[11-12]。TAE虽然不能作为肝血管瘤的治愈性手段,但可作为手术治疗前的辅助性手段。文献报道,肝血管瘤手术治疗前,辅助性TAE治疗可减少术中出血、降低手术风险[13-14]。
从理论上来讲,RFA治疗前行TAE治疗,可以阻断肝血管瘤血流,缩小瘤体,降低消融难度[6-10,15]。本研究通过分析15例巨大肝血管瘤采用TAE序贯RFA治疗的相关资料,旨在探讨RFA联合TAE治疗巨大肝血管瘤的可行性、安全性及有效性。
资料与方法
一、一般资料
回顾性分析温州医科大学附属第五医院2007年10月—2015年5月期间,经TAE序贯RFA治疗的15例患者(15个)巨大肝血管瘤的临床资料。均符合以下治疗标准[8-10]:(1)与血管瘤相关的持续腹痛或腹部不适,经常规胃镜和肠镜检查,排除潜在的消化道疾病所引起的症状。(2)影像学随访2年期间,病灶直径增加>1 cm。(3)拒绝外科手术治疗的患者。本研究通过了温州医科大学附属第五医院伦理委员会的审核。
二、TAE治疗策略
采用Seldinger技术,经右侧股动脉途径穿刺置管,以5F-RH导管(Cook, Bloomington IN, USA)行超腹腔干和肠系膜上动脉造影,明确血管瘤的部位、大小、数量及肿瘤的供血动脉后,用3F微导管(Microferret®, Cook)行供血动脉超选择性插管,使导管头端进入血管瘤瘤体,先经导管或微导管注入2%利多卡因5 ml预防血管痉挛和止痛,然后注入平阳霉素(PYM®,浙江海正药业股份有限公司)与碘油(Lipiodol®, Andre Gurbet, Aulnay-sous-Bois, France)的混合乳剂,随后注入直径为1~2 mm的明胶海绵颗粒(Gelfoam®, Upjohn, Kalamazoo MI, USA)使血管瘤完全填充。每例患者平阳霉素用量为8 mg。栓塞结束后再次造影,观察评估血管闭塞的程度及残余灶染色情况。
三、RFA治疗策略
所有患者在TAE术后1月行CT引导下RFA治疗。射频发生器为美国RITA 1500X型,最大输出功率为250 W;选用StarBurst XLi-enhanced消融电极(RITA公司,美国),单点最大消融直径为7 cm。患者取仰卧位,CT平扫后确定最佳穿刺路径和穿刺点并作标记。局部麻醉后,将消融电极经穿刺点穿入肝脏,到达血管瘤病灶;再次行CT扫描,确定消融电极位置满意后开始消融治疗。
单点消融策略:从直径2 cm开始,当消融温度达到105℃时,依1 cm梯度逐渐增大消融直径,当至5 cm时,维持消融温度于105~115 ℃,5 min后,再视病灶情况逐渐增大消融直径至6 cm或者7 cm,维持消融温度于105~115 ℃,当输出功率降至30 W以下时,结束单点消融。
其他消融策略:(1)消融电极经过部分正常肝组织再刺入瘤体内,以防瘤体出血。(2)采用多点重叠消融策略,采取“先边缘,后中间”的方法,逐点重叠消融。(3)消融范围控制在肝血管瘤瘤体内,避免消融瘤体周围正常肝组织。(4)为预防穿刺道出血,在退出消融电极前对针道进行消融[10]。
四、随访
RFA后1个月行增强CT或MRI检查,如果病灶区呈低密度影,边缘未见强化,延迟后未见充填,则视为完全消融;否则,为不完全消融。对于完全消融者,间隔6个月复查增强CT或MRI,观察消融灶缩小情况和可能的肿瘤复发情况。未获得完全消融的患者,间隔6个月随访时,若残余瘤体明显进展,则再次进行RFA治疗。
五、研究终点
主要研究终点是技术成功率、治疗安全性(消融相关并发症)以及完全消融率。次要研究终点是症状改善情况、消融灶体积变化、残留血管瘤复发及生活质量。本研究的研究终点时间定为RFA治疗后6个月。
六、统计学分析
统计分析软件应用SPSS15.0,碘油用量、住院时间、消融灶直径、消融次数、消融时间以均数±标准差表示,治疗前后的上述指标比较用t检验。P<0.05为差异有统计学意义。
结 果
一、一般情况
本研究纳入的15例患者中,男6例,女9例;年龄29~54岁,平均(43.5±7.5)岁。15个巨大血管瘤的直径为10~16 cm,平均(13.0±2.2)cm,患者的一般情况见表1。
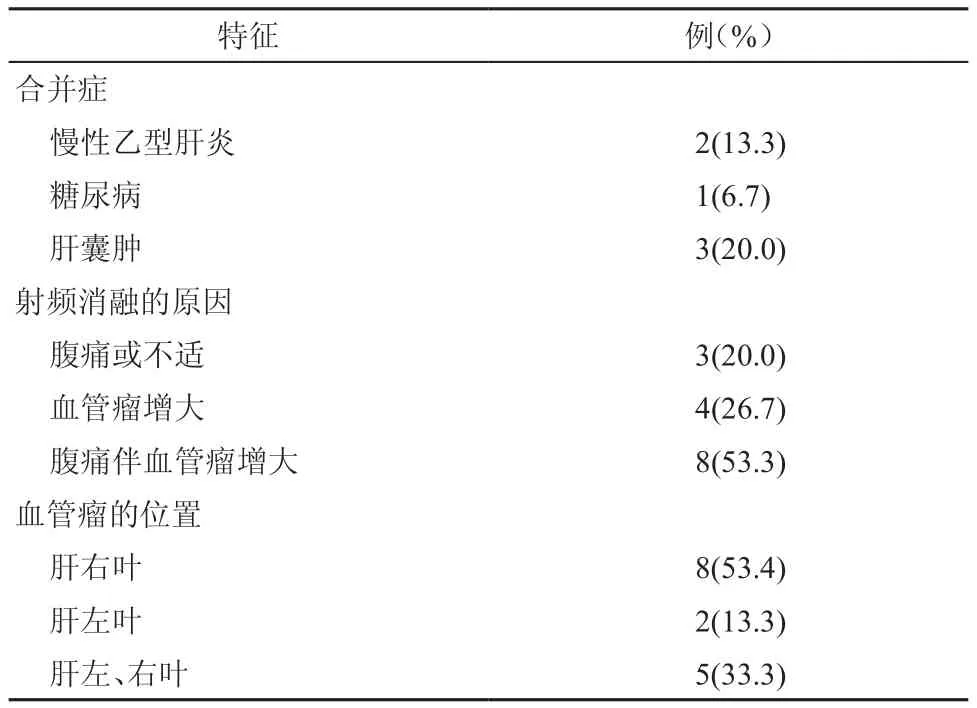
表1 15例患者的一般情况
二、RFA联合TAE治疗结果
经TA E治疗后,肝血管瘤的平均直径从(13.0±2.2)cm缩小至(7.1±2.0)cm,差异有统计学意义(P<0.001)。RFA治疗后的情况见表2。所有患者RFA治疗均获成功,技术成功率为100%(图1)。15个巨大肝血管瘤中,14个(93.3%)获得完全消融。1个肝血管瘤未完全消融,增强CT显示消融灶边缘轻微强化。

表2 RFA联合TAE治疗15个巨大肝血管瘤的手术参数
三、并发症
TAE术后72 h内有8例患者需要注射杜冷丁来缓解术后疼痛。RFA治疗后48 h内有4例需要注射杜冷丁缓解术后疼痛。有4例(26.7%)患者发生了6个消融相关并发症;按照Dindo-Clavien分级[16],均为轻微并发症(I级)。其中2例患者有中度发热(38~39℃),未经特殊处理,持续2~5 d后自行好转。有4例患者血清转氨酶升高(>80 U/L),在消融治疗后2周,血清转氨酶逐渐降至正常范围。15例患者中,未发生肺纤维化、血红蛋白尿、溶血性黄疸、气胸、腹腔脏器损伤及肝、肾功能衰竭等并发症。
四、随访结果
RFA治疗后,无围手术期死亡或远期并发症,如肝血管瘤复发、胆漏或肝脓肿。消融治疗后1个月,消融灶平均直径缩小至(6.1±2.0)cm;消融治疗后6个月,消融灶平均直径进一步缩小至(4.9±1.6)cm。随访期间,1例未获得完全消融的肝血管瘤体积也逐渐缩小,无需进一步治疗。11例有血管瘤相关症状的患者中,有10例症状完全消失,1例症状明显改善。6个月的随访过程中,所有患者未再新发与血管瘤相关症状。所有患者都能进行正常生活与工作。
讨 论
本研究显示,RFA联合TAE治疗巨大肝血管瘤是微创、安全、有效的。TAE后肝血管瘤的体积明显缩小,平均直径从(13.0±2.2)cm缩小至(7.1±2.0)cm。降低了后续RFA治疗的难度,减少消融相关并发症的发生。RFA联合TAE治疗后患者的平均住院日明显低于文献报道的单纯RFA治疗病例[10]。

图1 患者女性,54岁,CT增强扫描发现肝右叶一直径13.0 cm的血管瘤(A-B图);DSA引导下将碘油与平阳霉素混合物注入供血动脉(C图);肝动脉栓塞治疗1个月后,CT显示瘤体明显缩小(D图);CT引导下行RFA治疗(E图);RFA治疗1个月后,增强CT显示血管瘤获得完全消融,消融灶明显缩小(F图);RFA治疗后6个月,消融灶进一步缩小(G图)。
RFA已被成功用于大肝血管瘤的临床治疗[6-10],但RFA治疗巨大肝血管瘤尚存在争议[9-10]。2011年,Park等[9]报道了采用超声引导下经皮RFA治疗5个巨大血管瘤,结果显示,5个巨大血管瘤的完全消融率为60%,2个巨大血管瘤因RFA过程中担心周围脏器热损伤中断治疗,导致技术失败。2007年至2011年,Gao等[8]尝试性地应用RFA治疗了16例17个巨大肝血管瘤,瘤体最大直径10~16 cm,平均13.2 cm。16例均成功接受RFA治疗,无技术失败;肿瘤完全消融率高达82.4%(14/17)。但遗憾地是,消融相关并发症高达100%。按照Dindo-Clavien分级标准[16],2例并发症分别为Ⅲ级(低位食管瘘)和Ⅳ级(急性呼吸窘迫综合征);其他为Ⅰ级,包括血红蛋白尿16例、发热10例、溶血性黄疸9例、贫血6例、转氨酶升高6例、一过性肾损伤1例和皮肤烧伤2例。初步研究结果表明,RFA治疗巨大肝血管瘤,虽然治疗效果满意,但消融相关并发症发生率过高。2011年至2102年, Gao等[10]应用RFA治疗了21例患者的21个巨大肝血管瘤,瘤体最大径10~15 cm,平均直径12.5 cm;作者采取了以下两项改进措施,以期在保证消融成功率的同时减少消融相关并发症:(1)治疗中使用Cooltip™射频消融系统。(2)在治疗的过程中,当患者体温超过39 ℃或出现血红蛋白尿时,则停止操作,择期再次治疗。21例患者均成功接受RFA治疗,无技术失败;完全消融达到90.5%(19/21),消融相关的并发症减少到47.6%(10/21)。18例患者经一次RFA治疗,3例患者(血管瘤直径≥14.0 cm)则经历了两次RFA治疗。显然,47.6%的消融相关并发症仍不能令人满意,而且还有3例患者经历了重复RFA治疗才完成治疗。上述研究均表明单独的RFA治疗巨大肝血管瘤有其局限性,RFA联合TAE治疗,则可能弥补单独治疗的不足。
肝动脉化疗栓塞(transcatheter arterial chemoembolization, TACE)是治疗无法手术切除肝细胞癌(hepatocellular carcinoma , HCC)的有效手段。然而,TACE只是HCC的姑息性治疗手段,而非治愈性治疗方案[17]。RFA治疗则是小HCC的治愈性治疗手段[18]。RFA可以使肿瘤直径<3 cm的小HCC获得完全消融,达到治愈目的;而对于直径>3 cm的HCC,则难以实现完全消融。近年来,RFA联合TACE作为一种有效的治疗组合,应用于直径>3 cm的HCC治疗,取得了满意疗效。联合治疗方案可实现协同治疗的目的:TACE可阻断肿瘤血供、降低热沉降效应,同时缩小肿瘤体积,明显降低RFA治疗难度,保证RFA治疗最大程度获得完全消融[19-21]。此外,诸多研究表明,手术治疗肝血管瘤前行TAE,可以缩小瘤体,减少术中出血的风险[13-14]。然而,RFA联合TAE治疗巨大血管瘤患者能否获益仍然不明确。
本研究显示,RFA联合TAE治疗可保证巨大肝血管瘤获得完全消融。我们也发现,TAE后肝血管瘤体积明显缩小,使得随后的消融时间比文献报道单纯RFA治疗的消融时间明显缩短[8-10],明显降低了消融相关并发症低(26.7%,4/15)。我们采纳了Gao等[10]推荐的消融治疗策略,本组患者中的消融相关并发症发生率明显低于Gao等的报道(26.7% vs. 47.6%),且不需要进行重复RFA治疗。我们分析,RFA联合TAE治疗巨大肝血管瘤的优势如下:(1)TAE可以阻断血管瘤血流,缩小瘤体,有利于缩短后期RFA治疗所需时间。(2)TAE后,瘤体内缺血、炎症导致瘤体内水肿,有利于扩大消融区域[11-12]。(3)TAE后,碘油沉积于瘤体内,有利于CT引导下穿刺定位瘤体,有效地避免消融电极穿刺损伤周围脏器。
总之,RFA联合TAE治疗巨大肝血管瘤是安全、有效的;TAE可有效阻断血管瘤血供,使病灶缩小,降低了后续RFA治疗的难度,减少了消融相关并发症。但是,本研究的不足是回顾性研究,缺乏对照组,样本量偏小,且随访期短。联合治疗的安全性和有效性尚需高级别循证医学证据进一步证实。
1 Schnelldorfer T, Ware AL, Smoot R, et al. Management of giant hemangioma of the liver: resection versus observation[J]. J Am Coll Surg, 2010,211(6):724-730.
2 Beatty JS, Mitchell JW, Holsten SB, et al. Traumatic rupture of a previously undiagnosed giant hepatic hemangioma[J]. Am Surg,2013,79(9):e314- e315.
3 Hasan HY, Hinshaw JL, Borman EJ, et al. Assessing normal growth of hepatic hemangiomas during long-term follow-up[J]. JAMA Surg,2014,149(12):1266-1271.
4 Miura JT, Amini A, Schmocker R, et al. Surgical management of hepatic hemangiomas: a multi-institutional experience[J]. HPB (Oxford),2014,16(10):924-928.
5 Zhang W, Huang ZY, Ke CS, et al. Surgical treatment of giant liver hemangioma larger than 10 cm: a single center's experience with 86 patients[J]. Medicine (Baltimore),2015,94(34):e1420.
6 Fan RF, Chai FL, He GX, et al. Laparoscopic radiofrequency ablation of hepatic cavernous hemangioma. A preliminary experience with 27 patients[J]. Surg Endosc,2006,20(2):281-285.
7 Zhang X, Yan L, Li B, et al. Comparison of laparoscopic radiofrequency ablation versus open resection in the treatment of symptomatic-enlarging hepatic hemangiomas: a prospective study[J]. Surg Endosc, 2016,30(2): 756-763.
8 Gao J, Ke S, Ding XM, et al. Radiofrequency ablation for large hepatic hemangiomas: initial experience and lessons[J]. Surgery,2013,153:78-85.
9 Park SY, Tak WY, Jung MK, et al. Symptomatic-enlarging hepatic hemangiomas are effectively treated by percutaneous ultrasonographyguided radiofrequency ablation[J]. J Hepatol,2011,54(3):559-565.
10 Gao J, Ding X, Ke S, et al. Radiofrequency ablation in the treatment of large hepatic hemangiomas: a comparison of multitined and internally cooled electrodes[J]. J Clin Gastroenterol,2014,48(6):540-547.
11 Firouznia K, Ghanaati H, Alavian SM, et al. Management of liver hemangioma using trans-catheter arterial embolization[J]. Hepat Mon,2014,14(12):e25788.
12 Sun JH, Nie CH, Zhang YL, et al. Transcatheter arterial embolization alone for giant hepatic hemangioma[J]. PloS One,2015,10(8):e0135158.
13 Akamatsu N, Sugawara Y, Komagome M, et al. Giant liver hemangioma resected by trisectorectomy after efficient volume reduction by transcatheter arterial embolization: a case report[J]. J Med Case Rep,2010,4:283.
14 Lupinacci RM, Szejnfeld D, Farah JF. Spontaneous rupture of a giant hepatic hemangioma. Sequential treatment with preoperative transcatheter arterial embolization and conservative hepatectomy[J]. G Chir,2011,32(11-12):469-472.
15 Gao J, Zhang Q, Zhang J, et al. Radiofrequency ablation of the main lesion of hepatocellular carcinoma and bile duct tumor thrombusas a radical therapeutic alternative: two case reports[J]. Medicine (Baltimore),2015,94(27):e1122.
16 Dindo D, Demartines N, Clavien PA. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey[J]. Ann Surg,2004,240(2):205-213.
17 Tacher V, Lin M, Duran R, et al. Comparison of existing response criteria in patients with hepatocellular carcinoma treated with transarterial chemoembolization using a 3D quantitative approach[J]. Radiology,2015,278(1):275-284.
18 Gao J, Wang SH, Ding XM, et al. Radiofrequency ablation for single hepatocellular carcinoma 3 cm or less as frst-line treatment[J]. World J Gastroenterol,2015,21(17):5287-5294.
19 Zhu AX, Abou-Alfa GK. Expanding the treatment options for hepatocellular carcinoma: combining transarterial chemoembolization with radiofrequency ablation[J]. JAMA,2008,299(14):1716-1718.
20 Tanaka M, Ando E, Simose S, et al. Radiofrequency ablation combined with transarterial chemoembolization for intermediate hepatocellular carcinoma[J]. Hepatol Res,2014,44(2):194-200.
21 Zhang L, Yin X, Gan YH, et al. Radiofrequency ablation following first-line transarterial chemoembolization for patients with unresectable hepatocellular carcinoma beyond the Milan criteria[J]. BMC Gastroenterol,2014,14:11.
Computed tomography-guided radiofrequency ablation following transcatheter arterial embolization intreatment of large hepatic hemangiomas
Song Jingjing*, Zhao Zhongwei, Tu Jianfei, Ji Jiansong, Gao Jun*Department of Interventional Radiology, Lishui Central Hospital, The Fifth Affliated Hospital of Wenzhou Medical University, Zhejiang 323000, China
Ji Jiansong , Email:jjstcty@sina.com; Gao Jun, Email: gaojun8430@163.com
Objective The purpose of this study was to evaluate the feasibility, safety, and efficacy of computed tomography (CT)-guided radiofrequency (RF) ablation combined with transcatheter arterial embolization (TAE) to treat large (≥ 10 cm) hepatic hemangiomas. Methods We retrospectively reviewed our sequential experience with 15 large hepatic hemangiomas in 15 patients. Results The mean diameter of the 15 hemangiomas was (13.0±2.2) cm (10.0-16.0 cm). RF ablation combined with TAE treatment was performed successfully in all patients. The mean diameter of the hemangiomas decreased from (13.0±2.2) to (7.1±2.0) cm fter TAE treatment. Out of 15 hepatic hemangiomas, 14 (93.3%) showed no enhancement on CT or MRI indicating complete ablation after RF treatment. The mean diameter of the ablation zone decreased to (6.1±2.0) cm one month after ablation and further decreased to (4.9±1.6) cm six months after ablation. There were six complications related to the ablation in four patients. According to the Dindo-Clavien classification, all the complications were minor (Grade I). Conclusions RF ablation combined with TAE is a safe and effective treatment for large hepatic hemangiomas. TAE can improve the disruption of lesion blood supply and reduce lesion size to facilitate subsequent RF ablation and reduce the risk of ablation-related complications.
Hemangioma; Liver; Large; Radiofrequency Ablation; Embolization
2015-10-12)
(本文编辑:王剑锋)
10.3877/cma.j.issn.2095-5782.2015.04.008
北京市卫生系统高层次卫生技术人才培养项目;浙江省丽水市科技计划项目 (2012JYZB89)
323000 温州医科大学附属第五医院,丽水市中心医院介入科(宋晶晶、赵中伟、涂建飞、纪建松);100043 北京,首都医科大学附属北京朝阳医院西区肝胆外科(高君)
纪建松,Email:jjstcty@sina.com;高君,Email: gaojun8430@163.com
宋晶晶,赵中伟,涂建飞,等.射频消融联合肝动脉栓塞治疗巨大肝血管瘤的效果评价[J/OD].中华介入放射学电子杂志,2015,3(4):201-206.
