硒蛋白X基因克隆、定点突变、原核表达及多克隆抗体制备
2015-05-09华汤加勇曹蕾周继昌贾刚刘光芒陈小玲王康宁四川农业大学动物营养研究所成都630深圳市慢性病防治中心分子生物学实验室深圳5800
赵 华汤加勇曹 蕾周继昌贾 刚刘光芒陈小玲王康宁(.四川农业大学动物营养研究所,成都630;.深圳市慢性病防治中心分子生物学实验室,深圳5800)
硒蛋白X基因克隆、定点突变、原核表达及多克隆抗体制备
赵 华1汤加勇1曹 蕾1周继昌2贾 刚1刘光芒1陈小玲1王康宁1
(1.四川农业大学动物营养研究所,成都611130;2.深圳市慢性病防治中心分子生物学实验室,深圳518020)
摘 要:本试验旨在克隆鉴定猪硒蛋白X(SelX)基因,将其定点突变后进行原核表达,获得重组蛋白,并制备猪SelX多克隆抗体,为以猪为模型SelX功能研究奠定基础。利用cDNA末端快速克隆(3′⁃RACE)技术从猪肝脏总RNA扩增出含开放阅读框(ORF)至poly(A)共1 215 bp的SelX基因cDNA片段,其348 bp的ORF编码区和对应的氨基酸残基与人相应序列分别有88% 和91%序列同源性,猪SelX基因提交NCBI GenBank数据库,序列号为EF113597。ORF编码氨基酸残基中硒代半胱氨酸(Sec)位于C-端第95个残基,其编码密码子TGA经定点突变为半胱氨酸(Cys)的TGT后,将其插入载体pET30,转入大肠杆菌BL21(DE3)中,在0.5 mmol/L异丙基硫代-β-D-半乳糖苷(IPTG)诱导2 h获得融合表达产物,经His⁃tag亲和层析后,获得分子质量为18.0 ku的纯化蛋白。将纯化获得的SelX基因突变体融合蛋白(SelXm)免疫兔子,得到效价高达1∶20 000的多克隆抗体,免疫印迹(Western⁃blot)结果显示该抗体能特异性识别纯化的SelXm和猪肝脏中相应SelX。本试验成功克隆并鉴定了猪SelX基因,并制备了其多克隆抗体。关键词:猪SelX基因;克隆;定点突变;原核表达;多克隆抗体
目前在人和鼠中已经通过试验探明了部分硒蛋白的功能,但大部分硒蛋白生物学功能尚不清楚,当中包括硒蛋白X(SelX)。研究发现SelX基因的mRNA转录产物组织分布广泛,尤其在肝脏、白细胞等中表达量较高[5]。猪与人类在生理结构和功能上具有多方面的相似性,这些相似性使猪成为人类一些疾病的理想动物模型[6],以猪为模型研究SelX生物学功能具有重要意义。在此本试验拟克隆猪SelX基因,并对其Sec密码子进行定点突变后,构建原核表达载体,表达SelX基因突变体蛋白(SelXm),制备猪SelXm多克隆抗体,为进一步以猪为模型研究SelX生物学功能奠定基础。
1 材料与方法
1.1 试验动物、菌株及质粒
健康成年雄性家兔2只(体重2.0~2.5 kg),购自四川农业大学教学农场,克隆载体pMD18⁃T购自宝生物工程(大连)有限公司,大肠杆菌TOP10、原核表达载体pET30,大肠杆菌BL21 (DE3)等由本实验室保存。
1.2 主要试剂
DNA限制性内切酶、AMV第1链cDNA合成试剂盒、T4 DNA连接酶、pfu Taq DNA聚合酶、DNA分子质量标准、3′-full RACE core set、定点突变试剂盒均购自宝生物工程(大连)有限公司;总RNA提取试剂Trizol购自Invitrogen公司,DNA凝胶回收试剂盒、PCR产物回收试剂盒、快速质粒小量提取试剂盒均购自Omega公司;琼脂糖购自Biowest公司;胰蛋白胨和酵母提取物均为OXOID公司产品;His⁃tag凝胶层析介质购自GE公司产品;其余试剂为国产分析纯试剂;引物由上海英骏生物技术有限公司合成。
1.3 SelX基因克隆与分析
通过NCBI GeneBank数据库查询猪表达序列标签(ESTs),获得1段与与人SelX基因具有同源性的序列(GeneBank登录号:CV874267),根据该序列设计cDNA末端快速克隆(3′⁃RACE)上游引物F1:5′-AGGCTCAAGACCCTGCGGTGGA-3′,与3′⁃full RACE core set试剂盒里的3′-adaptor primer构成引物对,扩增含完整3′-端全长的SelX基因。新鲜采取长白猪肝脏组织,采用Trizol试剂盒提取总RNA,检测其质量合格后,用于克隆SelX基因。以总RNA为模板,以Oligo(dT)-3′⁃site Primer为引物,按3′⁃full RACE core set试剂盒操作合成第1链cDNA。再以F1和3′⁃adaptor primer组成引物对,以合成的第1链cDNA为模板扩增获得含完整ORF至poly(A)的SelX基因序列。PCR反应条件为:94℃初始变性5 min,然后经过35个循环(94℃30 s,58℃30 s,72℃1.5 min),然后72℃延伸10 min结束,4℃保存。采用T/A克隆将扩增片段连接到pMD18⁃T载体,采用蓝白筛选方法筛选阳性克隆,经PCR验证后进一步将获取的目的DNA送上海英骏生物技术有限公司测序。本试验中分子生物学操作参照相应试剂盒说明和《精编分子生物学实验指南》[7]。利用NCBI Blast、SECISearch 2.18等在线分析软件对克隆的DNA序列进行序列分析,确认后提交NCBI Gen⁃Bank。
电力电缆设备的运行管理是个全面的过程,在整个过程中,需要注>意的是做好电缆以及附件的处理工作,在设备运行管理中,成本管理是关键。尤其是敷设的电缆设备的管理中,提前实施检测和管理。
1.4 SelX基因定点克隆、原核表达载体构建
以克隆的SelX⁃pMD18⁃T质粒为模版,在SelX基因的ORF内Sec密码子TGA附近设计突变引物突变引物MX⁃F:5′-TCAGCAGTTCCCT⁃GAAGTTCATC-3′和MX⁃R:5′-ATATACA⁃GAAGCGGGACTGTCC-3′,应用反向PCR技术,利用突变引物对进行PCR扩增,对SelX基因实现定点突变,将密码子由TGA突变成TGT。按定点突变试剂盒(TaKaRa)操作说明进行突变PCR、Blunting Kination反应和连接(Ligation)反应。电转化后,细胞涂布LB平板(含青霉素),37℃过夜培养至长出单菌落,挑取单克隆菌落进行PCR验证和测序验证。
根据SelX基因的ORF设计EX⁃F:5′-ATATCGGATCCATGTCGTTCTGCAGCTTC-3′(引入BamHⅠ酶切位点)和Ex⁃R:5′-GCCG⁃CAAGCTTGCTACTGTCCCTGGGAGG-3′(引入HindⅢ酶切位点)引物对,用于PCR扩增和原核表达载体构建。以上述突变SelX基因重组质粒为模板,pfu Taq DNA聚合酶PCR扩增后,PCR产物经过乙醇沉淀回收并测定浓度,分别用BamHⅠ和HindⅢ双酶切处理。同时对pET30质粒进行BamHⅠ和HindⅢ双酶切处理,PCR产物和pET30质粒经双酶切处理后,经1%琼脂糖凝胶电泳后,用胶回收试剂盒回收相应目的DNA和质粒酶切片段。DNA片段与相应酶切线性化处理的pET30载体采用T4 DNA连接酶于16℃过夜连接,用Qiagen PCR回收试剂盒回收连接片段后用于电转化。连接产物pET30⁃SelXm重组质粒转化大肠杆菌Top10感受态细胞细菌,涂布于新鲜LB平板,37℃过夜培养后挑取单菌落进行阳性克隆PCR筛选和双酶切鉴定。构建好的pET30⁃SelXm表达载体转入大肠杆菌BL21(DE3)细胞,筛选转化子,阳性菌落命名为pET30⁃SelXm/BL21。
1.5 重组质粒的诱导表达与目的蛋白质纯化
pET30⁃SelXm/BL21和阴性对照菌株pET30/BL21分别接种于20 mL的LB培养基中(含卡那霉素30 mg/L)37℃200~250 r/min悬浮培养过夜,次日按1%转接至100 mL新的培养液中(含卡那霉素30 mg/L),当OD600 nm为0.4时,加入0.5 mmol/L异丙基硫代-β-D-半乳糖苷(IPTG)进行诱导培养。在诱导后1、2、3 h时取菌液1 mL于离心管中,4℃8 000×g离心10 min收集菌落,加入1 mL磷酸盐缓冲液(PBS)重悬细菌,再次离心收集菌体,最后用50~100 μL蒸馏水调整各样品菌样浓度尽量一致。取20 μL菌样,加入5 μL十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS⁃PAGE)上样缓冲液,100℃煮沸10 min后,冰水放置5 min,样品离心后,取20 μL用于12%SDS⁃PAGE检测并分析重组蛋白表达量。根据电泳结果确定合适的诱导条件后,扩大培养体积至1 L,收集菌样用于目的蛋白纯化,该蛋白记为SelXm。用于蛋白质纯化的菌体按加入裂解液[50 mmol/L Tris pH 8.0,10 mmol/L乙二胺四乙酸(EDTA),0.1 mol/L氯化钠(NaCl),0.25 mg/mL溶菌酶],先冰浴超声波粉碎菌体,然后37℃水浴2 h。12 000×g 4℃,离心10 min收集包涵体,用8 mmol/L尿素溶解后,调整溶液pH为7.4,NaCl 为0.5 mol/L,然后进行Ni SepharoseTM亲和层析,纯化的蛋白质样品转入分子截留质量3.5 ku透析袋透析后,分装放-20℃保存。
1.6 多克隆抗体的制备及抗体效价测定
用纯化的SelXm常规免疫家兔,每次免疫剂量为0.3 mg,溶于PBS中。首次免疫,将纯化的蛋白质加入等体积的弗氏完全佐剂,在涡旋振荡仪中振荡混匀,形成“油包水”状乳悬液,充分乳化后采取背部多点皮下免疫注射,每点注射约100 μL。2周后用同样剂量蛋白质与等体积的弗氏不完全佐剂混合后进行加强免疫。后每隔10 d,进行1次加强免疫,共进行2次加免。最后1次加强免疫后6 d,颈静脉采血,制备血清。以家兔免疫前耳静脉采集的血清作为阴性对照。
用抗原包被液(pH 9.6)稀释纯化蛋白质浓度为2 μg/mL,取100 μL纯化蛋白质(抗原)液置于96孔酶标板中,37℃放置过夜。然后用PBS-吐温(PBST)洗涤酶标孔3次,加入封闭液200 μL/孔于酶标板中,置37℃封闭1~2 h。用PBST洗涤酶标孔3次后,每孔加入稀释的待测样品抗血清(1∶500、1∶1 000、1∶2 500、1∶5 000、1∶10 000、1∶20 000),以免疫前的血清作为相应阴性对照,加盖37℃孵育2 h。PBST洗涤酶标板3次后,每孔100 μL加封闭液稀释的辣根过氧化物(HRP)标记山羊抗兔酶标抗体(1∶2 500倍稀释),37℃孵育1 h。PBST洗涤3次后,每孔加入100 μL新鲜配制的四甲基联苯胺(TMD)底物显示液,置暗处反应20 min。用100 μL/孔2 mmol/L H2SO4终止反应后,置于酶标仪中,在450 nm波长读数。若待测孔OD450 nm大于或等于阴性对照孔的2.1倍,即认为是阳性值,从而得出血清的抗体效价。
将纯化的SelXm融合蛋白及空载体进行SDS⁃PAGE后,进行蛋白质免疫印迹(Western blot)分析,用半干法电转移到聚偏二氟乙烯(PVDF)膜上,5%牛血清白蛋白(BSA)封闭后,以本试验制备的兔抗血清(1∶10 000)为一抗,辣根过氧化物酶标记的羊抗兔IgG(1∶2 000)为二抗进行反应。显色反应参照Millpore公司的ECL化学发光底物说明书进行,底片曝光操作参照《精编分子生物学实验指南》[7]。同时对猪肝脏样品提取总蛋白,进行SDS⁃PAGE电泳后,进行Western⁃blot分析,检测制备的兔抗血清是否对肝脏中SelX具有免疫原性。
2 结果与分析
2.1 SelX基因克隆与分子生物学分析
以猪肝脏总RNA为模板,经反转录合成第1 链cDNA片段。利用F1引物,采用3′-RACE方法,扩增出了1条1 215 bp的目标基因片段(图1-A)。扩增的DNA片段经T/A克隆后,送上海英骏生物技术有限公司进行序列测定确定,获得了包含完整3′⁃UTR和ORF的SelX基因,经NCBI Blast比对分析该基因ORF区长348 bp,编码116个氨基酸残基,猪SelX Sec残基位于C-端第95个残基,ORF编码区与人SelX基因ORF区有88%序列同源性,编码的蛋白质序列与人SelX具有91%序列同源性(图1-B)。猪SelX基因提交NC⁃BI GenBank数据库,序列号为:EF113597。SelX基因经SECISearch 2.18软件分析,具有典型的硒蛋白特有的3′⁃UTR SECIS发夹结构(图1-C)。采用SingalP 3.0在线软件(www.cbs.dtu.dk/serv⁃ices/singalP/)对克隆的猪SelX基因进行信号肽预测,结果显示SelX没有信号肽切割位点。

图1 猪SelX的基因克隆及其蛋白氨基酸序列和基因序列分析Fig.1 Gene cloning,protein and gene sequence analysis of porcine SelX
2.2 SelX基因定点突变及原核表达载体构建
构建好的表达载体测序结果显示Sec的编码密码子TGA突变成TGT(图2-A),TGA在原核表达系统中是1个终止密码子经过突变成TGT后,可以在原核系统中表达目的蛋白。突变体表达载体pET30⁃SelXm转入大肠杆菌BL21(DE3)细胞,随机挑选3个阳性转化,采用菌落PCR,以EX⁃F和EX⁃R引物对进行PCR扩增,均扩增出分子质量约为360 bp大小的DNA片段(图2-B),与预期DNA片段大小一致,说明突变基因原核表达载体构建并转化成功。
2.3 SelX基因原核表达、纯化及抗体效价测定
pET30⁃SelXm/BL21经过IPTG诱导培养表达出目的蛋白,空载质粒pET30/BL21诱导后不能表达目的蛋白(图3-A),经0.5 mmol/L IPTG诱导2 h即可获得理想的目的蛋白表达量。表达的蛋白经过His⁃tag亲和层析,得到纯化的目的蛋白,SDS⁃PAGE显示分子质量约为18.0 ku(图3-A)。
纯化的SelX基因突变体融合蛋白免疫家兔,经加强免疫后,颈部静脉采集血液,室温放置1 h,放入4℃冰箱过夜,制备抗血清。采用酶联免疫分析(ELISA)法测定多克隆抗体效价,以免疫前兔血清作为对照,结果显示,经过免疫后,制备的抗血清效价高达1∶20 000(表1),利用免疫印迹(Western⁃blot)方法检测表明,所获得的多克隆抗体能与纯化的SelXm特异性结合(图3-A),制备的多克隆抗体(抗血清)与肝脏中的SelX具有交差反应(图3-B)。
3 讨 论
未知序列基因克隆方法有很多种,可以根据不同物种之间基因序列同源性比较,设计引物,PCR扩增获得部分基因片段信息,在此基础上采用采用5′⁃RACE和3′⁃RACE等方法,获得基因的完整序列信息[8]。随着猪ESTs数据库等生物信息数据库的急剧丰富,通过查询目标基因ESTs信息,在此基础上采用5′⁃RACE和3′⁃RACE等方法克隆获得基因片段,成为克隆新基因的强有力手段[9]。本试验采用传统ESTs生物信息学分析结合3′⁃RACE等技术手段成功分离克隆出包含完整ORF和3′-侧翼序列的SelX基因序列片段,并将基因序列提交NCBI GenBank数据库(GenBank登录号:EF113597),分析SelX基因ORF片段在猪和人之间的序列同源性发现,CDS编码区与人SelX基因CDS区有88%序列同源性(图1-B),编码的蛋白序列与人SelX具有91%序列同源性。SE⁃CISearch 2.18在线生物信息学软件分析发现,克隆的SelX基因3′⁃UTR具有典型的硒蛋白特有的3′⁃UTR SECIS发夹结构(图1-C)。信号肽分析显示猪SelX没有信号肽切割位点,预示着SelX为孢内蛋白,可能定位于细胞质。
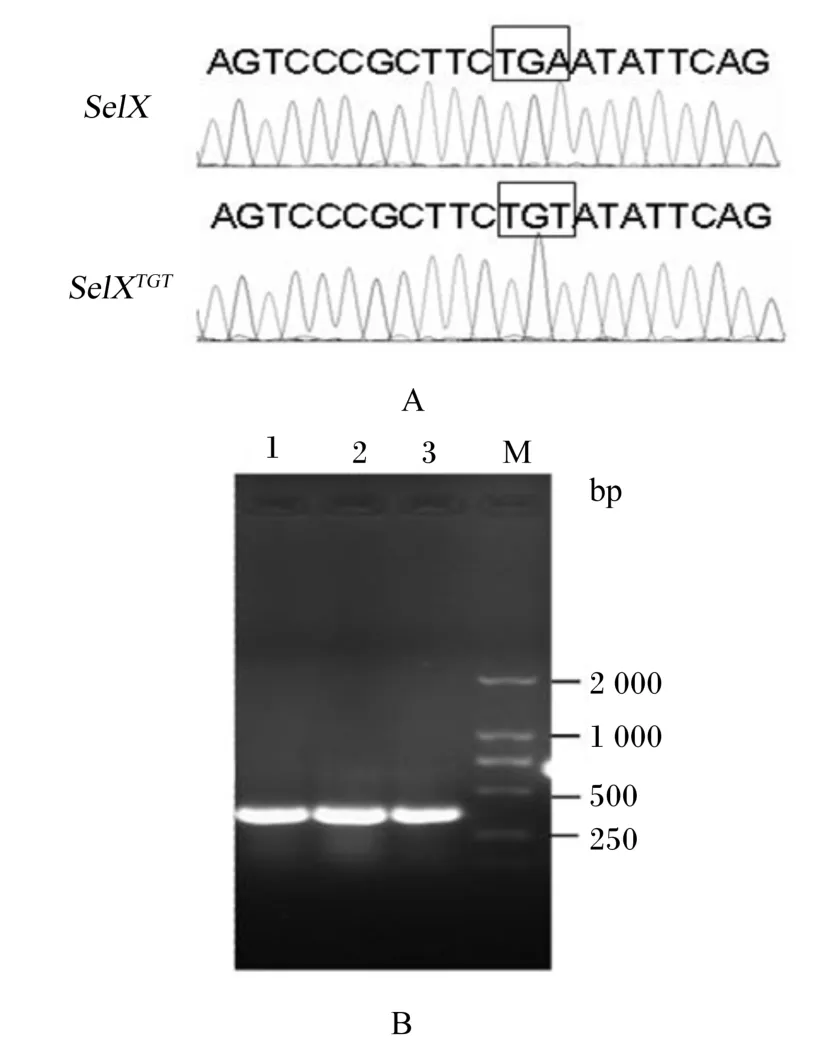
图2 SelX基因Sec密码子突变及其重组表达载体鉴定Fig.2 Identification of site⁃directed mutagenesis of Sec codon and recombinant expression plasmids of SelX gene
高等哺乳动物中体内要识别硒蛋白基因ORF 中TGA为Sec密码子,除了需要SECIS外,还需要一套复杂的识别机制,需要SECIS识别蛋白(SPS 2)、转运Sec的tRNA(Sec⁃tRNASec)等因子参与[10]。原核细胞缺乏相应的识别机制,因此高等哺乳动物来源的硒蛋白不能直接在原核系统中表达,由于Sec和半胱氨酸(Cys)性质很相似,因此通过定点突变将Sec密码子突变成Cys密码子,可以在原核表达系统中表达硒蛋白类似物,表达的突变体蛋白由于相应Cys位点不含硒,因而不具有硒蛋白生物学活性,但由于二者蛋白质氨基酸序列基本一致,因而具有相应的免疫原性,可通过硒蛋白类似物来制备其对应硒蛋白抗体。周继昌等[11]对猪硒蛋白Sep15基因进行定点突变后,成功表达了Sep15突变蛋白,免疫兔子后成功制备了猪Sep15抗血清。本试验采用快速PCR定点突变方法成功地对SelX基因进行了单碱基定点突变(图2-A)。通过在待突变位点设计突变引物(2引物5′端相邻)直接以双链DNA为模板,以突变引物进行高保真PCR扩增,得到含平末端的PCR产物,末端进行磷酸化处理后,在DNA连接酶的作用下得到含目的片段的环状双链DNA,转化相应的宿主菌后即可快速筛选出含突变基因的转化子[12-13]。SelX基因突变后,成功构建大肠杆菌表达载体,pET30⁃SelXm/BL21转化子细胞在0.5 mmol/L IPTG诱导培养2 h成功表达了SelXm(图3)。本试验采用pET30表达载体对猪SelX基因突变体蛋白进行融合表达,表达载体N-端含有1个6个组氨酸串联的His⁃tag,便于目的蛋白分离纯化,经过His⁃tag介质亲和层析,得到了纯化的目的蛋白,分子质量约为18.0 ku(图3-A)。
SelX属于蛋氨酸亚砜还原酶家族一员,该类蛋白质负责将氧化状态的蛋氨酸亚砜(MetSO)还原成蛋氨酸残基,从而在生物体内发挥着重要生物学功能。蛋氨酸亚砜还原酶家族包含MsrA和MsrB,目前在人体内已经鉴定出4种MsrB,SelX属于MsrB[14],但目前其生物学功能尚不清楚。我们在以猪为模型的研究中发现SelX基因表达量在肝脏、肾脏、肌肉、垂体、甲状腺和下丘脑等组织中不受饲粮硒水平(缺硒和高营养剂量硒)影响[15],这可能预示这SelX在这些组织中具有重要功能,机体在硒营养状态发生改变时优先保障其稳定表达从而保证其重要功能发挥。但对于SelX蛋白表达是否受缺硒或过量硒水平影响尚不清楚,本试验用纯化SelXm免疫家兔制备抗猪SelX的多克隆抗体,经间接ELISA检测表明,制备的抗血清效价高达1∶20 000以上(表1);利用Wersten⁃blot方法检测表明,所获得的多克隆抗体能与纯化的SelXm融合蛋白特异性结合,同时也能识别猪肝脏中的SelX。因此本试验制备的多克隆抗体也可望用于检测SelX蛋白表达,为今后以猪为模型从从蛋白水平探讨SelX功能奠定了基础。

图3 SelX融合蛋白的SDS⁃PAGE分析和Western blot检测Fig.3 SDS⁃PAGE analysis of expressed fusion protein SelX and Western blot assay for the purified protein

表1 间接ELISA检测猪SelXm多克隆抗体效价Table 1 The polyclonal antibody titer of porcine SelXm determined by indirected ELISA
4 结 论
本试验成功克隆了猪SelX基因并对其序列进行比对分析(基因序列提交NCBI GenBank数据库,序列号为:EF113597);对其编码密码子TGA经定点突变为半胱氨酸(Cys)的TGT后,成功实现了SelX基因突变体蛋白在大肠杆菌中表达;表达的蛋白经纯化后,免疫家兔,获得了效价高达1∶20 000的多克隆抗体;Western⁃blot显示制备的抗血清能特异性识别纯化的SelXm和猪肝脏组织中的SelX,可用于猪组织SelX的Western⁃blot分析。
参考文献:
[1] KRYUKOV G V,CASTELLANO S,NOVOSELOV
S V,et al.Characterization of mammalian selenopro⁃ teomes[J].Science,2003,300(5624):1439-1443.
[2] KVICALA J.Selenium and organism[J].Cas Lek Cesk,1999,138(4):99-106.
[3] LOW S C,BERRY M J.Knowing when not to stop:selenocysteine incorporation in eukaryotes[J].Trends in Biochenmical Sciences,1996,21(6):203-208.
[4] MIX H,LOBANOV A V,GLADYSHEV V N.SECIS elements in the coding regions of selenoprotein tran⁃scripts are functional in higher eukaryotes[J].Nucleic Acids Research,2007,35(2):414-423.
[5] LESCURE A,GAUTHERET D,CARBON P,et al.Novel selenoproteins identified in silico and in vivo by using a conserved RNA structural motif[J].Journal of Biological Chemistry,1999,274(53):38147-38154.
[6] BOULLION R D,MOKELKE E A,WAMHOFF B R,et al.Porcine model of diabetic dyslipidemia:insulin and feed algorithms for mimicking diabetes mellitus in hu⁃mans[J].Comparative Medicine,2003,53(1):42-52.
[7] 奥斯伯F,金斯顿R E,塞德曼J G.精编分子生物学实验指南[M].颜子颖,王海林,译.北京:科学出版社,1998.
[8] 赵华,周继昌,李俊刚,等.应用RACE法分离和克隆猪GPX2基因研究[J].安徽农业科学,2008,36 (18):7586-7588.
[9] GILL R W,SANSEAU P.Rapid in silico cloning of genes using expressed sequence tags(ESTs)[J].Bio⁃technology Annual Review,2000,5:25-44.
[10] DRISCOLL D M,COPELAND P R.Mechanism and regulation of selenoprotein synthesis[J].Annual Re⁃views of Nutrition,2003,23:17-40.
[11] 周继昌,李黛淋,汤加勇,等.硒蛋白Sep15基因克隆、定点突变及其原核表达[J].中国生物工程杂志,2011,31(8):12-17.
[12] 李振林,夏虎,刘克荣,等.在分子克隆中用PCR进行定点突变[J].第一军医大学分校学报,2002,25 (2):86-88.
[13] 周赞虎,张永祥,陈枝华,等.基因改造中快速PCR定点突变方法应用[J].中国公共卫生,2007,23 (1):102-103.
[14] KIM H⁃Y,GLADYSHEV V N.Methionine sulfoxide reductases:selenoprotein forms and roles in antioxi⁃dant protein repair in mammals[J].Biochemical Jour⁃nal,2007,407(1):321-329.
[15] LIU Y,ZHAO H,ZHANG Q S,et al.Prolonged dieta⁃ry selenium deficiency or excess does not globally af⁃fect selenoprotein gene expression and/or protein pro⁃duction in various tissues of pigs[J].Journal of Nutri⁃tion,2012,142(8):1410-1416.
Author,ZHAO Hua,associate professor,E⁃mail:zhua666@126.com
(责任编辑 王智航)
Gene cloning,Site⁃directed Mutagenesis,Prokaryotic Expression and Polyclonal Antibody Preparation of Porcine Selenoprotein X
ZHAO Hua1TANG Jiayong1CAO Lei1ZHOU Jichang2JIA Gang1LIU Guangmang1CHEN Xiaoling1WANG Kangning1
(1.Animal Nutrition Institute,Sichuan Agricultural University,Chengdu 611130,China;2.Molecular Biology Lab,Shengzhen Center for Chronic Disease Control,Shenzhen 518020,China)
Abstract:The objective of this experiment was to clone,site⁃directed mutate,prokaryotic express porcine sel⁃enoprotein X(SelX)and prepare its polyclonal antibody for further study of its roles using pig models.Total RNA was extracted from porcine liver for 3′⁃RACE,and a 1 215 bp cDNA fragment of the SelX containing se⁃quence from the open reading frame(ORF)till to its poly(A)tail was isolated.The 384 bp ORF share an 88%identity to that of human,while their amino acid sequences had 91%identity.The sequence of porcine SelX was submitted to NCBI GenBank with accession number of EF113597.The selenocysteine(Sec)encoded by TGA codon was located in the 95th amino acid position near the C⁃terminal of SelX.The codon TGA for Sec was site⁃directed mutated into TGT for cysteine(Cys),then the mutant was cloned into pET30 vector and expressed in E.coli BL21(DE3)induced by 0.5 mmol/L isopropy⁃β⁃D⁃thiogalactoside(IPTG)for 2 hours.The expressed recombinant protein exhibited a molecular weight of approximately 18.0 ku after purified using Ni Sepharose affinity column.The purified SelX mutant protein(SelXm)was used to immunize rabbit and the obtained polyclonal anti⁃sera showed a 1∶20 000 titer.Western⁃blot assay showed the rabbit anti⁃sera exhibited a specific immune recognization against the purified SelXm fusion protein and SelX in porcine liver tissue.In conclusion,the porcine SelX gene is successfully cloned and identified,and also its polyclonal antibody is suc⁃cessfully prepared in the present study.[Chinese Journal of Animal Nutrition,2015,27(5):1485⁃1491]
Key words:porcine SelX gene;cloning;site⁃directed mutagenesis;prokaryotic expression;polyclonal anti⁃body
中图分类号:S828
文献标识码:A
文章编号:1006⁃267X(2015)05⁃1485⁃07
作者简介:赵 华(1974—),男,四川雅安人,副研究员,博士,主要研究领域为营养与分子生物学。E⁃mail:zhua666@126.com
基金项目:国家自然科学基金面上项目(31072043,31272468);四川农业大学双支计划
收稿日期:2014-11-30
doi:10.3969/j.issn.1006⁃267x.2015.05.019
