鹅源草酸青霉产果胶酶对肥胖模型大鼠体重、脂肪沉积及脂质代谢的影响
2015-05-09徐晓波王宝维葛文华张名爱青岛农业大学优质水禽研究所国家水禽产业技术体系营养与饲料功能研究室青岛266109
徐晓波 王宝维葛文华 张名爱 解 超(青岛农业大学优质水禽研究所,国家水禽产业技术体系营养与饲料功能研究室,青岛266109)
鹅源草酸青霉产果胶酶对肥胖模型大鼠体重、脂肪沉积及脂质代谢的影响
徐晓波 王宝维∗葛文华 张名爱 解 超
(青岛农业大学优质水禽研究所,国家水禽产业技术体系营养与饲料功能研究室,青岛266109)
摘 要:本试验旨在研究鹅源草酸青霉产果胶酶对肥胖大鼠体重、脂肪沉积及脂质代谢影响。随机选取雄性大鼠108只,体重220~240 g,适应性饲养3 d。分为对照组(Ⅰ组)、高脂组(Ⅱ组)和高脂模型组;高脂模型组造模成功后,将其按体重随机分为7组,每组3个重复,每个重复4只;各组在基础饲粮中分别添加0(Ⅲ组)、0.01%(Ⅳ组)、0.05%(Ⅴ组)、0.1%(Ⅵ组)、0.2%(Ⅶ组)、0.4%(Ⅷ组)、0.8%(Ⅸ组)的果胶酶。试验期8周。结果表明:1)鹅源草酸青霉产果胶酶能够有效抑制肥胖模型大鼠体重的增长,降低Lee’s指数,控制体型发育。2)鹅源草酸青霉产果胶酶能够降低肥胖模型大鼠机体脂肪沉积量。3)鹅源草酸青霉产果胶酶能够有效地对肥胖模型大鼠由于摄入高脂饲粮引起的脂肪肝进行干预,使其恢复到正常水平。4)鹅源草酸青霉产果胶酶能够降低肥胖模型大鼠血清总胆固醇、甘油三酯、低密度脂蛋白胆固醇、游离脂肪酸含量,提高血清高密度脂蛋白胆固醇含量。5)鹅源草酸青霉产果胶酶能够降低肥胖模型大鼠谷丙转氨酶和谷草转氨酶活性,提高血清脂蛋白酯酶和肝酯酶活性。由此可见,鹅源草酸青霉产果胶酶对肥胖模型大鼠脂肪沉积和脂质代谢具有显著干预修复作用,降脂效果明显。
关键词:鹅源草酸青霉果胶酶;肥胖大鼠;脂肪沉积;脂质代谢
果胶酶是能够催化果胶物质降解的一组酶的总称。果胶物质通常存在于高等植物中,如蔬菜、水果、玉米、大豆等,是非淀粉多糖的成分之一[1]。随着我国工业的迅速崛起和农业的迅速发展,果胶酶的市场需求量也越来越大,应用方向越来越广泛[2]。为此,开展果胶酶新型利用方向的研究,对于开发新型酶制剂具有重要的经济价值和社会意义。Osei等[3]研究表明,在肉鸡饲粮中添加一定量的果胶酶制剂,可以提高42日龄的肉鸡屠宰率。Tahir等[4]研究发现,在饲粮中添加果胶酶与纤维素酶,可以显著提高肉鸡的屠宰率和胸肌率。雷廷等[5]研究表明,在饼粕类饲粮中添加果胶酶能够提高鸡的代谢能和氨基酸消化率。许毅[6]研究表明,在肉鸡饲粮中添加果胶酶有改善肉鸡生长性能的趋势,全期日增重和料重比均有不同程度改善。王春林等[7]研究表明,在玉米-豆粕饲粮中添加果胶酶制剂,能够显著提高21日龄肉仔鸡的平均日增重和平均日采食量,并且提高饲料转化率,与添加金霉素有相当的促生长作用。姜晓霞等[8]研究表明,在肉鸡饲粮中添加一定量的果胶酶可以提高肉鸡的腿肌率,降低腹脂率。梅宁安等[9]研究发现,饲粮添加饲料级果胶酶可显著提高肉仔鸡的生长性能。由此可见,果胶酶对家禽生长性能和饲料转化率的影响已经进行了初步探索,但对机体脂肪沉积规律、脂质代谢机理、改变机体营养再分配和降脂减肥效果等领域尚未见系统报道。为此,本试验以大鼠作为研究对象,在肥胖模型大鼠饲粮中添加不同水平鹅源草酸青霉果胶酶,研究其对试验肥胖模型大鼠体重、脂肪沉积量和脂质代谢指标的影响,探索果胶酶对机体脂肪沉积规律和代谢机理,为进一步探明果胶酶功能提供科学依据。
1 材料与方法
1.1 试验动物与材料
雄性Wistar大鼠由青岛派特福德白鼠养殖专业合作社提供,试验动物合格证号:SCXK(鲁)20090007,编号0008362;基础对照饲粮和高脂饲粮由南通特洛菲饲粮科技有限公司提供;果胶酶由青岛农业大学优质水禽研究所提供,通过鹅源草酸青霉发酵获得(酶活460 U/g)。酶活定义1 g酶粉或1 mL酶液在50℃,pH 3.5的条件下,1 h分解果胶产生1 mg半乳糖醛酸为1个酶活单位。
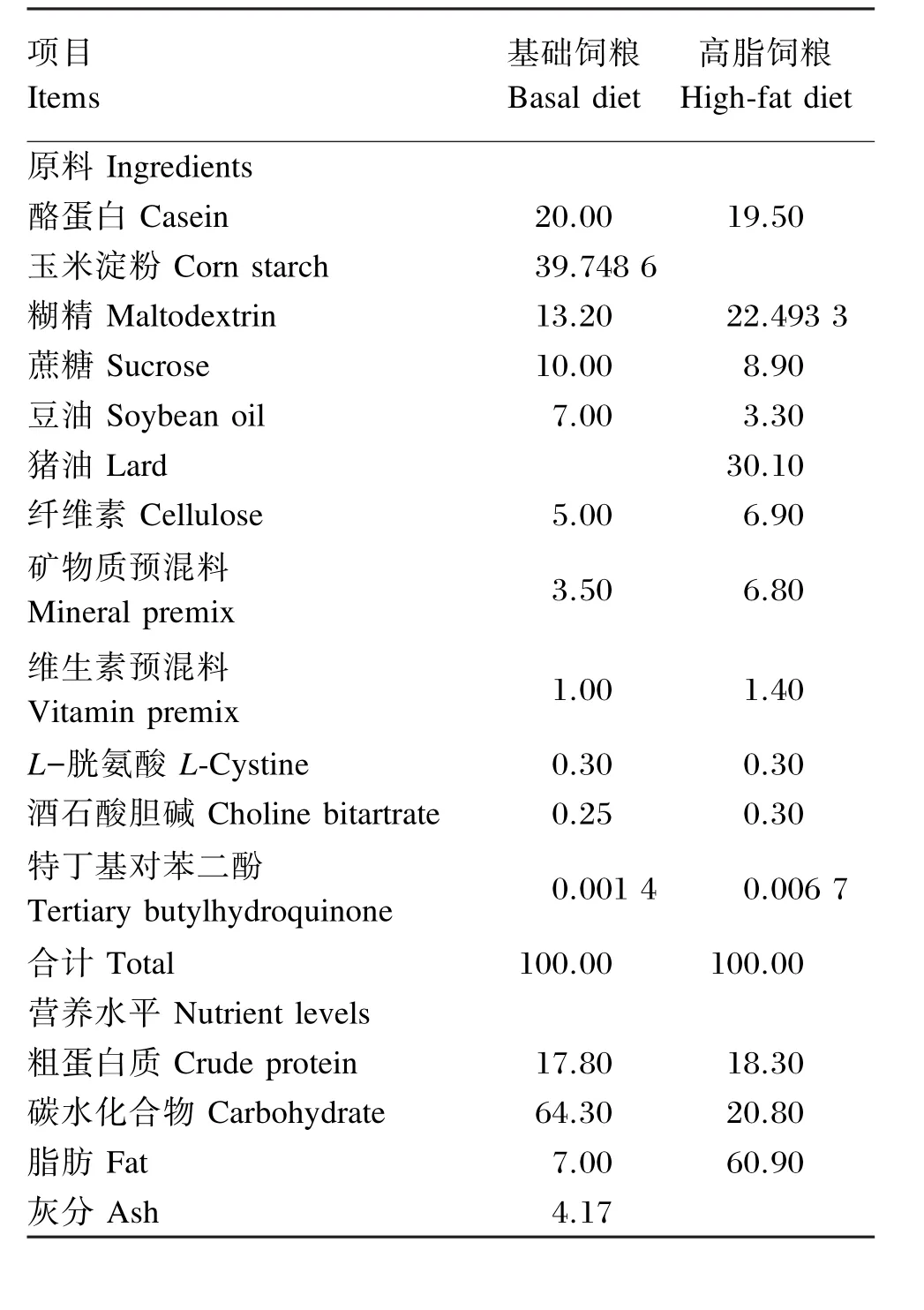
表1 饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of diets(air⁃dry basis) %
1.2 主要仪器与试剂
自动生化分析仪(日立7600⁃020型);低温高速离心机(Sigma公司);超低温冰箱(日本三洋公司);MAPADA UV-1100型紫外可见分光光度计(上海美谱达仪器有限公司);XS-204电子分析天平(梅特勒-托利多集团);微型移液器(德国Ep⁃pendorf公司);DKB-501A型超级恒温水槽(上海精宏试验设备有限公司);WH-2微型旋涡混合仪(上海沪西分析仪器有限公司)等。
总胆固醇(total cholesterol,TC)、甘油三酯(total triglyceride,TG)、高密度脂蛋白胆固醇(high⁃density lipoprotein cholesterol,HDL⁃C)、低密度脂蛋白胆固醇(low⁃density lipoprotein cholester⁃ol,LDL⁃C)、脂蛋白酯酶(lipoprotein lipase,LPL)、肝酯酶(hepaticendothelaillipase,HL)、游离脂肪酸(nonesterified fatty acid,NEFA)、谷草转氨酶(as⁃partate transaminase,AST)和谷丙转氨酶(alanine aminotransferase,ALT)试剂盒均购于南京建成生物工程研究所。
1.3 试验方法
选取108只体重为(220±20)g健康雄性Wistar大鼠,适应性为3 d。试验分如下2个阶段进行。
造模试验:1~2周龄,按体重随机分为对照组(Ⅰ组)、高脂组(Ⅱ组)、高脂模型组,其中对照组和高脂组各12只,高脂模型组84只;对照组饲喂基础饲粮,高脂组和高脂模型组饲喂60%高脂饲粮。
果胶酶饲养效果试验:3~8周龄,高脂造模成功后,将高脂模型组84只大鼠按体重随机分为7组(Ⅲ~Ⅸ组),每组3个重复,每个重复4只;每个组在基础饲粮中分别添加0(Ⅲ组)、0.01%(Ⅳ组)、0.05%(Ⅴ组)、0.1%(Ⅵ组)、0.2%(Ⅶ组)、0.4%(Ⅷ组)、0.8%(Ⅸ组)的果胶酶。对照组饲喂基础饲粮,高脂组饲喂高脂饲粮,高脂模型组(Ⅲ~Ⅸ组)喂饲添加相应比例的果胶酶饲粮。各组均自由采食和饮水。8周后,测定大鼠的生长指标、脂肪沉积情况和脂质代谢指标。
1.4 饲养管理
适应性喂养3 d使大鼠适应环境,适应期间饲喂基础对照饲粮;造模期间,依次按照一定比例递增给予高脂饲粮。整个试验期间,大鼠自由摄食、饮水,每天观察大鼠的采食、饮水情况;每天观察大鼠的精神状态、健康状况和活动情况,每周称量1次体重。
室内温度(22±2)℃,相对湿度55%±5%,室内通风良好,保持饲养室及周围环境的安静。每3 d更换1次垫料,每周用适宜浓度的84消毒液进行消毒,保持鼠笼清洁卫生,12 h光照周期。
1.5 测试指标及检测方法
体重:每周用电子天平称重,记录试验大鼠体重变化。
Lee’s指数:测量大鼠体长(从鼻至肛门的长度),计算其Lee’s指数。
Lee’s指数=(体重×103)1/3/体长。体脂比:将大鼠肾周脂肪、睾周脂肪、肠系膜脂肪取出,于电子天平称重。
体脂比(%)=(脂肪总重/体重)×100。
血脂测定:TC、TG、HDL⁃C、LDL⁃C、NEFA含量及LPL、HL、AST、ALT活性均经南京建成生物工程研究所所购试剂盒测定。
1.6 数据统计分析
试验数据以“平均值±标准差”表示,数据统计利用SPSS 17.0软件包中的平衡试验设计方差分析过程(ANOVA)进行,均值的多重比较采用Duncan氏法进行。
2 结果与分析
2.1 高脂饲粮诱导肥胖大鼠模型的建立
由表2可以看出,饲喂60%高脂饲粮的高脂模型组大鼠在第2周时,体重开始高于饲喂基础对照饲粮的对照组20%以上,并持续增重,表明高脂饲粮诱导肥胖大鼠模型建模成功。
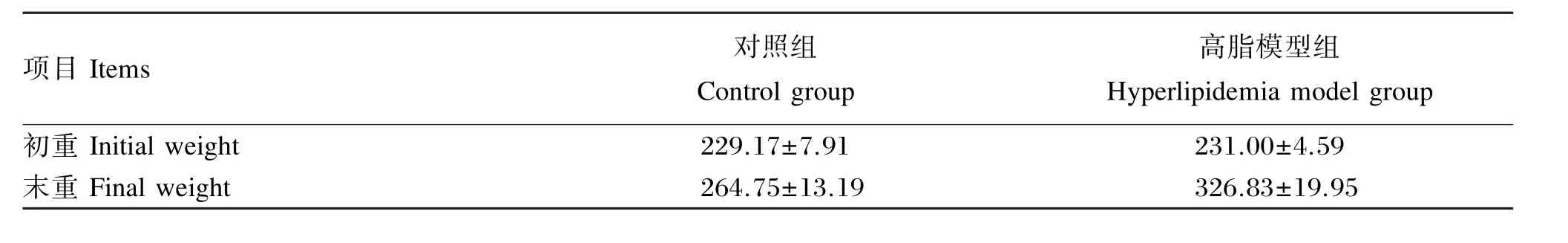
表2 高脂饲粮对建模期大鼠体重的影响Table 3 Effects of high⁃fat diet on body weight of rats during model⁃establishment period g
2.2 试验大鼠体重变化
由表3可以看出,各组间大鼠初重无显著差异(P>0.05)。造模结束后,各组造模后体重显著高于Ⅰ组(P<0.05)。试验结束后,与Ⅰ组相比,Ⅱ组、Ⅲ组大鼠末重极显著提高(P<0.01),Ⅳ组、Ⅴ组、Ⅷ组、Ⅸ组大鼠末重显著提高(P<0.05),Ⅵ组、Ⅶ组大鼠末重无显差异(P>0.05);与Ⅱ组相比,Ⅲ组、Ⅳ组大鼠末重显著降低(P<0.05),Ⅴ组、Ⅵ组、Ⅶ组、Ⅷ组、Ⅸ组大鼠末重极显著降低(P<0.01);与Ⅲ组相比,Ⅳ组大鼠末重无显著差异(P>0.05),Ⅴ组、Ⅷ组、Ⅸ组大鼠末重显著降低(P<0.05),Ⅵ组、Ⅶ组大鼠末重极显著降低(P<0.01)。
结果表明,向大鼠饲粮中添加一定量的鹅源草酸产果胶酶,能够显著抑制肥胖模型大鼠体重的增加。
2.3 大鼠Lee’s指数与体脂比
由表4可以看出,与Ⅰ组相比,Ⅱ组、Ⅲ组、Ⅳ组大鼠Lee’s指数极显著提高(P<0.01),Ⅴ组、Ⅵ组、Ⅶ组、Ⅷ组和Ⅸ组大鼠Lee’s指数均无显著差异(P>0.05);与Ⅱ组相比,Ⅲ组、Ⅳ组大鼠Lee’s指数显著降低(P<0.05),Ⅴ组、Ⅵ组、Ⅶ组、Ⅷ组和Ⅸ组大鼠Lee’s指数均极显著降低(P<0.01);与Ⅲ组相比,Ⅳ组大鼠Lee’s指数无显著差异(P>0.05),Ⅴ组、Ⅷ组和Ⅸ组大鼠Lee’s指数显著降低(P<0.05),Ⅵ组和Ⅶ组大鼠Lee’s指数均极显著降低(P<0.01)。
与Ⅰ组相比,Ⅶ组、Ⅷ组、Ⅸ组大鼠体脂比无显著差异(P>0.05),Ⅲ组、Ⅳ组、Ⅴ组、Ⅵ组大鼠体脂比显著提高(P<0.05),Ⅱ组大鼠体脂比极显著提高(P<0.01);与Ⅱ组相比,Ⅲ组、Ⅳ组、Ⅴ组、Ⅵ组大鼠体脂比显著降低(P<0.05),Ⅶ组、Ⅷ组、Ⅸ组大鼠体脂比极显著降低(P<0.01);与Ⅲ组相比,Ⅳ组、Ⅴ组、Ⅵ组大鼠体脂比无显著差异(P>0.05),Ⅷ组、Ⅸ组大鼠体脂比显著降低(P<0.05),Ⅶ组大鼠体脂比极显著降低(P<0.01)。其中Ⅶ组大鼠体脂比较Ⅲ组降低48.10%。
结果表明,鹅源草酸青霉产果胶酶能够有效降低肥胖模型大鼠Lee’s指数,控制体型发育;并能够降低肥胖模型大鼠机体脂肪沉积量,具有明显的降脂作用,从而改变了机体组织成分的构成。

表3 鹅源草酸青霉果胶酶对大鼠体重的影响Table 3 Effects of pectinase produced by Penicillium oxalicum Currie&Thom on body weight of rats
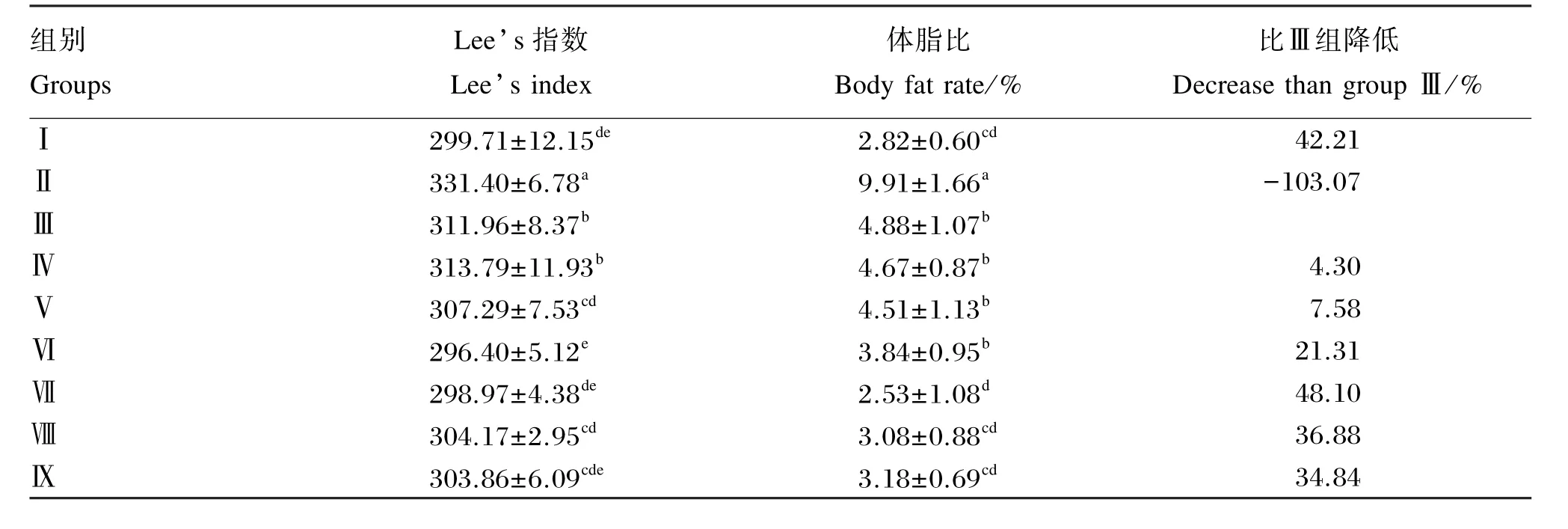
表4 鹅源草酸青霉果胶酶对大鼠Lee’s指数和体脂比的影响Table 4 Effects of pectinase produced by Penicillium oxalicum Currie&Thom on Lee’s index and body fat ratio of rats
2.4 大鼠脏体指数
由表5可以看出,与Ⅰ组相比,其他组大鼠心体指数、脾体指数、胃体指数、肾体指数和生殖体指数均无显著差异(P>0.05)。肝体指数有所差异,与Ⅰ组相比,Ⅱ组大鼠肝体指数极显著提高(P<0.01),Ⅲ组、Ⅳ组大鼠肝体指数显著提高(P<0.05),Ⅴ组、Ⅵ组、Ⅶ组、Ⅷ组、Ⅸ组大鼠肝体指数无显著差异(P>0.05);与Ⅱ组相比,Ⅲ组、Ⅳ组大鼠肝体指数无显著差异(P>0.05),Ⅴ组大鼠肝体指数显著降低(P<0.05),Ⅵ组、Ⅶ组、Ⅷ组、Ⅸ组大鼠肝体指数极显著降低(P<0.01);与Ⅲ组相比,Ⅳ组、Ⅴ组大鼠肝体指数无显著差异(P>0.05),Ⅵ组、Ⅶ组、Ⅷ组、Ⅸ组大鼠肝体指数显著降低(P<0.05)。
结果表明,肥胖模型大鼠由于摄入高脂饲粮,形成了脂肪肝,并引起肝重的增加;鹅源草酸青霉产果胶酶能够对其有效地进行干预,使其恢复到正常水平。

表5 鹅源草酸青霉果胶酶对大鼠脏体指数的影响Table 5 Effects of pectinase produced by Penicillium oxalicum Currie&Thom on organ index of rats %
2.5 大鼠血脂代谢
由表6可以看出,与Ⅰ组相比,Ⅲ组大鼠血清TC含量显著提高(P<0.05),Ⅱ组大鼠血清TC含量极显著提高(P<0.01),Ⅳ组、Ⅴ组、Ⅵ组、Ⅶ组、Ⅷ组和Ⅸ组均无显著差异(P>0.05);与Ⅱ组相比,Ⅲ组、Ⅴ组、Ⅷ组和Ⅸ组大鼠血清TC含量显著降低(P<0.05),Ⅵ组和Ⅶ组大鼠血清TC含量极显著降低(P<0.01),Ⅳ组大鼠血清TC含量无显著差异(P>0.05);与Ⅲ组相比,Ⅳ组、Ⅴ组、Ⅷ组和Ⅸ组大鼠血清TC含量均无显著差异(P>0.05),Ⅵ组和Ⅶ组大鼠血清TC含量显著降低(P<0.05)。
与Ⅰ组相比,Ⅱ组、Ⅲ组、Ⅷ组和Ⅸ组大鼠血清TG含量极显著提高(P<0.01),Ⅳ组大鼠血清TG含量显著提高(P<0.05),Ⅴ组、Ⅵ组和Ⅶ组均无显著差异(P>0.05);与Ⅱ组相比,Ⅲ组、Ⅳ组、Ⅷ组和Ⅸ组大鼠血清TG含量显著降低(P<0.05),Ⅴ组、Ⅵ组和Ⅶ组大鼠血清TG含量极显著降低(P<0.01);与Ⅲ组相比,Ⅳ组、Ⅷ组和Ⅸ组大鼠血清TG含量均无显著差异(P>0.05),Ⅴ组大鼠血清TG含量显著降低(P<0.05),Ⅵ组和Ⅶ组大鼠血清TG含量极显著降低(P<0.01)。
与Ⅰ组相比,Ⅱ组大鼠血清HDL⁃C含量显著降低(P<0.05),Ⅲ组、Ⅳ组、Ⅴ组、Ⅵ组、Ⅶ组、Ⅷ组和Ⅸ组大鼠血清HDL⁃C含量均无显著差异(P>0.05);与Ⅱ组相比,Ⅳ组、Ⅴ组、Ⅶ组、Ⅷ组和Ⅸ组大鼠血清HDL⁃C含量显著提高(P<0.05),Ⅵ组大鼠血清HDL⁃C含量极显著提高(P<0.01),Ⅲ组大鼠血清HDL⁃C含量无显著差异(P>0.05);与Ⅲ组相比,Ⅳ组、Ⅴ组、Ⅶ组、Ⅷ组和Ⅸ组大鼠血清HDL⁃C含量均无显著差异(P>0.05),Ⅵ组大鼠血清HDL⁃C含量显著提高(P<0.05)。
与Ⅰ组相比,Ⅱ组大鼠血清LDL⁃C含量显著提高(P<0.05),Ⅲ组、Ⅳ组、Ⅴ组、Ⅵ组、Ⅶ组、Ⅷ组和Ⅸ组大鼠血清LDL⁃C含量均无显著差异(P>0.05);与Ⅱ组相比,Ⅲ组、Ⅳ组、Ⅴ组、Ⅵ组、Ⅶ组、Ⅷ组和Ⅸ组大鼠血清LDL⁃C含量均显著降低(P<0.05);与Ⅲ组相比,Ⅳ组、Ⅴ组、Ⅵ组、Ⅶ组、Ⅷ组和Ⅸ组大鼠血清LDL⁃C含量均无显著差异(P>0.05)。
与Ⅰ组相比,Ⅱ组、Ⅳ组、Ⅴ组大鼠血清NEFA含量极显著提高(P<0.01),Ⅲ组、Ⅵ组、Ⅶ组、Ⅷ组和Ⅸ组大鼠血清NEFA含量显著提高(P<0.05);与Ⅱ组相比,Ⅲ组、Ⅵ组、Ⅶ组、Ⅷ组和Ⅸ组大鼠血清NEFA含量极显著降低(P<0.01),Ⅳ组、Ⅴ组大鼠血清NEFA含量显著降低(P<0.05);与Ⅲ组相比,Ⅳ组、Ⅴ组大鼠血清NEFA含量显著提高(P<0.05),Ⅵ组、Ⅶ组、Ⅷ组和Ⅸ组大鼠血清NEFA含量无显著差异(P>0.05)。
结果表明,在大鼠饲粮中添加一定量的鹅源草酸青霉产果胶酶能够显著降低大鼠血清中TC、TG、NEFA含量,并能提高HDL⁃C含量。
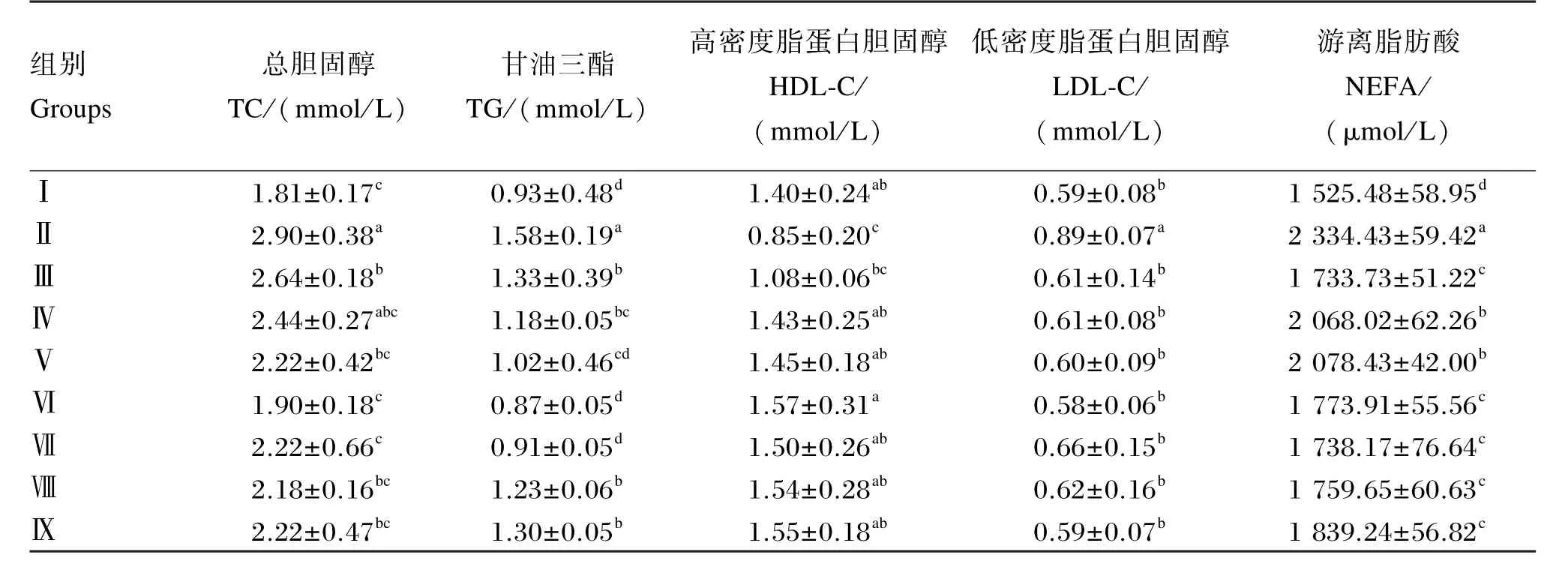
表6 鹅源草酸青霉果胶酶对大鼠血清脂类代谢的影响Table 6 Effects of pectinase produced by Penicillium oxalicum Currie&Thom on serum lipid metabolism of rats
2.6 大鼠肝脏指标
由表7可以看出,与Ⅰ组相比,Ⅱ组、Ⅲ组、Ⅳ组、Ⅴ组大鼠血清ALT活性极显著提高(P<0.01),Ⅵ组、Ⅶ组、Ⅸ组大鼠血清ALT活性显著提高(P<0.05),Ⅷ组大鼠血清ALT活性无显著差异(P>0.05);与Ⅱ组相比,Ⅲ组、Ⅳ组、Ⅴ组、Ⅵ组大鼠血清ALT活性显著降低(P<0.05),Ⅶ组、Ⅷ组、Ⅸ组大鼠血清ALT活性极显著降低(P<0.01);与Ⅲ组相比,Ⅳ组、Ⅴ组、Ⅵ组大鼠血清ALT活性无显著差异(P>0.05),Ⅶ组、Ⅸ组大鼠血清ALT活性显著降低(P<0.05),Ⅷ组大鼠血清ALT活性极显著降低(P<0.01)。
与Ⅰ组相比,Ⅱ组、Ⅲ组、Ⅳ组、Ⅴ组、Ⅵ组大鼠血清AST活性极显著提高(P<0.01),Ⅶ组、Ⅷ组、Ⅸ组大鼠血清AST活性显著提高(P<0.05);与Ⅱ组相比,Ⅲ组、Ⅳ组、Ⅴ组、Ⅵ组大鼠血清AST活性显著降低(P<0.05),Ⅶ组、Ⅷ组、Ⅸ组大鼠血清AST活性极显著降低(P<0.01);与Ⅲ组相比,Ⅳ组、Ⅴ组、Ⅵ组大鼠血清AST活性无显著差异(P>0.05),Ⅶ组、Ⅷ组、Ⅸ组大鼠血清AST活性显著降低(P<0.05)。
与Ⅰ组相比,Ⅱ组大鼠血清LPL活性显著降低(P<0.05),Ⅲ组和Ⅳ组大鼠血清LPL活性无显著差异(P>0.05),Ⅴ组、Ⅵ组大鼠血清LPL活性显著提高(P<0.05),Ⅶ组、Ⅷ组、Ⅸ组大鼠血清LPL活性极显著提高(P<0.01)。与Ⅱ组相比,Ⅲ组和Ⅳ组大鼠血清LPL活性显著提高(P<0.05),Ⅴ组、Ⅵ组、Ⅶ组、Ⅷ组、Ⅸ组大鼠血清LPL活性极显著提高(P<0.01);与Ⅲ组相比,Ⅴ组、Ⅵ组大鼠血清LPL活性显著提高(P<0.05),Ⅶ组、Ⅷ组、Ⅸ组大鼠血清LPL活性极显著提高(P<0.01),Ⅳ组大鼠血清LPL活性无显著差异(P>0.05)。
与Ⅰ组相比,Ⅱ组大鼠血清HL活性极显著降低(P<0.01),Ⅲ组大鼠血清HL活性显著降低(P<0.05),Ⅵ组大鼠血清HL活性极显著提高(P<0.01),Ⅳ组、Ⅴ组、Ⅶ组、Ⅷ组、Ⅸ组大鼠血清HL活性无显著差异(P>0.05);与Ⅱ组相比,Ⅲ组大鼠血清HL活性显著提高(P<0.05),Ⅳ组、Ⅴ组、Ⅵ组、Ⅶ组、Ⅷ组、Ⅸ组大鼠血清HL活性极显著提高(P<0.01)。与Ⅲ组相比,Ⅳ组、Ⅴ组、Ⅷ组大鼠血清HL活性显著提高(P<0.05),Ⅵ组、Ⅶ组、Ⅸ组大鼠血清HL活性极显著提高(P<0.01)。
结果表明,鹅源草酸青霉产果胶酶能够降低大鼠血清ALT和AST活性,并能在一定程度上提高大鼠血清LPL和HL活性。
3 讨 论
3.1 高脂饲粮诱导肥胖大鼠模型的建立
昝玉玺等[11]研究表明,高脂饲粮能够引起大鼠产生肥胖,并且同时伴有高脂血症;王根辈等[12]研究表明,应用限制喂养的方法便于造成营养性的大鼠肥胖模型,并引起动物高脂血症,以上研究都与本试验的原理和结果基本相同。本试验选取(220±20)g的健康雄性Wistar大鼠,饲喂60%高脂饲粮的肥胖模型组大鼠在第2周时,体重开始高于饲喂基础对照饲粮的Ⅰ组20%以上,表明60%高脂饲粮诱导肥胖大鼠模型建立成功。
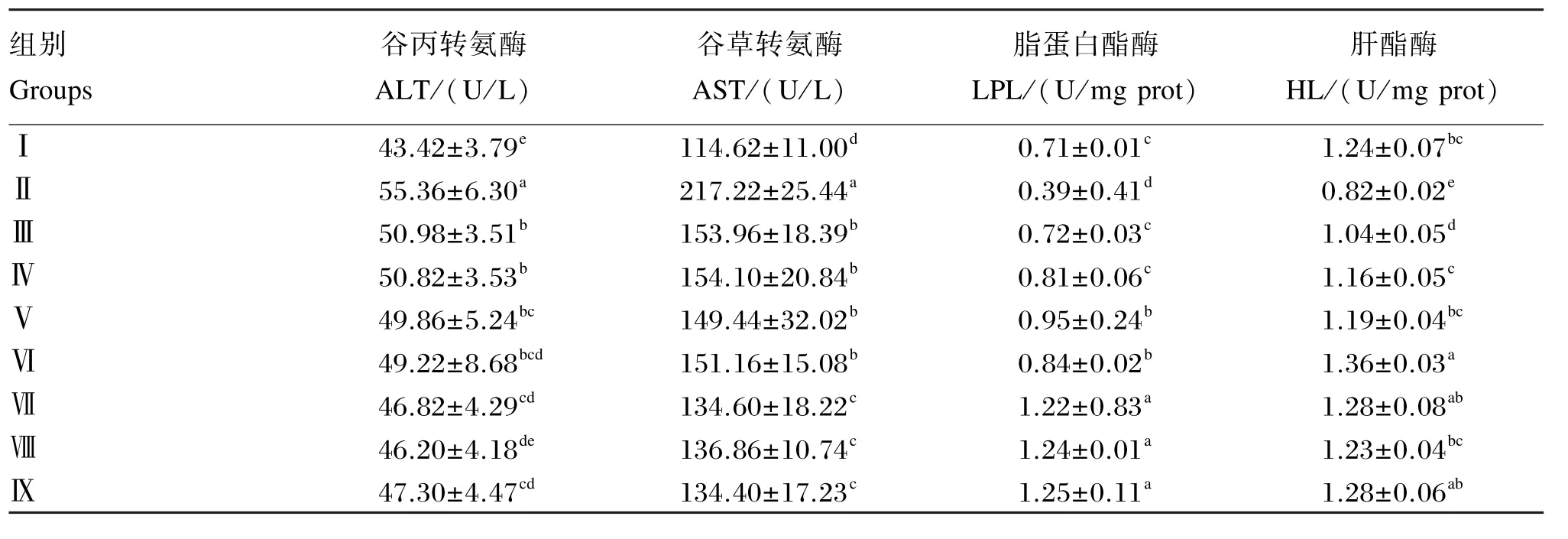
表7 鹅源草酸青霉果胶酶对大鼠肝脏脂类代谢酶活性的影响Table 7 Effects of pectinase produced by Penicillium oxalicum Currie&Thom on liver lipid metabolism enzyme activity of rats
3.2 鹅源草酸青霉产果胶酶对肥胖大鼠Lee’s指数和体脂比的影响
姜晓霞等[8]研究表明,在肉鸡的饲粮中添加0.25%的果胶酶对肉鸡的生长发育影响显著,并可以显著提高胸肌和腿肌率,降低腹脂率。何明等[13]的研究表明,Lee’s指数用于评价成年大鼠肥胖程度方面具有可行性和准确性,因此可以用Lee’s指数来作为评价成年肥胖模型大鼠肥胖程度的指标。黄宗锈等[14]研究表明,在人的食物中添加左旋肉碱可以使肥胖受试者的体重下降0.7 kg,体脂总量减少0.6 kg。本试验研究表明,与Ⅱ组相比,鹅源草酸青霉产果胶酶组的Lee’s指数和体脂比显著或极显著降低;与Ⅲ组相比,鹅源草酸青霉产果胶酶组能降低大鼠的Lee’s指数和体脂比。结果表明,鹅源草酸青霉产果胶酶可以有效抑制脂肪的沉积,从而起到降低内脏脂肪,达到体重降低的目的。
3.3 鹅源草酸青霉产果胶酶对肥胖大鼠血脂变化的影响
肥胖与饮食含量,环境因素有着密切的关系,高热量高油脂的饮食会引发多种新陈代谢疾病[15]。陈文岳等[16]研究表明,应用乌龙茶治疗肥胖症可以明显减轻体重,减少腹部皮下脂肪和TG 及TC含量。王慧铭等[17]研究表明,昆布多糖能够降低TG和TC含量,改善血清HDL⁃C含量,作用于洛伐他汀无异。刘庆阳等[18]研究表明,在饲粮中每天添加100 mg/kg的大黄酸可以降低肥胖大鼠NEFA含量。李潇等[19]研究表明,对肥胖大鼠每天按照100 mg/kg灌胃石榴花多酚可以显著降低血清中的NEFA含量。本试验结果表明,与Ⅱ组相比,鹅源草酸青霉产果胶酶组的TC、TG、LDL⁃C、NEFA含量显著降低,HDL⁃C含量显著提高;与Ⅲ组相比,鹅源草酸青霉产果胶酶组的LDL⁃C和NEFA含量无显著差异,TC、TG含量或显著性降低。结果表明,鹅源草酸青霉产果胶酶可以有效降低肥胖大鼠的TC、TG含量,并能提高HDL⁃C含量。
3.4 鹅源草酸青霉产果胶酶对肥胖大鼠肝脏脂类代谢酶活性的影响
ALT和AST是肝功能检测中2个重要指标,其高低标志着肝细胞实质损害的程度。当肝组织损伤时,细胞内转氨酶可进入血中,引起血ALT含量升高。AST存在于肝细胞浆内,并分布于线粒体内,当肝细胞损害严重时,线粒体内AST释放入血液中,使血清AST含量升高。陈丽等[20]研究发现,将柿叶总黄酮喂食饮食性高脂血症大鼠可使试验组大鼠血清AST和ALT活性降低。范婷婷[21]研究发现,将荷叶生物碱给予高脂血症大鼠,血清中的ALT和AST活性均有显著降低,效果接近于降脂药物辛伐他汀。本试验发现,添加果胶酶试验组与Ⅱ组和对照组相比,大鼠血清ALT和AST活性显著或极显著降低。结果表明,添加果胶酶能够降低肥胖模型大鼠血清ALT和AST活性,对肥胖造成的肝损伤有明显修复作用。
LPL和HL是脂质代谢中的关键酶,能够降低血浆脂蛋白和TG含量;LPL和HL高表达量可以有效抑制血清中的胆固醇和TG活性,并能提高高密度脂蛋白含量,有效避免高脂血症和脂肪肝的发生。曹阿芳等[22]研究表明,将车前子多糖中高剂量添加到饲粮中,大鼠的血清的LPL活性较正常模型组显著升高。徐新颖等[23]研究表明,将海带粉加入到大鼠饲粮中,动物血清和肝组织中的LPL和HL活性均高于模型对照组和阳性对照组。本试验结果表明,添加果胶酶能够明显提高肥胖模型大鼠血液中LPL和HL活性,从而加强脂类代谢,达到减少机体脂肪沉积的作用。有关果胶酶降血脂分子调控机制还有待于研究。
4 结 论
综上试验结果表明,鹅源草酸青霉产果胶酶对肥胖模型大鼠具有如下修复作用:
①能够有效抑制肥胖模型大鼠体重的增长,降低Lee’s指数,控制体型发育。
②能够降低肥胖模型大鼠机体脂肪沉积量,具有明显的降脂作用。
③能够有效地对肥胖模型大鼠由于摄入高脂饲粮引起的脂肪肝进行干预,使其恢复到正常水平。
④能够降低肥胖模型大鼠血清TC、TG、LDL⁃C、NEFA含量,提高血清HDL-C含量。
⑤能够降低肥胖模型大鼠血清ALT和AST活性,提高血清LPL和HL活性。
参考文献:
[1] 冯建岭,韩晴,代增英,等.果胶酶在食品中的应用研究[J].江苏调味副食品,2014(02):9-11.
[2] 方华平,程茂基.果胶酶在食品与饲料工业中的应用[J].饲料博览,2006(05):34-35.
[3] OSEI S A,ODURO S.Effects of dietary enzyme on broiler chickens fed diets containing wheat bran[J].Journal of Animal and Feed Sciences,2000,9(4):681-686.
[4] TAHIR M,SALEH F,OHTSUKA A,et al.Pectinase plays an important role in stimulating digestibility of a corn⁃soybean meal diet in broilers[J].The Journal of Poultry Science,2006,43(4):323-329.
[5] 雷廷,呙于明,王耀辉,等.饼粕类饲粮原料中添加果胶酶对肉鸡回肠氨基酸消化率和代谢能的影响[J].动物营养学报,2014,26(02):453-465.
[6] 许毅.果胶酶对肉鸡玉米豆粕型饲粮养分利用率的影响[D].硕士学位论文.南京:南京农业大学,2004.
[7] 王春林,陆文清,李德发,等.果胶酶对肉仔鸡生长性能及屠体性状的影响[J].中国畜牧杂志,2004 (02):19-21.
[8] 姜晓霞,王宝维,孙鹏,等.鹅源草酸青霉产果胶酶对肉鸡生长发育影响研究[C]//中国家禽科学研究进展———第十四次全国家禽科学学术讨论会论文集.北京:中国农业科学技术出版社,2009.
[9] 梅宁安,白洁,邵喜成,等.饲粮级果胶酶对肉仔鸡生长性能的影响[J].家禽科学,2014(02):12-13.
[10] LEAN M E J,HAN T S,MORRISON C E.Waist circumference as a measure for indicating need for weight management[J].British Medical Journal,1995,311(6998):158-161.
[11] 昝玉玺,王天云,董卫华,等.高脂饲粮诱发大鼠肥胖模型的实验研究[J].现代预防医学,2008,16:3131-3132.
[12] 王根辈,栗志文,曹晶,等.高脂饮食诱发大鼠营养性肥胖动物模型的研究[J].吉林医学,2012(01):5-7.
[13] 何明,涂长春,黄起壬,等.Lee’s指数用于评价成年大鼠肥胖程度的探讨[J].中国临床药理学与治疗学杂志,1997(03):177-179.
[14] 黄宗锈,林健,林春芳.左旋肉碱对肥胖人员减肥作用的效果观察[J].预防医学论坛,2007(01):6-8.
[15] FORD E S,GILES W H,DIETZ W H.Prevalence of the metabolic syndrome among US adults:findings from the third national health and nutrition examina⁃tion survey[J].The Journal of the American Medical Association,2002,287(3):356-359.
[16] 陈文岳,林炳辉,陈岭,等.福建乌龙茶治疗单纯性肥胖症的临床研究[J].中国茶叶,1998(01):20-21.
[17] 王慧铭,孙炜,黄素霞,等.昆布多糖对大鼠减肥及降血脂作用的实验研究[J].中国现代应用药学,2008 (01):16-19.
[18] 刘庆阳,于世家.大黄酸对糖尿病肥胖大鼠脂肪组织抵抗素基因表达及血浆游离脂肪酸水平的影响[J].中华中医药杂志,2009(08):1061-1063.
[19] 李潇,魏媛媛,窦勤,等.石榴花多酚对2型糖尿病大鼠游离脂肪酸和胰岛素抵抗的影响[J].中成药,2011(04):679-682.
[20] 陈丽,梁宇红,马新博,等.柿叶总黄酮对高脂血症大鼠脂肪肝和脂蛋白代谢相关酶的影响[J].中国现代应用药学,2011(07):606-611.
[21] 范婷婷.荷叶生物碱类物质降脂减肥活性研究[D].硕士学位论文.杭州:浙江大学,2013.
[22] 曹阿芳.车前子多糖防治大鼠高脂血症的实验研究
[D].硕士学位论文.石家庄:河北医科大学,2014.[23] 徐新颖,于竹芹,帅莉,等.海带对实验性高脂血症大鼠血脂水平的调节作用机制[J].中华中医药杂志,2011(02):384-387.
(责任编辑 武海龙)
Effects of Pectinase Produced by Penicillium oxalicum Currie&Thom on Body Weight,Lipid Deposition and Lipid Metabolism of Obese Model Rats
XU Xiaobo WANG Baowei∗GE Wenhua ZHANG Mingai XIE Chao
(Nutrition and Feed Laboratory of China Agriculture Research System,Institute of High Quality Waterfowl,Qingdao Agricultural University,Qingdao 266109,China)
Abstract:This experiment was conducted to study the effects of pectinase produced by Penicillium oxalicum Currie&Thom on body weight,lipid deposition and lipid metabolism of obese model rats.A total of 108 male rats with body weight of 220 to 240 g,adapted feeding 3 days.The rats were divided into control group (groupⅠ),hyperlipidemia group(groupⅡ)and other hyperlipidemia model groups.After successful mod⁃eling,the rats were randomly divided into 7 groups with 3 replicates per group and 4 rats per replicate.Rats in the 7 groups were fed the basal diets supplemented with 0(groupⅢ),0.01%(groupⅣ),0.05%(groupⅤ),0.1%(groupⅥ),0.2%(groupⅦ),0.4%(groupⅧ)and 0.8%(groupⅨ)pectinase,respectively.The experiment last for 8 weeks.The results showed as follows:1)the pectinase produced by Penicillium oxa⁃licum Currie&Thom could restrain the increasing weight,decreased the Lee’s index and control portion size of obese model rats.2)The pectinase could significantly reduce the amount of lipid deposition of obese model rats.3)The pectinase could restore the fatty liver disease of obese model rats to the normal level due to intake of high⁃fat diet.4)The pectinase could reduce the content of total cholesterol,total triglyceride,low⁃density lipoprotein cholesterol and nonesterified fatty acid in serum of obese model rats,and increase the serum high⁃density lipoprotein cholesterol content.5)It also could reduce the activity of aspartate transaminase and alanine aminotransferase in serum of obese model rats,and increase the activity of serum lipoprotein lipase and hepati⁃cendothelaillipase in serum.In conclusion,the pectinase produced by Penicillium oxalicum Currie&Thom has significant effect on reducing the deposition and serum lipid of obese model rats.[Chinese Journal of Animal Nutrition,2015,27(5):1650⁃1658]
Key words:pectinase produced by Penicillium oxalicum Currie&Thom;obese rats;lipid deposition;lipid metabolism
Corresponding author∗,professor,E⁃mail:wangbw@qau.edu.cn
通信作者:∗王宝维,教授,研究生导师,E⁃mail:wangbw@qau.edu.cn
基金项目:国家农业科技成果转化资金项目(2013G B2C 620543);山东省农业科技成果转化资金项目(鲁科农字2012⁃65)
作者简介:徐晓波(1989—),男,山东潍坊人,硕士研究生,研究方向为营养与保健。E⁃mail:xiaobo45697@126.com
收稿日期:2014-11-01
doi:10.3969/j.issn.1006⁃267x.2015.05.038
中图分类号:S816.7
文献标识码:A
文章编号:1006⁃267X(2015)05⁃1650⁃09
