猪小肠上皮细胞分离培养与鉴定
2015-05-09左晓昕陈银银贡笑笑占今舜赵国琦扬州大学动物科学与技术学院扬州225009
詹 康 左晓昕 陈银银 贡笑笑 占今舜 赵国琦(扬州大学动物科学与技术学院,扬州225009)
猪小肠上皮细胞分离培养与鉴定
詹 康 左晓昕 陈银银 贡笑笑 占今舜 赵国琦∗
(扬州大学动物科学与技术学院,扬州225009)
摘 要:为建立功能性永生化的猪小肠上皮细胞系,并为猪肠道营养吸收与免疫调控以及仔猪肠道疾病发病机制的研究提供细胞模型,本试验采用组织块培养法来分离纯化猪小肠上皮细胞,并通过细胞角蛋白18、细胞增殖曲线、核型分析来鉴定猪小肠上皮细胞。结果表明:1)采用组织块培养法能够成功培养猪小肠上皮细胞并稳定传11代。2)本试验获得的猪小肠上皮细胞角蛋白18抗原鉴定为阳性,染色体核型为二倍体。3)倒置显微镜下观察培养至第11代的猪小肠上皮细胞仍然保持着上皮细胞的特征,呈现“铺路石”和上皮样形态。培养11代后的猪小肠上皮细胞间隙开始变大,规则不明显,细胞开始凋亡。第15代的猪小肠上皮细胞则出现大量凋亡并从瓶底脱落,仅有很少细胞贴壁生长。综上所述,采用组织块培养法能够获得生物学功能稳定的猪小肠上皮细胞系并能正常传11代,可为细胞的永生化提供试验素材。
关键词:猪小肠上皮细胞;功能性;肠道营养与免疫;永生化
小肠上皮细胞是动物体内最重要的消化吸收细胞,在仔猪肠道营养吸收与肠道免疫调控发挥重要作用[1-2]。国外研究分离肠上皮细胞多采用酶消化法,但是主要用于研究人、小鼠等,猪小肠上皮细胞组织块培养鲜见报道。多位研究人员证实,利用酶消化法获得猪回肠、空肠上皮细胞,并转染SV40病毒基因可获得永生化细胞[3-8]。Con⁃teas等[9]利用小肠上皮细胞为模型在体外研究表皮生长因子(EGF)和生长抑制因子对小肠上皮细胞DNA合成的影响,结果表明这些因子能够上调小肠上皮细胞DNA的表达。Carrol等[10]在利用基质胶来研究小肠上皮细胞的分化功能,并发现基质胶能够上调小肠上皮细胞基因的表达量。国外已经建立了一些猪小肠上皮细胞系,但是这些细胞系在国内还未永生化和商品化,很难重复获得猪小肠上皮细胞系,而且这些细胞系还未进行功能的验证[4]。本试验旨在建立功能性的猪小肠上皮细胞系并进行功能性验证,为猪小肠上皮细胞的营养吸收、肠道免疫调控机制的研究和猪小肠上皮细胞系永生化提供功能性的细胞素材。
1 材料与方法
1.1 材料
刚出生的仔猪小肠组织块(无菌活体采样)。DMEM/F12完全培养基:10%澳洲胎牛血清(FBS)、0.25%Trypsin⁃EDTA、5 mL胰岛素-转铁蛋白-硒-乙醇胺溶液(均为Gibco公司产品)。100 U/mL青霉素、100 μg/mL链霉素、4 mmol/L谷氨酰胺溶液、2.8 μmol/L氢化可的松、噻唑蓝(MTT)(均为Sigma公司产品)。15 ng/mL EGF (Peprotech公司产品)。细胞角蛋白18单克隆抗体、抗羊异硫氰酸荧光素(FITC)荧光二抗(Santa Cruz公司产品)。
1.2 猪小肠上皮细胞原代的培养
在实验室超净台中,将刚出生的仔猪进行无菌活体采样并放入含有3倍体积的青霉素和链霉素的培养基中。用杜氏磷酸盐缓冲液(DPBS)清洗小肠组织数次,剔除肠系膜。将组织移至另一培养皿中,用DPBS再次清洗,直至上清液清亮。再用DMEM/F12完全培养基反复清洗组织,直至培养基上清液清亮并转移至100 mL小烧杯中,并用小剪刀将组织剪成<1 mm3的组织块,静置5 min自行沉淀,弃上清。继续剪碎,加无血清培养基悬浮组织块,再转移至15 mL的离心管中清洗,1 000 r/min离心5 min,弃上清。反复清洗组织块,直至上清液清亮。加入2 mL的10%FBS的DMEM/F12完全培养基悬浮组织块,用扩口移液管将组织块转入6孔板中,放入二氧化碳(CO2)培养箱中培养。刚开始加入适量的DMEM完全培养基润湿组织即可,切记不能让组织块漂起来。第2天,再加入1 mL的DMEM完全培养基。
1.3 猪小肠上皮细胞的纯化和克隆
当6孔板内培养的猪小肠上皮细胞开始出现大部分集落时,同时仍然有大量成纤维细胞,这时候可以加0.05%胰蛋白酶消化并放置在显微镜下观察猪小肠上皮细胞的皱缩和发亮的程度。不时拍打6孔板和底部,这时大量的成纤维细胞会从底部脱落下来,然而也有少量的上皮细胞脱落下来。经几次反复敲打,大部分成纤维细胞脱落下来,但是猪小肠上皮细胞仍然贴壁。DPBS清洗3次,然后用EDTA消化,再用0.05%胰蛋白酶消化,血清培养基终止消化,吹打并悬浮细胞计数,使细胞密度为50个/mL。取100 μL细胞悬液加入96孔板中,培养1周。
1.4 猪小肠上皮细胞生长曲线的测定
取第5代猪小肠上皮细胞,96孔板接种细胞2×103个,24 h之后取8孔,每孔加20 μL的MTT溶液放入培养箱继续培养4 h。吸出MTT溶液再用磷酸盐缓冲液(PBS)清洗细胞2~3遍并吸弃,每孔加入150 μL的DMSO,振荡10 min。吸出8孔的液体并转入96孔板中,490 nm吸光度(OD)值,连续测9 d。
1.5 猪小肠上皮细胞角蛋白18的鉴定
将猪小肠上皮细胞按1×104个/cm2接种于4孔腔室玻片(chamber slide)。待细胞密度达到90%时用DPBS洗3次。用4%可溶性聚四氟乙烯(PFA)和丙酮/甲醇(1∶1)放置4℃冰箱固定30 min,然后DPBS轻轻洗3次,防止细胞脱落下来。3%鸡血清室温封闭30 min,移除血清。加细胞角蛋白18一抗,对照组加PBS,放置4℃冰箱过夜。DPBS洗3次,荧光素驴抗羊二抗室温避光孵育1 h。DPBS清洗3次,4′,6-二脒基-2-苯基吲哚(DAPI)室温染色7 min。DPBS洗3次,蒸馏水洗1次,封固剂封片,避光。
1.6 猪小肠上皮细胞核型分析
根据Sun等[11]染色体核型分析方法并进行稍微的修改。取第10代猪小肠上皮细胞,加秋水仙素到培养液中至终浓度为0.05 μg/mL,在37℃培养箱中继续培养3~4 h,大部分处于细胞分裂中期。胰蛋白酶消化分离细胞后转入15 mL离心管,4℃下1 000 r/min离心3 min收集细胞。吸去上清液加入预热至37℃的0.075 mol/L氯化钾(KCl)溶液7 mL,轻轻吹打均匀,37℃培养箱中温育17 min。悬液中加入新鲜固定液1 mL,轻轻吹打混匀。将悬液以1 400 r/min离心10 min去上清。加入新鲜固定液7 mL吹打混匀,室温静置30 min,1 400 r/min离心10 min弃上清液,重复上个步骤1次。视细胞量加入固定液0.5 mL,吹打均匀。取出预冷的载玻片,将载玻片倾斜45°,在载玻片上方用吸管迅速滴上2~3滴细胞悬液,用嘴轻轻吹散使细胞分散均匀,室温干燥。吉姆萨(Giemsa)工作液染色15 min,冲洗,空气干燥。先用低倍镜寻找良好的分裂相,再使用高倍镜观察。
2 结 果
2.1 猪小肠上皮细胞的原代培养
由图1可知,组织块在培养大约18 h后即可贴壁,但是贴壁不牢。此外,组织块周围辐射出少量的猪小肠成纤维细胞和上皮细胞(图2)。第5天猪小肠成纤维细胞大量增殖并处于对数生长期,猪小肠上皮细胞和成纤维细胞夹杂着生长(图3)。同时,猪小肠上皮细胞也开始大量增殖并形成细胞集落(图4)。细胞培养至第7天,一些猪小肠上皮细胞开始衰老,细胞体积变大,细胞形态发生改变(图5)。本试验对猪小肠上皮细胞每3 d进行传代,传至第12代时,细胞开始衰老,细胞增殖缓慢;传至第15代时,细胞增殖缓慢,基本上停止生长,细胞体积变大,最终从瓶底脱落。
2.2 猪小肠上皮细胞的纯化和克隆
由图6可知,通过96孔板单克隆猪小肠上皮细胞,成功克隆出4个孔为猪小肠上皮细胞。在克隆的过程中,也有一些孔生长出上皮样细胞。随着培养时间增加,很多孔的猪小肠上皮细胞开始衰老、凋亡。但是,仍然有很少孔的细胞依然增殖。通过酶消化传代接种至24孔板,对猪小肠上皮细胞进行扩大培养,扩大培养观察见图7。

图1 组织块培养大约18 h后发生贴壁(物镜)Fig.1 The tissue fragment adhering to the wall after about 18 h culture(objective,4×)
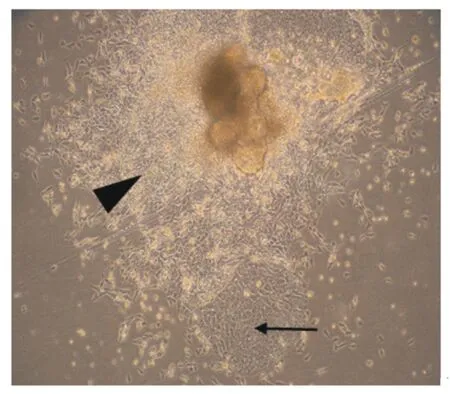
图2 培养18 h后猪小肠成纤维细胞和上皮细胞开始分裂(物镜)Fig.2 The porcine intestinal fibroblast cells and epithelial cells began to divide after 18 h culture(objective,4×)

图3 第5天猪小肠成纤维细胞开始大量增殖(物镜)Fig.3 The porcine intestinal fibroblasts cells started to great proliferate in day 5(objective,4×)

图4 第5天猪小肠上皮细胞开始大量增殖(物镜)Fig.4 The porcine intestinal epithelial cells started to great proliferate in day 5(objective,4×)

图5 第7天一些猪小肠上皮细胞开始衰老(物镜)Fig.5 Some porcine intestinal epithelial cells started to senesce in day 7(objective,4×)
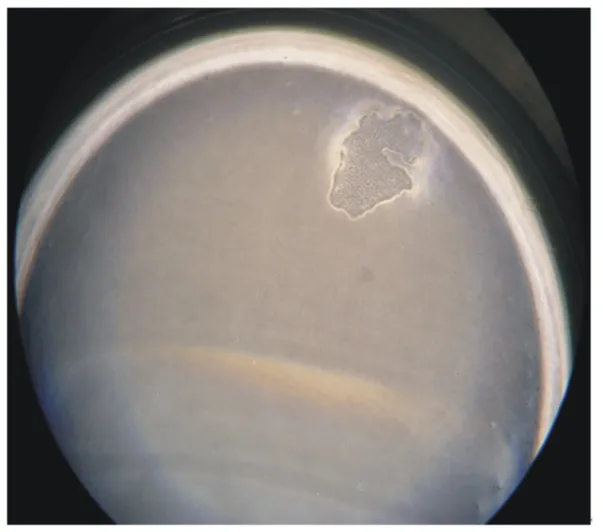
图6 利用96孔板有限稀释法获得单克隆猪小肠上皮细胞系(物镜)Fig.6 Use 96⁃well plates limiting dilution method to achieve monoclonal porcine intestinal epithelial cells line(objective,4×)
2.3 猪小肠上皮细胞生长曲线的测定
图8显示,第1~3天细胞生长缓慢,第4~6天细胞处于对数生长期增殖旺盛,第7天开始细胞达到平台期,细胞增殖缓慢,细胞生长曲线为“S”形。以上数据暗示符合细胞生长的一般规律。

图7 单克隆的猪小肠上皮细胞扩大培养(物镜)Fig.7 The monoclonal porcine intestinal epithelial cell lines was cultured expand(objective,4×)

图8 猪小肠上皮细胞生长曲线Fig.8 Growth curve of porcine intestinal epithelial cells
2.4 猪小肠上皮细胞角蛋白18的鉴定
由图9可知,通过显微镜荧光拍照视野下的所有细胞都发出绿色荧光,这说明每个细胞表面都有细胞角蛋白18抗原表达,表明克隆的细胞为猪小肠上皮细胞。

图9 猪小肠上皮细胞角蛋白18的免疫荧光Fig.9 The porcine intestinal epithelial cellscytokeratin 18 immunofluorescence
2.5 猪小肠上皮细胞核型分析
对传至第10代的猪小肠上皮细胞进行染色体核型分析(图10)。由分析结果可知,第10代的猪小肠上皮细胞染色体数基本上是38条,只有很少细胞的染色体是37条,这可能是细胞悬液在滴板的时候细胞分散所致。以上数据进一步表明传至第10代的猪小肠上皮细胞具有稳定的生物学功能。

图10 猪小肠上皮细胞核型分析Fig.10 Karyotype analysis of the porcineintestinal epithelial cells
3 讨 论
3.1 组织块法培养原代猪小肠上皮细胞
本试验利用的组织块培养法是获得猪小肠上皮细胞最可行的方法。由于该方法未经任何酶的处理,因此能够获得活力很高且增殖旺盛的猪小肠上皮细胞,这为细胞的转基因奠定基础。国外研究人员基本上是通过酶消化法获得猪小肠上皮细胞,这种方法虽然能获得大量的上皮细胞,但是经过高浓度的酶消化后,细胞膜表面的一些蛋白受体会丢失[12-13]。细胞间的信号转导主要依赖于膜蛋白受体与膜外蛋白相互结合,改变膜蛋白受体结构并产生一系列的分子信号转导。如果膜蛋白受损,这将导致细胞间的信号转导受到抑制,无法正常发挥细胞的生物学功能。因此,组织块培养法培养细胞是获得功能性细胞的前提。Bouhet等[14]对新生的仔猪小肠采样,通过组织块培养建立了猪小肠上皮细胞系。本试验采用组织块培养法成功获得单克隆猪小肠上皮细胞。组织块培养细胞时要注意:首先要避免组织被微生物污染。从冰上取出离心管之后,用酒精喷洒离心管周围。所有玻璃移液管在吸取组织块时,要预先润湿玻璃管,以防止组织块沾在管内壁。小肠组织块接种到6孔板的数量也是非常重要的,量少导致细胞难以增殖,过多会导致细胞聚集严重。组织块接种到6孔板之后,孔内培养液的用量是猪小肠上皮细胞能否成功培养的关键。接种的组织块润湿后轻轻贴在底部即可,组织上表面也不能干涸,组织过分的干涸会导致组织产生霉菌污染。24 h之后可以适当增加培养基,但绝不能使组织块漂起。原代培养过程中,要每天观察孔内细胞的培养状况,如有污染应立即丢弃。从培养箱拿出6孔板时,禁止晃动,防止组织块漂起来。本试验研究结果表明,利用组织块法培养猪小肠上皮细胞能够获得大量有活力的猪小肠上皮细胞,可为下游试验提供较好的素材。
3.2 猪小肠上皮细胞的分离纯化与克隆
组织块细胞培养法最大的优点是细胞活力强,稳定性好。但是,上皮细胞与成纤维细胞夹杂生长,这对上皮细胞的纯化产生困难。虽然,杂细胞对猪小肠上皮细胞生长是必需的,但是成纤维细胞等杂细胞过度增殖反而会抑制猪小肠上皮细胞的生长[15]。细胞纯化方法有很多种,如相差贴壁和相差消化法、刮除法、克隆环和96孔有限稀释法。Rose等[16]利用有限稀释法在96孔板中每孔接种1个细胞,最终获得单克隆的乳腺上皮细胞株。本试验采用相差消化法来纯化猪小肠上皮细胞。首先用细胞刮刀将大部分成纤维细胞刮掉,用DPBS清洗以去除杂细胞。这时,与上皮细胞生长距离很近的成纤维细胞用刮除法是不可行,会导致上皮细胞也会被刮掉。这时采用0.05%胰蛋白酶来消化细胞,敲打皿壁,放入培养箱温育1 min。在纯化的过程中,胰蛋白酶的浓度和消化时间非常重要。由于成纤维细胞和上皮细胞对胰蛋白酶的敏感性不同,0.05%胰蛋白酶就可以轻松把成纤维细胞消化下来,而上皮细胞只有很少部分皱缩发亮,但是不会脱落仍继续贴壁。消化时间是本实验室摸索出来的最佳时间,能够最低限度减少对上皮细胞的伤害。如果在纯化过程中还有杂细胞生长,可采用相差贴壁法,这是由于成纤维细胞比上皮细胞贴壁快。放入培养箱中20 min,成纤维细胞基本上贴壁,上皮细胞没有贴壁或贴壁不牢,轻轻晃动培养皿将培养基移入另一培养瓶中,此时培养瓶中基本上是上皮细胞。此外,我们发现培养基表面也漂浮着很少发亮死细胞,这可能是胰蛋白酶二次消化和吹打过程造成的,只要上皮细胞贴壁之后立即吸弃死细胞,基本对细胞生长无影响。然而,单克隆细胞才是本试验最理想的猪小肠上皮细胞系。国外克隆细胞一般采用克隆环方法,但是本试验未获得成功,可能是由于技术上不够娴熟,有待进一步研究。利用96孔有限稀释法克隆细胞,最关键的是避免孔与孔之间的污染。每孔里面大约5个细胞,每隔2 d观察细胞生长情况,直至细胞密度达到50%即可转入到24孔板中进行扩大培养。PBS清洗细胞时用排枪吸弃,避免用单道枪,防止孔与孔交叉污染。
3.3 猪小肠上皮细胞生长曲线的测定
猪小肠上皮细胞的生长特性对于上皮细胞的形态及功能具有至关重要的作用。由于本试验所培养的细胞是非转化的细胞,因此生长的速度要比转化的细胞慢。为了克服这个障碍,细胞每3 d传代1次。本试验接种的细胞数目为1.2× 104个/cm2,3 d之后猪小肠上皮细胞生长密度为70%。细胞培养前5代时,上皮细胞增殖比较旺盛。在接种数目相同的情况,第7代之后细胞生长速度明显减慢,细胞开始出现衰老和凋亡,细胞间隙开始变大,单个细胞开始变大,之后细胞开始脱落。有研究认为原代培养的细胞群体倍增20 (PD20)之后,细胞经过死亡阶段0期(M0期),一部分细胞开始死亡,之后,开始进入死亡阶段1期(M1期)和死亡阶段2期(M2期),这时候细胞开始大量凋亡。一些病毒蛋白可使肿瘤抑制蛋白(pRb)失活并可越过MI期,细胞继续生长[17-18]。Liu等[19]利用E6病毒蛋白使肿瘤抑制因子p53失活并激活端粒酶,使细胞成功逃离M2期,细胞产生无限增殖的永生化细胞。本试验所培养的猪小肠上皮细胞是未经转化的细胞,细胞生长曲线符合细胞的生长特性。以上数据表明本试验所培养的猪小肠上皮细胞是良好的试验素材,为细胞的营养吸收和免疫调控奠定了基础。
3.4 猪小肠上皮细胞角蛋白18的鉴定
细胞骨架蛋白是上皮细胞重要的标志蛋白,其中以角蛋白7、8、18为主。本试验利用角蛋白18来对猪小肠上皮细胞的进行鉴定。细胞角蛋白18主要分布在上皮细胞的细胞膜表面,是细胞的主要骨架蛋白。细胞角蛋白18的主要功能是维持上皮细胞的稳定性及连续性。从细胞的形态上也能够一定程度地辨别成纤维细胞和上皮细胞。利用组织块培养细胞,早期培养从组织块周围辐射出来的细胞是成纤维细胞,接着上皮细胞从组织块周围分裂出来。成纤维细胞和上皮细胞的形态差异较大,成纤维细胞的形态呈现梭形,上皮细胞的形态呈现“铺路石”状。组织块培养原代细胞呈现出成纤维细胞和上皮细胞夹杂着生长,而且成纤维细胞增殖速率要远远大于上皮细胞,这样就会导致成纤维细胞形成细胞簇,细胞间相互挤压,从而改变成纤维细胞的形态,形态似乎也是“铺路石”状。这样从显微镜下很难辨别这2种细胞的形态。国内外鉴定是否为上皮细胞,一般是通过免疫荧光检测上皮细胞的细胞膜表面表达细胞角蛋白18抗原[20-21]。本试验采用免疫荧光来鉴定上皮细胞角蛋白18表面抗原。在鉴定过程中,一抗和二抗稀释的比例、孵育时间要确定好,否则会导致背景过高。从图9可知,在荧光显微镜视野下的所有细胞经过细胞角蛋白18抗体的免疫反应,显示出绿色荧光。以上结果证明,本试验分离纯化获得的是纯的猪小肠上皮细胞。
3.5 猪小肠上皮细胞核型分析
细胞核型分析对于细胞的生物学功能具有重要的指示作用。Balducci等[22]在研究人脂肪细胞过程中发现,随着细胞传代次数增加,人脂肪细胞的染色体开始异常。Zhang等[23]在研究鼻咽上皮细胞中发现,NP69⁃LMP1亚细胞系传至第54代,染色体结构重排,显示出细胞传代次数越多,细胞正常的生物学功能丧失。基因的正常表达是基于细胞染色体功能稳定实现的。一旦细胞染色体缺失将会引起基因表达调控的紊乱,尤其是转录活性区染色体的缺失将抑制细胞本身具有的蛋白质分子信号转导通路,这可能下调抑癌基因的表达或高表达一些癌基因[24-27]。目前,国内外研究的细胞基本上是二倍体核型,但是随着细胞的传代次数越来越多,细胞的一些重要生物学功能将丧失,染色体核型变为多倍体或单倍体。如果一旦出现这样问题,下游的细胞吸收营养物质试验就很难模拟体内猪小肠上皮细胞吸收模式。本试验研究表明,传至第10代的猪小肠上皮细胞仍然保持着二倍体的核型,具有稳定的生物学功能,可为仔猪的肠道营养吸收和肠道疾病免疫治疗提供重要的细胞素材。
4 结 论
本试验利用组织块细胞培养法成功培养了猪小肠上皮细胞系且细胞活力较强并能够稳定传11代。传至第12代的猪小肠上皮细胞开始衰老,传至第15代的猪小肠上皮细胞停止生长并从瓶底脱落。原代猪小肠上皮细胞成功培养并进行功能性验证,可为猪小肠上皮细胞的营养吸收、肠道免疫调控机制的研究和建立永生化猪小肠上皮细胞系提供理想试验模型。
参考文献:
[1] 韩杰,张飞,边连全.刺五加多糖对免疫应激断奶仔猪免疫器官指数、粪便微生物菌群数量和胃肠道pH的影响[J].动物营养学报,2014,26(8):2314-2319.
[2] 寇涛,吕佳琪,李伟,等.母猪饲粮中添加精氨酸对仔猪肠道免疫细胞数量的影响[J].动物营养学报,2014,26(8):2077-2084.
[3] KOH S Y,GEORGE S,BROZEL V,et al.Porcine in⁃testinal epithelial cell lines as a new in vitro model for studying adherence and pathogenesis of enterotoxigen⁃ic Escherichia coli[J].Veterinary Microbiology,2008,130(1/2):191-197.
[4] KAEFFER B,BOTTREAU E,VELGE P,et al.Epithe⁃lioid and fibroblastic cell lines derived from the ileum of an adult histocompatible miniature boar(d/d hap⁃lotype)and immortalized by SV40 plasmid[J].Euro⁃pean Journal of Cell Biology,1993,62(1):152-162.
[5] LU S,YAO Y,MENG S M,et al.Over expression of apolipoprotein A⁃Ⅳenhances lipid transport in new⁃born swine intestinal epithelial cells[J].The Journal of Biological Chemistry,2002,277:31929-31937.
[6] SCHIERACK P,NORDHOFF M,POLLMANN M,et al.Characterization of a porcine intestinal epithelial cell line for in vitro studies of microbial pathogenesis in swine[J].Histochemistry and Cell Biology,2006,125 (3):293-305.
[7] PETTO C,LESKO S,GABEL G,et al.Establishment and characterization of porcine colonic epithelial cells grown in primary culture[J].Cell Tissues Organs,2011,194(6):457-468.
[8] QUARONI A,MAY R J.Establishment and character⁃ization of intestinal epithelial cell cultures[J].Methods in Cell Biology,1980,21:403-427.
[9] CONTEAS C N,MAJUMDARA P.The effects of gas⁃trin,epidermal growth factor and somatostatin on DNA synthesis in a small intestinal crypt cell line (IEC⁃6)[J].Proceedings of the Society for Experi⁃mental Biology and Medicine,1987,184(3):307-311.
[10] CARROL K M,WONG T T,DRABIK D L,et al.Dif⁃ferentiation of rat small intestinal epithelial cells by ex⁃tracellular matrix[J].The American Journal of Physi⁃ology,1988,254(3Pt1):G355-G360.
[11] SUN N C,CHU E H Y,CHANG C C.Staining meth⁃od for the banding patterns of human mitotic chromo⁃somes[J].Caryologia:International Journal of Cytolo⁃gy,Cytosystematics and Cytogenetics,1974,27(3):315-324.
[12] 周传丽,刘铮铸,俞英,等.仔猪小肠黏膜上皮细胞体外分离培养及鉴定[J].中国农业科学,2011,44 (21):4516-4524
[13] 李慧,格日乐其木格,王健宇,等.肠绒毛消化法所得仔猪小肠上皮细胞的培养与鉴定[J].中国细胞生物学学报,2011,33(10):1094-1101.
[14] BOUHET S,HOURCADE E,LOISEAU N,et al.The mycotoxin fumonisin B1alters the proliferation and the barrier function of porcine intestinal epithelial cells [J].Toxicological Sciences:an Official Journal of the Society of Toxicology,2004,77(1):165-171.
[15] KEDINGER M,SIMON⁃ASSMANN P,ALEXAN⁃DRE E,et al.Importance of a fibroblastic support for in vitro differentiation of intestinal endodermal cells and for their response to glucocorticoids[J].Cell Death and Differentiation,1987,20(2/3):171-182.
[16] ROSE M T,ASO H,YONEKURA S,et al.In vitro differentiation of a cloned bovine mammary epithelial cell[J].Journal of Dairy Research,2002,69(3):345-355.
[17] SHAY J W,WRIGHT W E,BRASISKYTE D,et al.E6 of human papillomavirus type 16 can overcome the M1 stage of immortalization in human mammary epi⁃thelial cells but not in human fibroblast[J].Onco⁃gene,1993,8(6):1407-1413.
[18] BAND V,ZAJCHOWSKI D,KULESA V,et al.Hu⁃man papillomavirus DNAs immortalize normal human mammary epithelial cells and reduce their growth fac⁃tor requirements[J].Proceedings of the National A⁃cademy of Sciences of the United States of America,1990,87(1):463-467.
[19] LIU Y,CHEN J J,GAO Q,et al.Multiple functions of human papillomavirus type 16 E6 contribute to the im⁃mortalization of mammary epithelial cells[J].Journal of Virology,1999,73(9):7297-7307.
[20] 王静,张彦明,仝钢,等.新生仔猪小肠上皮细胞的分离培养和鉴定[J].畜牧兽医学报,2010,41(1):92-98.
[21] WHEELER T T,CALLAGHAN M R,DAVIS S R,et al.Milkprotein synthesis,gene expression,and hormo⁃nal responsiveness in primary cultures of mammary cells from lactating sheep[J].Experimental Cell Re⁃search,1995,217(2):346-354.
[22] BALDUCCI L,BLASI A,SALDARELLI M,et al.Im⁃mortalization of human adipose⁃derived stromal cells:production of cell lines with high growth rate,mesen⁃chymal marker expression and capability to secrete high levels of angiogenic factors[J].Stem Cell Re⁃search&Therapy,2014,5(3):63-78.
[23] ZHANG H,TSAO S W,JIN C,et al.Sequential cyto⁃genetic and molecular cytogenetic characterization of an SV40T⁃immortalized nasopharyngeal cell line transformed by Epstein Barr virus latent membrane protein⁃1 gene[J].Cancer Genetics and Cytogenetics,2003,150(2):144-152.
[24] LU Y J,GUO S P,TONG T,et al.Establishment and characterization of a SV40T⁃transformed human bron⁃chial epithelial cell line[J].Lung Cancer,1998,19 (1):15-24.
[25] HUANG D P,LO K W,CHOI P H K,et al.Loss of heterozygosity on the short arm of chromosome 3 in nasopharyngeal carcinoma[J].Cancer Genetics and Cytogenetics,1991,54(1):91-99.
[26] DENG L W,JING N,TAN G L,et al.A common re⁃gion of allelic loss on chromosome region 3p25.3⁃26.3 in nasopharyngeal carcinoma[J].Genes,Chromo⁃somes and Cancer,1998,23(1):21-25.
[27] CHAN A S,TO K F,LO K W,et al.High frequency of chromosome 3p deletion in histologically normal nasopharyngeal epithelia from southern Chinese[J].Cancer Research,2000,60(19):5365-5370.
(责任编辑 菅景颖)
Isolation Culture and Identification of Porcine Intestinal Epithelial Cells
ZHAN Kang ZUO Xiaoxin CHEN Yingying GONG Xiaoxiao ZHAN Jinshun ZHAO Guoqi∗
(College of Animal Science and Technology,Yangzhou University,Yangzhou 225009,China)
Abstract:This experiment was designed to establish a functional immortalized porcine intestinal epithelial cells line and study porcine intestinal nutrient absorption,immune regulation and the pathogenesis of the neonatal porcine intestinal disease,which provided the cell model.Tissue culture method was used in this experiment to separate and purify the porcine epithelial cells.And the methods of cytokeratine 18 immunofluorescence,cell proliferation curve and karyotype analysis were used to identify the porcine intestinal epithelial cells.The results showed that the porcine intestinal epithelial cells could be successfully cultured and passed 11 generations stably by tissue culture method.2)The porcine intestinal epithelial cells showed positive reaction against cytokeratine 18 antigen,and the karyotype was diploid.3)The 11th generation cells still have characteristics of epithelial cells,showing“cobblestone⁃shape”and epithelial⁃like morphological features.However,the porcine intestinal epithelial cells were out of shape and went to the procedure of apoptosis after 11 generations.Most of them went to death in 15th generation and seldom were adherent to the dishes anymore.In summary,the experiment succeed to obtain a porcine intestinal epithelial cells line with stable biological functions by tissue culture meth⁃od,and they pass 11 generations stably,which provided the experimental materials for immortalized cells.[Chinese Journal of Animal Nutrition,2015,27(5):1477⁃1484]
Key words:porcine intestinal epithelial cell;function;intestinal nutrition and immunity;immortalize
Corresponding author∗,professor,E⁃mail:jszhaoguoqi@hotmail.com
通信作者:∗赵国琦,教授,博士生导师,E⁃mail:jszhaoguoqi@hotmail.com
作者简介:詹 康(1988—),男,江苏南京人,硕士研究生,从事动物分子营养研究。E⁃mail:zhankang0305@163.com
基金项目:江苏省高校优势学科建设工程资助项目;江苏省科技支撑项目(BE2013387)
收稿日期:2014-12-15
doi:10.3969/j.issn.1006⁃267x.2015.05.018
中图分类号:Q813.1
文献标识码:A
文章编号:1006⁃267X(2015)05⁃1477⁃08
