一步法制备金红石型TiO2介孔微球负极材料
2015-05-04曹丽云惠亚妮黄剑锋欧阳海波李嘉胤
曹丽云, 惠亚妮, 黄剑锋, 欧阳海波, 李嘉胤
(陕西科技大学 材料科学与工程学院, 陕西 西安 710021)
一步法制备金红石型TiO2介孔微球负极材料
曹丽云, 惠亚妮, 黄剑锋, 欧阳海波, 李嘉胤
(陕西科技大学 材料科学与工程学院, 陕西 西安 710021)
以四氯化钛、乙二醇和乙酸为起始原料,采用低温溶剂法成功制备了金红石型TiO2介孔微球.利用X-射线衍射仪(XRD)、扫描电子显微镜(SEM)和N2吸附-脱附测试对材料进行了表征,并研究了它的电化学性能.结果表明:相比于市售纳米级金红石型二氧化钛,介孔微球具有更好的倍率性能和循环稳定性(5 C倍率下循环100次容量保持率为98 %).
介孔; TiO2; 电化学性能
0 引言
锂离子电池由于具有工作电压高、能量密度高、无记忆效应、循环寿命长、环境友好等一系列突出优点,现已广泛应用于便携式电子产品,以及用于动力电车和混合动力汽车的动力电池[1-4].然而,目前商业化所使用的锂离子电池负极材料为碳材料,该材料存在着一定的体积效应和安全隐患,使得锂离子电池的应用受到了限制[5-7].为了获得结构与性能更好的电极材料,研究者们开始将视线转移到了其他材料,如锡基、硅基材料和其他氧化物材料,它们均具有很高的放电比容量,但是却也存在着循环稳定性差的缺点[8-10].作为锂离子电池负极材料的替代者,二氧化钛由于在锂离子嵌入/脱出过程中,体积膨胀小(3%),嵌入/脱出深度小、行程短,放电平台电位高(约为 1.7 V)[11-13],因而得到了人们的广泛关注.在二氧化钛的三种晶型锐钛矿、金红石、板钛矿中,性能最为突出研究最多的为锐钛矿型.而金红石型二氧化钛由于其较差的导锂、导电能力以及较窄的空间通道[6],一度被认为不适合做电极材料.金红石型二氧化钛的电化学性能受形貌的影响很大.近年来有文献报道,对金红石型二氧化钛进行纳米化,一方面可以提高脱嵌容量,另一方面可以增加材料的比表面积并对表面进行修饰,也可以改善其嵌锂能力,从而提高了其充放电比容量[6, 14, 15].
目前,金红石型二氧化钛的制备大部分都需要经高温固相反应(400 ℃~1 000 ℃),经历由无定形→锐钛矿→金红石的转化过程[16-18].一方面,高温固相法会使得产物的形貌不易控制,导致其电化学性能变差;另一方面,高温固相法对设备提出了较高的要求,也造成了较大的能源浪费.本文以TiCl4为原料,通过低温溶剂热法一步合成出了TiO2介孔微球.该TiO2是由直径约20 nm短棒交织而成的直径约为1.2μm的微球.与市售的二氧化钛纳米颗粒相比,它表现出了良好的倍率性能和循环稳定性.
1 实验部分
1.1 TiO2微晶的制备
分别量取乙二醇20 mL、乙酸20 mL、四氯化钛3 mL,在磁力搅拌器上充分搅拌均匀,得到反应前驱液,倒入容积为100 mL的水热釜的聚四氟乙烯内衬中,密封水热釜,将其放入100 ℃均相反应器中,反应18 h.反应结束后自然冷却到室温,取出水热釜.将所制备的白色沉淀通过离心分离,然后采用去离子水和无水乙醇洗涤数次,随后在电热真空干燥箱中60 ℃干燥1 h得到产物二氧化钛(TiO2-2).本实验是以市售阿拉丁金红石型二氧化钛(TiO2-1)做为对比.
1.2 测试与表征
产物的物相采用日本理学产D/max2200PC型X射线衍射仪(X-ray diffraction,XRD)进行分析,测试条件为:铜靶Kα射线,X射线波长λ=0.154 18 nm, 2θ =15 °~70 °.产物的显微结构采用日本JEOL公司产JSM-6390A型扫描电子显微镜(scanning electron microscope,SEM)进行观察.产物的N2吸附-脱附性能采用美国康塔公司产NOVA2200e型表面空隙度分析仪进行测试.
二氧化钛电极材料的制备过程为:将0.025 g粘结剂(PVDF),溶于1.2 mLN-甲基吡咯烷酮中,磁力搅拌1 h;加入0.025 g乙炔黑,磁力搅拌1 h;之后,加入0.2 g二氧化钛,磁力搅拌48 h,得到混合溶液.将此混合溶液在涂片机上匀速涂片,集流体为铜箔.在80 ℃干燥24 h后,进行冲电极片.将所得电极片称重后,在上海布劳恩公司生产的LABSTAR型手套箱中组装电池.
电池的充放电性能在深圳新威公司产BTS-5V10MA型伴电池恒流充放电测试仪进行测试.电池的交流阻抗性能在上海辰华产的CHI660E型电化学工作站进行测试.
2 结果与讨论
图1为产物和市售二氧化钛的XRD图谱.从图中可以看出,TiO2-1和TiO2-2的每个衍射峰均与Rutile TiO2(JCPDS No.21-1276)的标准峰对应得很好,且没有杂质衍射峰的出现,表明了TiO2-1和TiO2-2均为纯相的金红石型二氧化钛.相比于TiO2-1的衍射峰,TiO2-2的衍射峰的强度较低,并且衍射峰也比较宽,这一结果可能是两个方面导致的.第一,本实验直接使用水热法制备TiO2-2,并没有对其进行热处理,部分二氧化钛没有达到结晶状态,从而使得TiO2-2的衍射峰较宽且强度较低.第二,较宽的衍射峰可能是由于TiO2-2的颗粒较小导致的.另外,TiO2-2的各个衍射峰强度,与标准卡片上的衍射峰的强度基本相互对应,表明了其基本没有出现某一个晶面上的取向生长.
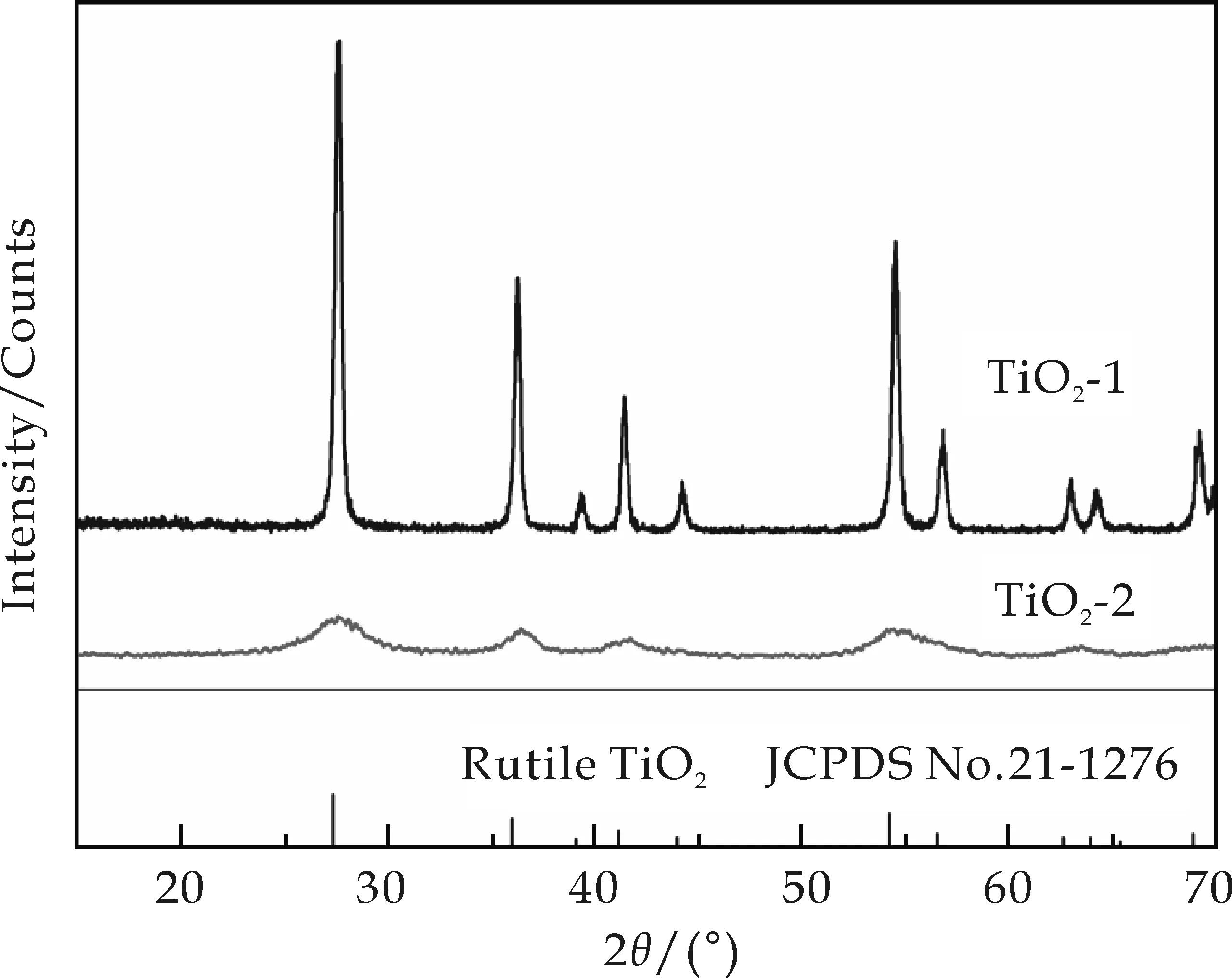
图1 100 ℃溶剂热反应18 h所得产物和市售二氧化钛的XRD图谱
图2为TiO2-1和TiO2-2的SEM图.由图可知,市售的金红石型二氧化钛TiO2-1的形貌为纳米级小颗粒,颗粒尺寸大约为60 nm.本实验所制备的金红石型二氧化钛为多晶的微米球,其形貌尺寸较为均一,直径约为1.2μm.同时,微米球的表面比较疏松,表面存在着明显的孔状结构.从放大图可以看出,此微米球是由直径约20 nm纳米短棒交织而成的连续的网.结合TiO2-2物相分析可知,其较宽的衍射峰部分可能是TiO2-2表面的纳米级结构导致的.
本实验制备二氧化钛的晶体生长机制为“溶解-结晶”机制,即在常温常压下,原料TiCl4在乙二醇和乙酸的混合溶液中缓慢水解(TiCl4的水解能力非常强,遇到空气中的水分即可发烟,此过程所对应的反应方程式为TiCl4+2H2O=TiO2+4HCl),生成二氧化钛晶核,其中乙二醇在其中起到了抑制水解的作用,乙酸在溶液中提供了一定的酸性环境,进一步调节了TiCl4的水解速率,使得其匀速、缓慢的水解.在此混合溶液转移进密封水热釜,放入均相反应器后,溶液得了匀速的升温.在保温阶段的高温高压环境下,水解生成的二氧化钛微粒溶解在了混合溶液中,通过再次的水解和缩聚反应生成了离子聚集体[Ti(OH)n(H2O)6-n]Cl4-n(对应的反应过程为TiCl4+nH2O→H2[Ti(OH)nCl6-n]+(n-2)HCl;H2[Ti(OH)nCl6-n]+(6-n)H2O→[Ti(OH)n(H2O)6-n]Cl4-n+2HCl)[19].随着反应的进行,当离子聚集体相对于溶解度更小的结晶相对过饱和,此时开始析出晶核.随着结晶过程的进行,水热过程中离子聚集体的浓度又变得低于前驱物的溶解度,前驱物的溶解继续进行.如此反复进行,前驱物将完全溶解,最终得到TiO2晶粒.

(a)TiO2-1 (b)TiO2-2×20.0 k (c)TiO2-2×50.0 k
图3为TiO2-1和TiO2-2的N2吸附-脱附等温线和孔径分布曲线.通常所说的比表面积是指1 g固体物质所具有的总的表面积,它包括两部分,一部分是由晶体内部存在的孔道结构所造成的内表面积,另一部分则是晶体外表面的表面积.N2吸附法测定样品比表面积的方法主要有:Langmuir单分子层吸附和BET多层吸附.本实验采用BET多层吸附对二氧化钛的比表面积进行了测试.从曲线的特点来看,TiO2-1和TiO2-2的吸附曲线与脱附曲线完全闭合,是一种典型的H1型磁滞回线,因此属于第四类的吸附等温线[20].根据吸附等温方程,可以计算出TiO2-1和TiO2-2样品的比表面积分别为88.035 m2/g和310.275 m2/g.插图为样品的孔径分布,曲线表明TiO2-1在5~7 nm具有较窄的孔径分布,TiO2-2颗粒表面的微孔直径较为均匀,大约为3 nm,很好的符合了介孔材料的孔径分布.综合比表面积测试结果和孔径分布情况可知,TiO2-2的比表面积比TiO2-1的大很多,同时也符合介孔材料的特点,这对于电极材料非常有利.较大的比表面积和孔状结构一方面有利于增加电极材料和电解液的接触面积;另一方面也增加了锂离子在样品中的扩散通道和表面吸附量[21].
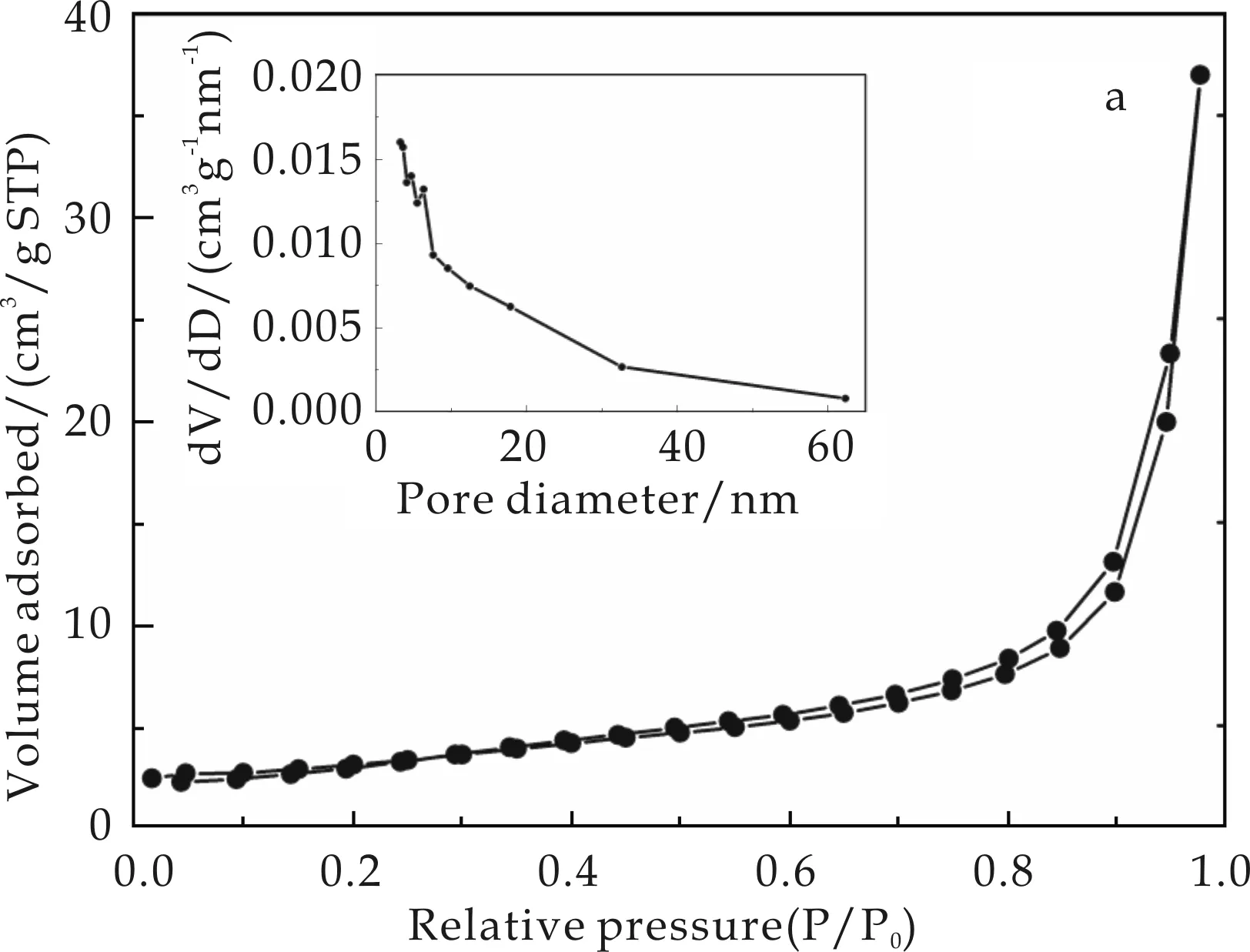
(a)TiO2-1

(b)TiO2-2
图4为TiO2-1和TiO2-2的电学性能测试图.由图4(a)可得,TiO2-1在1 C倍率下的首次充放电的比容量分别为90 mAh g-1和121 mAh g-1,库伦效率为74%.TiO2-2的首次充放电的比容量分别为129 mAh g-1和149 mAh g-1,库伦效率为87%.
从图4(b)的倍率性能测试图可以看出,TiO2-2在1 C倍率下的放电比容量稳定在138 mAh g-1,当倍率增加到2 C、5 C、10 C时,其放电比容量分别为120 mAh g-1、100 mAh g-1、68 mAh g-1.当回到1 C倍率下时,TiO2-2的放电比容量可以恢复到137 mAh g-1,表明了其具有良好的倍率性能.而TiO2-1在1 C、2 C、5 C、10 C的放电比容量分别为122 mAh g-1、96 mAh g-1、70 mAh g-1、36 mAh g-1.当回到1 C倍率下时,TiO2-1的放电比容量为116 mAh g-1.
从图4(c)的循环稳定性图可以看出,TiO2-2和TiO2-1在5 C倍率下的首次放电比容量分别为102 mAh g-1和78 mAh g-1,分别循环100次后,TiO2-1的放电比容量下降为66 mAh g-1,而TiO2-2的放电比容量仍然保持在100 mAh g-1,对应的容量保持率分别为98 %和85 %.
从图4(d)的样品的交流阻抗测试图可以看出,TiO2-1和TiO2-2均在高频区和中低频区分别出现了一个半圆、一条斜线.高频区所出现的半圆对应于电极材料在电化学反应过程中电极/电解液界面的电荷转移阻抗,半圆的半径越大,电荷转移越困难.中低频区出现的斜线对应于Li+在固体材料内部的扩散阻抗,即Warhurg阻抗,理想锂离子电池的电极材料的交流阻抗谱中的斜线的斜率为45 °.相比于TiO2-1,TiO2-2的交流阻抗谱的半圆直径较小,且斜线更接近45 °,表明着TiO2-2具有较小的电荷转移阻抗.
综合以上的结果表明,TiO2-2具较优的电化学性能,原因可能是:一方面,TiO2-2的形貌为纳米棒组成的微米球,具有巨大的比表面积和明显的孔道结构,使得电极和电解液的接触面积增大,同时也增加了锂离子和电子的扩散通道以及活性位点,从而使得其具有良好的电化学性能.此外,TiO2-1的颗粒尺寸大约为60 nm,而TiO2-2的表面纳米棒直径约为20 nm,因此TiO2-2拥有较短的锂离子和电子的扩散路径.根据电池材料中锂离子和电子的扩散能力与扩散系数成正比和扩散路径的平方成反比,则TiO2-2中的锂离子和电子的扩散能力远远大于TiO2-1,从而导致了TiO2-2具有较好的电化学性能.
另一方面,TiO2-2较小的电荷转移阻抗有利于克服充放电过程中的动力学限制,能够使TiO2活性颗粒中的嵌锂深度得到提高,并降低活性颗粒表面与内部存在的Li+浓度差,从而降低电池极化,提高放电容量,改善循环性能.
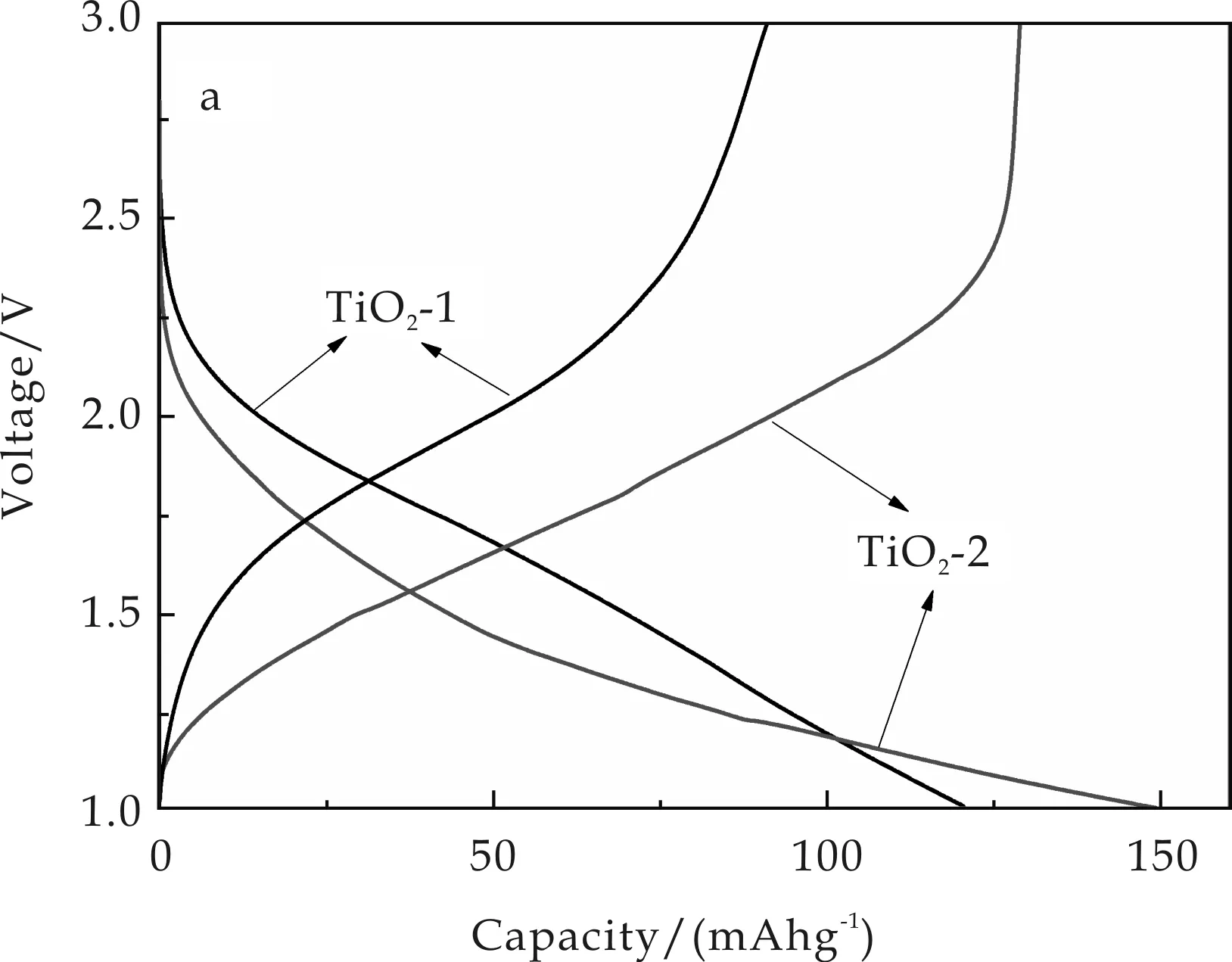
(a)在1 C倍率下的首次充放电图
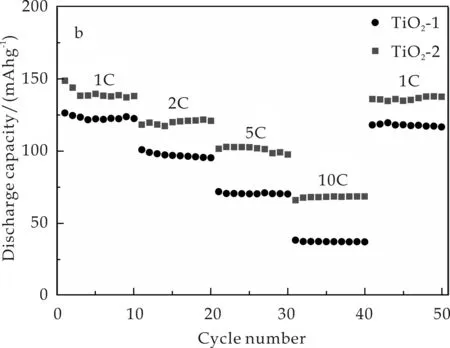
(b)倍率性能图

(c)在5 C倍率下的循环稳定性图

(d)交流阻抗测试图
3 结论
本文以TiCl4为原料,通过溶剂热法成功得制备出了TiO2介孔微球.该TiO2是由直径约20 nm短棒交织而成的直径约为1.2μm的微球.通过电学性能测试,它表现出了良好的储锂容量(1 C时首次放电比容量为149 mAh g-1)和较好的循环稳定性(5 C下循环100次容量保持率为98 %).
[1] Rahul Mukherjee,Rahul Krishnan,Toh Ming Lu,et al.Nanostructured electrodes for high-power lithium ion batteries[J].Nano Energy,2012,1(4):518-533.
[2] Norio Takami,Yasuhiro Harada,Takuya Iwasaki,et al.Micro-size spherical TiO2(B) secondary particles as anode materials for high-power and long-life lithium-ion batteries[J].Journal of Power Sources,2015,273(1): 923-930.
[3] Jie Wang,Laifa Shen,Hongsen Li,et al.A facile one-pot synthesis of TiO2/nitrogen-doped reduced graphene oxide nanocomposite as anode materials for high-rate lithium-ion batteries[J].Electrochimica Acta,2014,133(1):209-216.
[4] V.S.Reddy Channu,D.Ravichandran, B. Rambabu,et al.Carbon and functionalized graphene oxide coated vanadium oxide electrodes for lithium ion batteries[J].Applied Surface Science,2014,305(30):596-602.
[5] Qinghua Zian,Zhengxi Zhang,Li Yang,et al.Encapsulation of SnO2nanoparticles into hollow TiO2nanowires as high performance anode materials for lithium ion batteries[J].Journal of Power Sources,2014,253(1):9-16.
[6] Xi Ping Li,Jian Mao.Sol hydrothermal synthesis of Li4Ti5O12/rutile-TiO2composite as high rate anode material for lithium ion batteries[J].Ceramics International,2014,40(8):13 553-13 558.
[7] Peng Zhang,Jingxia Qiu,Zhanfeng Zheng,et al.Free-standing and bendable carbon nanotubes/TiO2nanofibres composite electrodes for flexible lithium ion batteries[J].Electrochimica Acta,2013,104(1) 41-47.
[8] Qingliu Wu,Toan Tran,Wenquan Lu,et al.Electrospun silicon/carbon/titanium oxide composite nanofibers for lithium ion batteries[J].Journal of Power Sources,2014,258(15):39-45.
[9] Jeng Yu Lin,Ming Hung Chou,Yi Chen Kuo.Rapid synthesis of tin oxide decorated carbon nanotube nanocomposities as anode materials for lithium-ion batteries[J].Journal of Alloys and Compounds,2014,589(15): 472-478.
[10] Yongho Lee,Tae Yong Kim,Dong Won Kim Joong Kee Lee Wonchang Choi.Coating of spinel LiNi0.5Mn1.5O4cathodes with SnO2by an electron cyclotron resonance metal-organic chemical vapor deposition method for high-voltage applications in lithium ion batteries[J].Journal of Electroanalytical Chemistry,2015,736(1):16-21.
[11] Feixiang Wu,Zhixing Wang,Xinhai Li,et al.Simple preparation of petal-like TiO2nanosheets as anode materials for lithium-ion batteries[J].Ceramics International,2014,40(10):1 685-1 690.
[12] Jingwei Zhang,Xiangxia Yan,Jiwei Zhang,et al.Preparation and electrochemical performance of TiO2/C composite nanotubes as anode materials of lithium-ion batteries[J].Journal of Power Sources,2012,198(15):223-228.
[13] Lei Tan,Chengying Cao,Huijun Yang,et al.Nitrogen-doped carbon coated anatase TiO2anode material for lithium-ion batteries[J].Materials Letters,2013,109(15):195-198.
[14] Shanmu Dong,Haibo Wang,Lin Gu,et al.Rutile TiO2nanorod arrays directly grown on Ti foil substrates towards lithium-ion micro-batteries[J].Thin Solid Films,2011,519(18):5 978-5 982.
[15] Tao Tao,Ying Chen.Direct synthesis of rutile TiO2nanorods with improved electrochemical lithium ion storage properties[J].Materials Letters,2013,98(1):112-115.
[16] Abbas M.Selman,Z.Hassan.Influence of deposition temperature on the growth of rutile TiO2nanostructures by CBD method on seed layer prepared by RF magnetron sputtering[J].Superlattices and Microstructures,2013,6(4):27-36.
[17] Krishnamurthy Prasad.D.V.Pinjari,A.B.Pandit,S.T.Mhaske.Phase transformation of nanostructured titanium dioxide from anatase-to-rutile via combined ultrasound assisted sol-gel technique[J].Ultrasonics Sonochemistry,2010,17(2):409-415.
[18] D. Dolat,D.Moszyński,N.Guskos,et al.Preparation of photoactive nitrogen-doped rutile[J].Applied Surface Science,2013,266(1):410-419.
[19] 陈瑞澄.四氯化钛水解过程的研究[J].湿法冶金,1999,18(3):1-7.
[20] Y.F.Tang,L.Yang,S.H.Fang,et al.Li4Ti5O12hollow microsphere assembled by nanosheets as an anode material for high-rate lithium ion batteries[J].Electrochim. Acta,2009,54(26):6 244-6 249.
[21] Z.W.Zhang,L.Y.Cao,J.F.Huang,et al.Temperature effects on spinel Li4Ti5O12as anode material for lithium ion batteries[J].Electrochim Acta,2013,88(15):443-446.
A one-step synthesis of rutile mesoporousmicrospheres TiO2for anode materials
CAO Li-yun, HUI Ya-ni, HUANG Jian-feng, OUYANG Hai-bo, LI Jia-yin
(School of Materials Science and Engineering, Shaanxi University of Science & Technology, Xi′an 710021, China)
Rutile TiO2mesoporous microspheres were successfully prepared by a low-temperature solvothermal synthesis using titanium tetrachloride,ethanediol and acetic acid as raw materials.The materials were characterized by X-Ray Diffraction (XRD),Scanning Electron Microscope (SEM) and nitrogen adsorption/desorption measurement.Additionally,the electrochemical properties of TiO2mesoporous microspheres were researched.Results indicate that,the TiO2mesoporous microspheres possess superior rate capabilities and cycle performance (98% capacity retention after 100 cycles at 5 C),compared to the commercial rutile nano-TiO2.
mesoporous; TiO2; electrochemical properties
2015-02-28
国家科技支撑计划项目(2013BAF09B02); 国家自然科学基金项目(51472152); 陕西省科技厅科研创新团队计划项目(2013KCT-06)
曹丽云(1972-),女,新疆石河子人,教授,博士,研究方向:功能薄膜及涂层材料、有机/无机复合材料
1000-5811(2015)03-0046-05
TB383
A
