鞘氨醇单胞菌TP-3原生质体制备与再生的研究
2015-04-24周明明李晓雁陈彦梅黄海东
周明明,李晓雁,陈 悦,陈彦梅,黄海东,*
(1.天津农学院农学与资源环境学院,天津300384;2.天津农学院食品科学与生物工程学院,天津300384)
鞘氨醇单胞菌TP-3原生质体制备与再生的研究
周明明1,李晓雁2,陈 悦2,陈彦梅1,黄海东1,*
(1.天津农学院农学与资源环境学院,天津300384;2.天津农学院食品科学与生物工程学院,天津300384)
研究了EDTA预处理、菌龄、溶菌酶浓度、酶解温度及酶解时间对鞘氨醇单胞菌TP-3原生质体制备与再生的影响。结果表明:10 mmol/L EDTA对菌体进行预处理,菌龄18 h,酶浓度60 μg/mL,酶解温度32℃,酶解时间30 min时,菌株原生质体的形成率可达96.1%,再生率达32.2%。本文为进行原生质体融合选育优良微生物菌种奠定了基础。
鞘氨醇单胞菌,原生质体,影响因素
食品胶是一类天然高分子聚合物的统称,这类物质充分水化后能形成黏稠、滑腻或凝胶状的高分子水溶胶,在食品加工中可以起到增稠、乳化、胶凝等作用[1-2]。食品胶按来源可分为植物胶、动物胶、微生物胶、海藻胶和化学改性胶,其中微生物胶性能优良、用途广泛、资源取之不竭,与其他来源的食品胶相比,生产周期短、不受气候、地理环境和自然灾害的影响,其产品研发和应用日益受到重视[3-6]。
鞘氨醇单胞菌是合成微生物胶的重要微生物资源,该菌属的菌株能合成包括结冷胶在内的一类生物聚合物,统称为鞘氨醇胶。菌株TP-3是从土壤中分离到的一株鞘氨醇单胞菌属的新种Sphingomonas sanxanigenens,其发酵合成的产物命名为鞘氨醇胶Ss,此胶具有优越的增稠性和剪切稀释性,在含钙离子的水溶液中低浓度即可形成凝胶[7-8]。将菌株TP-3的发酵液pH调至3.0左右,鞘氨醇胶Ss即可沉淀出来,与其他鞘氨醇胶所采用的有机溶剂沉淀法提取相比,酸沉提取能够显著地降低生产成本。本文对菌株TP-3的原生质体制备与再生条件进行了研究,为利用原生质体融合选育优良菌株,进一步提高该菌株的产物合成量和生产性能奠定基础。
1 材料与方法
1.1 材料与仪器
菌种S.sanxanigenens TP-3 由本实验室保藏;固体培养基(g/L) 蔗糖15.0,蛋白胨5.0,牛肉膏3.0,酵母膏3.0,琼脂粉15.0,pH7.0;液体培养基(g/L) 蔗糖15.0,蛋白胨2.5,磷酸氢二钾2.5,磷酸氢二铵1.5,硫酸镁0.1,酵母粉1.5,pH7.0;补充基本培养基(BNK)(g/L) 蔗糖181.0,蛋白胨5.0,牛肉膏3.0,琼脂粉20.0,pH7.0;再生补充培养基(BZNK)(g/L) BNK配方中琼脂改为8.0;磷酸缓冲液 0.1 mol/L磷酸氢二钠,0.1 mol/L磷酸二氢钠,pH7.0;高渗缓冲液0.1 mol/L磷酸氢二钠,0.1 mol/L磷酸二氢钠,0.8 mol/L甘露醇,pH7.0;原生质体稳定液(SMM) 0.5 mol/L蔗糖,20 mol/L MgCl2,0.02 mol/L顺丁烯二酸,pH6.5;溶菌酶 用SMM溶液配制,终浓度0.5 mg/mL,过滤除菌备用;磷酸氢二钾、磷酸氢二铵、硫酸镁、磷酸氢二钠、磷酸二氢钠、甘露醇、MgCl2、顺丁烯二酸等 均为分析纯;酚藏花红染色剂 购自Sigma公司。
KYC-100C摇床 上海福玛公司;TGL16A台式高速离心机 潮南凯达公司;WH-2微型旋涡混合仪 上海沪西公司;BA410荧光显微镜 厦门Motic公司;NDJ-1旋转粘度计 上海精密公司;STARTER 2100实验室pH计 奥豪斯仪器(上海)有限公司;DHG-9078A型电热恒温鼓风烘干箱 上海精宏实验设备有限公司;MCO-15A型恒温培养箱 上海市跃进医疗器械一厂;BCM-1000A生物洁净工作台 苏州安泰洁净有限公司;FA2004电子天平 上海精密天平;电子显微镜 日本Philips EM400-ST。
1.2 实验方法
1.2.1 菌种活化 取保藏的TP-3菌种划线接种到平板上,30℃恒温培养72 h,挑取单菌落在试管斜面上蛇形划线,30℃恒温培养72 h。
1.2.2 菌株发酵曲线测定 取5 mL无菌水将斜面试管中的菌体冲洗下来,按10%的接种量将其接种到液体培养基中,30℃、180 r/min摇床培养72 h。每隔6 h取一次样,并测定发酵液的pH、粘度、菌数和鞘氨醇胶Ss产量。
1.2.3 发酵参数的测定 使用校准后的pH计测定发酵液的酸碱度;在6 r/min的条件下,使用3号转子测定发酵液的粘度;发酵液无菌取样后,用无菌水进行梯度稀释,取0.1 mL稀释样涂布于固体平板培养基上,30℃恒温培养3 d后进行菌落计数,计算发酵的菌数指标;发酵过程中取样,加入1 mol/L的盐酸调节发酵液pH至3.0,沉淀的产物过滤后80℃恒温干燥至恒重,称重得发酵产物量。
1.2.4 原生质体的制备 菌株TP-3液体培养至对数生长前期,取适量菌液在8000 r/min条件下离心5 min,弃上清液,用磷酸缓冲液洗涤菌体细胞。将菌体悬浮于适量的SMM缓冲液中,使溶液中细胞浓度约为108~109CFU/mL。取0.1 mL菌悬液,用无菌水稀释到10-5、10-6、10-7,涂布平板培养基,30℃培养4 d后得菌落数A(菌落总数)。取剩余的菌悬液,在其中加入溶菌酶,混合均匀后于37℃保温30 min,4000 r/min离心10 min,弃上清液,用高渗缓冲液洗涤除酶,取菌液0.1 mL,用无菌水稀释到10-2、10-3、10-4,涂布平板培养基,进行剩余菌数B(未被酶裂解的剩余细胞)的测定。
1.2.5 原生质体的再生 取0.1 mL酶解后的原生质体悬液,用SMM缓冲液稀释到10-3、10-4、10-5,各取1 mL加入底层BNK培养基的中央,再倒入上层BZNK培养基,混匀,30℃培养4~5 d后计数,将菌落数计为C(再生菌落数)。原生质体形成率与再生率的计算公式如下:原生质体形成率(%)=(A-B)/A×100,原生质体再生率(%)=(C-B)/(A-B)×100。
1.2.6 原生质体制备与再生的影响因素
1.2.6.1 EDTA预处理对原生质体制备与再生的影响 酶解前,在菌龄18 h,酶浓度100 μg/mL,酶解温度37℃,酶解时间30 min的固定条件下,加入2~14 mmol/L浓度梯度的EDTA对菌悬液进行预处理,测定原生质体形成率和原生质体再生率。
1.2.6.2 青霉素浓度对原生质体制备与再生的影响用10 mmol/L EDTA对菌体进行预处理,菌龄为18 h,酶浓度100 μg/mL,温度37℃,酶解时间30 min的固定条件下,加入0~100 μg/mL的青霉素预处理2 h,测定原生质体形成率和原生质体再生率。
1.2.6.3 菌龄对原生质体制备与再生的影响 依据1.2.2发酵曲线中的结果,用10 mmol/L EDTA对菌体进行预处理,酶浓度100 μg/mL,温度37℃,酶解时间30 min的固定条件下,选择6~36 h的细菌培养物制备原生质体,测定原生质体形成率和原生质体再生率。
1.2.6.4 溶菌酶浓度对原生质体制备与再生的影响用10 mmol/L EDTA对菌体进行预处理,菌龄18 h,温度37℃,酶解时间30 min的固定条件下,取10~120 μg/mL的溶菌酶制备原生质体,测定原生质体形成率和原生质体再生率。
1.2.6.5 酶解温度对原生质体制备与再生的影响 用10 mmol/L EDTA对菌体进行预处理,菌龄18 h,酶浓度100 μg/mL,酶解时间30 min的固定条件下,选择17~47℃范围的酶解温度制备原生质体,测定原生质体形成率和原生质体再生率。
1.2.6.6 酶解时间对原生质体制备与再生的影响 用10 mmol/L EDTA对菌体进行预处理,菌龄18 h,酶浓度100 μg/mL,酶解温度37℃的固定条件下,酶解时间为10~70 min制备原生质体,测定原生质体形成率和原生质体再生率。
1.2.7 原生质体制备条件的验证 在上述原生质体各制备因素的基础上,得到原生质体制备与再生的最佳条件,进行各影响因素的综合实验,得出菌株原生质体的最高形成率和再生率。
1.2.8 菌体细胞与原生质体的观察 用接种环取菌悬液于干净的载玻片上,晾干,加结晶紫染液进行染色,用水冲洗并晾干,在显微镜下进行观察。细菌电子显微镜观察方法见参考文献[9],配制0.01%的酚藏花红染色剂[10],在原生质体溶液中按1∶1的比例加入染色剂,将混合溶液滴于载玻片上,加盖玻片,在荧光显微镜下进行观察。
1.3 数据处理
实验进行三次重复,应用软件Origin 6.1和Excel 2003对得出的数据进行分析处理。
2 结果与分析
2.1 菌株TP-3的发酵曲线
在实验菌株发酵培养的过程中,进行pH、发酵液粘度、菌数和鞘氨醇胶Ss产物量的测定,结果如图1所示。从细胞生长曲线可以看出,菌株TP-3在培养8 h后进入对数生长期,46 h进入稳定期,此时菌数达1.5×1010CFU/mL;产物鞘氨醇胶Ss的合成曲线与细胞生长曲线近乎平行,在60 h达到最高24.1 g/L,结晶紫染色后镜检发现,在发酵培养的全部阶段均能观察到纤毛状的产物包裹在细胞周围,说明鞘氨醇胶Ss是一种初级代谢产物;发酵培养在32 h之前,发酵液的pH基本稳定,随着产物合成量的增加,发酵液粘度逐渐增加,产物鞘氨醇胶Ss属于酸性多糖,因此32 h之后发酵液的pH略有降低。由于整个发酵周期中,胞外均存在高分子多糖,不利于原生质体的制备,提示应该选择发酵液粘度低、产物合成少的发酵阶段,进行原生质体制备的研究。

图1 菌株TP-3的发酵曲线Fig.1 Fermentation growth curve of strain TP-3
2.2 原生质体的制备与再生
2.2.1 EDTA预处理对原生质体制备与再生的影响鞘氨醇单胞菌TP-3为革兰氏阴性细菌,结构和成分较革兰氏阳性菌复杂,特别是细胞外壁中的脂多糖及多糖类,会影响溶菌酶的作用。Minghua D等发现,制备原生质体时,在添加溶菌酶之前用EDTA预处理,可以提高原生质体的形成率[11]。本实验用EDTA对菌悬液进行预处理,结果如图2所示。

图2 EDTA预处理对原生质体形成率与再生率的影响Fig.2 Effect of EDTA pretreatment on protoplast formation and regeneration of strain TP-3
随着EDTA浓度的增大,原生质体的形成率在10 mmol/L之前逐渐提高;原生质体的再生率则相反,呈下降趋势。以原生质体形成率与再生率的乘积最大,作为判断原生质体制备最佳条件的依据[12],以此标准,选择10 mmol/L的浓度作为EDTA预处理的最佳浓度。
2.2.2 青霉素浓度对原生质体制备与再生的影响在菌株TP-3液体培养的过程中加入一定量的青霉素,可以在一定程度上提高原生质体的形成率(图3)。与抑制革兰氏阳性菌的机理不同,青霉素可以与革兰氏阴性菌细胞膜上的青霉素结合蛋白PBPS发生结合,从而干扰细胞壁代谢,并造成细胞形变[13]。

图3 青霉素浓度对原生质体形成率与再生率的影响Fig.3 Effect of concentration of penicillin on protoplast formation and regeneration of strain TP-3
从实验结果可以看出,青霉素的加入明显降低了原生质体再生率;在浓度低于20 μg/mL时,使用青霉素有利于原生质体的形成,但浓度继续升高后,由于细胞存活率下降,实验过程中的剩余细胞数量迅速下降,原生质体形成率也相应降低。
2.2.3 菌龄对原生质体制备与再生的影响 菌龄对原生质体的制备与再生很重要,处于对数生长期的细胞生理状态相对一致,细胞分裂迅速,对酶的敏感性强,易于原生质体化和再生[14]。菌龄对原生质体制备与再生的影响,结果如图4所示。
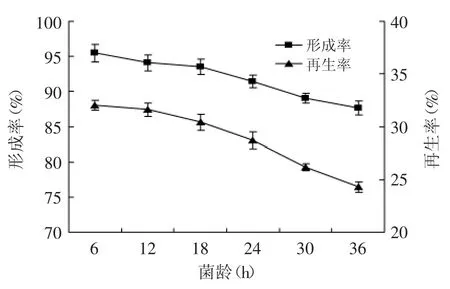
图4 菌龄对原生质体形成率与再生率的影响Fig.4 Effect of cell age on protoplast formation and regeneration of strain TP-3
原生质体的形成率和再生率都随着菌龄的增加而下降。说明随着发酵时间的延长,菌体细胞周围的多糖产物逐渐增多,影响溶菌酶的作用效果;但菌龄过短时细胞数量偏低,不利于后续的原生质体融合研究,因此选择菌龄为18 h作为原生质体制备与再生的最佳发酵时间。
2.2.4 溶菌酶浓度对原生质体制备与再生的影响经EDTA预处理后,实验菌株细胞壁表面的脂多糖层的Ca2+、Mg2被螯合去除,破坏了脂多糖的结构,使溶菌酶可以作用于细胞壁的肽聚糖[15]。用不同浓度的溶解酶进行原生质体的制备与再生实验,结果如图5所示。
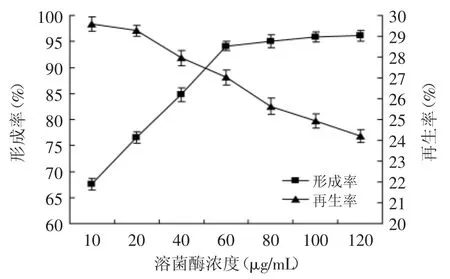
图5 酶浓度对原生质体形成率与再生率的影响Fig.5 Effect of concentration of lysozyme on protoplast formation and regeneration of strainTP-3
随着溶菌酶量的增加,原生质体形成率呈上升趋势,由于细胞壁破坏影响菌体活性,再生率呈下降趋势。溶菌酶浓度在10~60 μg/mL范围内,原生质体形成率迅速增长,继续提高溶菌酶浓度,原生质体形成率增加不明显,但原生质体再生率迅速下降。原因可能是随着酶浓度的增加,酶不仅酶解了细胞壁,还对早期形成的原生质体细胞膜造成了损伤,再生率下降[12]。依据原生质体形成率与再生率乘积最大原则[12],选择溶菌酶浓度为60 μg/mL作为原生质体制备与再生的最佳条件。
2.2.5 酶解温度对原生质体制备与再生的影响 原生质体制备时,低于酶解最适温度时,酶活性低,酶解时间长;温度高于酶解最适温度时,酶蛋白逐渐变性而使酶失活,不利于原生质体的形成[16]。本文对不同的酶解温度进行了实验,结果如图6所示。

图6 酶解温度对原生质体形成率与再生率的影响Fig.6 Effect of temperatures of lysozyme on protoplast formation and regeneration of strainTP-3
随着温度的升高,原生质体的形成率呈上升趋势,再生率则持续下降,酶解温度达到47℃时,再生率降为0。随着温度的升高溶菌酶活性增强,因此原生质体形成率增高,再生率的下降一方面是由于溶菌酶对细胞的损伤,另一方面,菌株TP-3的最适发酵温度为28~30℃,温度过高对菌体本身的内酶系统造成破坏,使原生质体无法再生[17]。选择32℃为最佳酶解温度。
2.2.6 酶解时间对原生质体制备与再生的影响 溶菌酶作用时间也是影响原生质体制备的重要因素,酶解时间不足,细胞不能完全去壁;酶解时间过长,会使早期释放的原生质体膜受到伤害,使原生质体破碎或再生能力减弱[18]。本文对不同的酶解时间进行了实验,结果如图7所示。
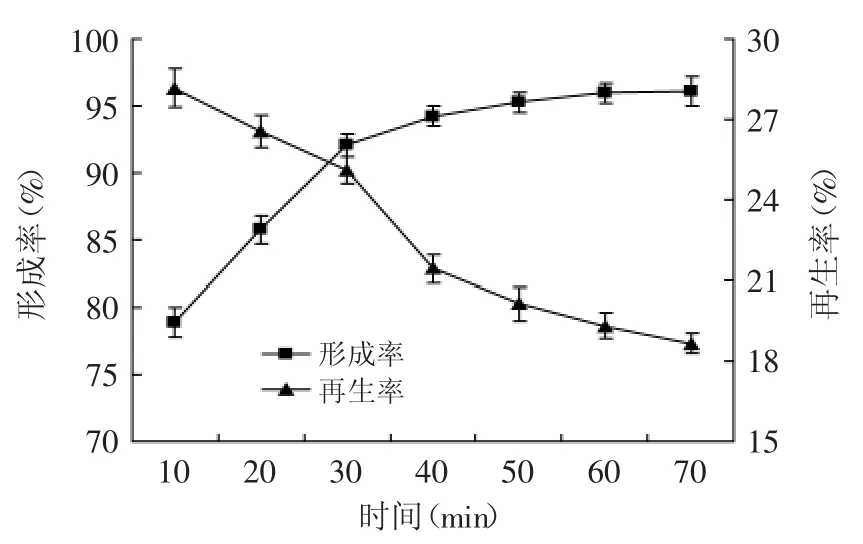
图7 酶解时间对原生质体形成率与再生率的影响Fig.7 Effect of operational times of lysozyme on protoplast formation and regeneration of strainTP-3
在酶作用10~30 min之间,原生质体的形成率随酶解时间延长而迅速提高,之后增速缓慢,再生率则呈下降趋势。酶解30 min后,原生质体再生率的迅速下降,说明过长的酶解时间影响了原生质体的活性,因此选择30 min作为原生质体形成与再生的最佳酶解时间。

图8 TP-3菌体细胞(7000×)Fig.8 Cell of strainTP-3(7000×)

图9 菌株TP-3的原生质体(1000×)Fig.9 Protoplast of strainTP-3(1000×)
2.3 原生质体制备条件的验证
根据上述实验结果,得到原生质体制备与再生的最佳条件为:10 mmol/L EDTA预处理,菌龄18 h,溶菌酶浓度60 μg/mL,酶解温度32℃,酶解时间30 min。在该条件下进行验证实验,结果表明原生质体形成率和再生率分别达到96.1%和32.2%。对原生质体制备前后的菌体形态进行观察,图8为菌体细胞的电子显微镜观察结果,可以看出菌株TP-3的细胞为杆状,大小为0.6~0.9 μm×1.5~2.0 μm,细胞周围可以观察到明显的纤毛状产物,鞘氨醇胶Ss。菌株TP-3的原生质体进行酚藏花红染色,在荧光显微镜下观察(图9),大多数菌体呈类球状,直径0.9~1.2 μm,原生质体周围仍然能观察到多糖产物。
3 结论与讨论
本文对菌株TP-3的原生质体制备条件进行了优化,发现EDTA预处理、菌龄、溶菌酶浓度、酶解温度和时间等因素对原生质体的形成率与再生率影响明显。由于菌株TP-3外包裹着产物Ss胶,影响了溶菌酶对菌株的作用,进而影响原生质体的制备。通过优化实验得出原生质体制备与再生的最佳条件:10 mmol/L EDTA预处理,菌龄18 h,酶浓度60 μg/mL,酶解温度32℃,酶解时间30 min,在此条件下菌株原生质体的形成率可达96.1%,再生率达32.2%。菌株TP-3是鞘氨醇单胞菌属的新种,该菌株的原生质体制备与再生条件的研究还未见报道。实验中发现加入20 μg/mL浓度以下的青霉素,可干扰细胞壁合成,原生质体形成率有所提高,但使用青霉素后细菌存活率降低,不利于后期原生质体融合育种,因此选择不加青霉素进行预处理。菌株TP-3原生质体周围仍可以观察到多糖产物的分泌,进一步说明鞘氨醇胶Ss合成后连接在细胞膜的脂载体上,并不分泌到细胞壁外。
Ss是鞘氨醇胶家族的一个新品种,增加产物量、提高产品粘度、降低胶凝临界浓度等诸多研究工作有待开展。对菌株进行传统诱变,获得目的性状提高的突变株后,通过多轮递推式原生质体融合,可以快速得到发酵性状更优良的菌株。原生质体的制备和再生是决定融合效率的关键因素,本文为菌株TP-3进行原生质体融合及基因组改组等育种工作奠定了基础。
[1]Vasiliki E,Maria M,Ioanna M,et al.Compression of gellan gels.PartⅡ:effect of sugars[J].Food Hydrocoll,2010,24(4):392-397.
[2]胡国华.功能性食品胶[M].北京:化学工业出版社,2003:1-22.
[3]Prajapati VD,Jani GK,Zala BS,et al.An insight into the emerging exopolysaccharide gellan gum as a novel polymer[J]. Carbohydr Polym,2013,93(2):670-678.
[4]Bradbeer JF,Hancocks R,Spyropoulos F,et al.Self-structuring foods based on acid-sensitive low and high acyl mixed gellan systems to impact on satiety[J].Food Hydrocoll,2014,35(100):522-530.
[5]张伟,沈年汉,陈秀芳,等.几种微生物多糖的特性及在食品工业中的应用[J].食品工业科技,2010,31(6):358-360.
[6]朱桂兰,童群义.微生物多糖的研究进展[J].食品工业科技,2012,33(6):444-448.
[7]Haidong H,Wei W,Ting M,et al.Sphingomonas sanxanigenens sp.nov.,isolated from soil[J].Int J Syst Evol Microbiol,2009,59(4):719-723.
[8]Huang HD,Wang W,Ma T,et al.Analysis of molecular composition and properties of a novel biopolymer[J].Chem J Chinese Univ,2011,30:324-327.
[9]胡冰.生物电子显微镜技术[M].南京:南京农业大学出版社,2004:99-101.
[10]龙建友,唐世荣,吴文君.原生质体融合技术对秦岭霉素产量提高的影响[J].中国农业科学,2007,40(7):1416-1421.
[11]Minghua D,Sara Z,Thomas R,et al.Visualization of protoplast fusion and quantitation of recombination in fused protoplasts of auxotrophic strains of Escherichia coli.[J].Metabolic Engineering,2005,7(1):45-52.
[12]岑沛霖.工业微生物学[M].北京:化学工业出版社,2001:335-344.
[13]张凤凯,金少鸿.β-内酰胺类抗生素的作用靶位-青霉素结合蛋白[J].国外医药:抗生素分册,2000,21(3):107-110.
[14]曾献春,孟冬丽.乳酸菌原生质体制备与再生研究[J].食品科学,2006,27(10):269-272.
[15]施巧琴,吴松刚.工业微生物育种学[M].北京:科学出版社,2003:302-303.
[16]韩光杰,孙俊,李传明,等.苏云金芽孢杆菌原生质体的制备及大质粒转化[J].江苏农业科学,2014,42(11):37-40.
[17]甘邱锋,张晓琳,王洁颖,等.刺糖多孢菌原生质体制备与再生条件优化[J].中国抗生素杂志,2011,36(1):18-24.
[18]宋爱环,李红叶,刘小红.指状青霉(Penicillium digitatum)原生质体制备和再生条件[J].农业生物技术学报,2004,12(2):197-201.
Conditions for protoplast preparation and regeneration by Sphingomonas sanxanigenens TP-3
ZHOU Ming-ming1,LI Xiao-yan2,CHEN Yue2,CHEN Yan-mei1,HUANG Hai-dong1,*
(1.College of Agronomy and Resources&Environment,Tianjin Agricultural University,Tianjin 300384,China;2.College of Food Science and Biotechnology,Tianjin Agricultural University,Tianjin 300384,China)
The effect of EDTA pretreatment,cell age and the concentration,temperature and work time of lysozyme on protoplast formation and regeneration by Sphingomonas sanxanigenens TP-3 were studied.The results showed that when cell age was 18 h,pretreated by 10 mmol/L EDTA,using 60 μg/mL of lysozyme,enzymolysis at 32℃for 30 min,the protoplast formation rate and regeneration rate respectively reached 96.1%and 32.2%. This work lay the foundation for protoplast fusion to breed good microbial strain.
Sphingomonas;protoplast;influence factors
TS201.1
A
1002-0306(2015)22-0184-05
10.13386/j.issn1002-0306.2015.22.030
2015-03-19
周明明(1990-),女,硕士研究生,主要从事微生物多糖方面的研究,E-mail:zmmydx@126.com。
*通讯作者:黄海东(1972-),男,博士,教授,主要从事资源细菌及工程方面的研究,E-mail:hhaidong@126.com。
国家自然科学基金项目(31571790);天津市大学生创新创业项目(201410061062)。
