左乙拉西坦杂质的合成*
2015-04-23陆骁骏黄建金
陆骁骏,邹 江,黄建金,杨 琰
(华润赛科药业有限责任公司,北京 100021)
乙拉西坦(Ⅰ)有R和S两种对映异构体,S-异构体即左乙拉西坦[(S)-Ⅰ]具有生物活性。(S)-Ⅰ作为抗癫痫药具有广谱、起效迅速的抗癫痫活性,药代动力学特性较理想、耐受性和安全性好[1],特别适用于成人和儿童的难治性部分性发作的辅助治疗(加用于其他抗癫痫药)。
(R)-Ⅰ对于抑制癫痫发作只有轻微或不明显的药效作用[2]。对于(R)-Ⅰ,(S)-N-(1-氨基-1-氧代丁基)-4-氯丁酰胺(USP定为左乙拉西坦杂质 A)和(S)-α-乙基-2-氧代-1-吡咯烷乙酸(USP定为左乙拉西坦酸,B)等无生物活性成分的研究,在Ⅰ的质量研究中具有重要意义。
目前,(R)-Ⅰ的制备主要通过高效液相色谱法手性拆分(S)-Ⅰ原料药中的右旋异构体[3-4],该方法不适合较大量定性研究。而A和B的合成至今未见文献报道。
基于此,本文开发了Ⅰ的质量研究中所需杂质的化学合成法。分别以D-氨基丁酸(D-1)和DL-氨基丁酸(DL-1)为起始原料,经4步反应合成了(R)-Ⅰ和A(纯度97.0%);(S)-Ⅰ经水解反应合成了B(纯度99.9%)(Scheme 1),其结构经1H NMR和MS确证。
1 实验部分
1.1 仪器与试剂
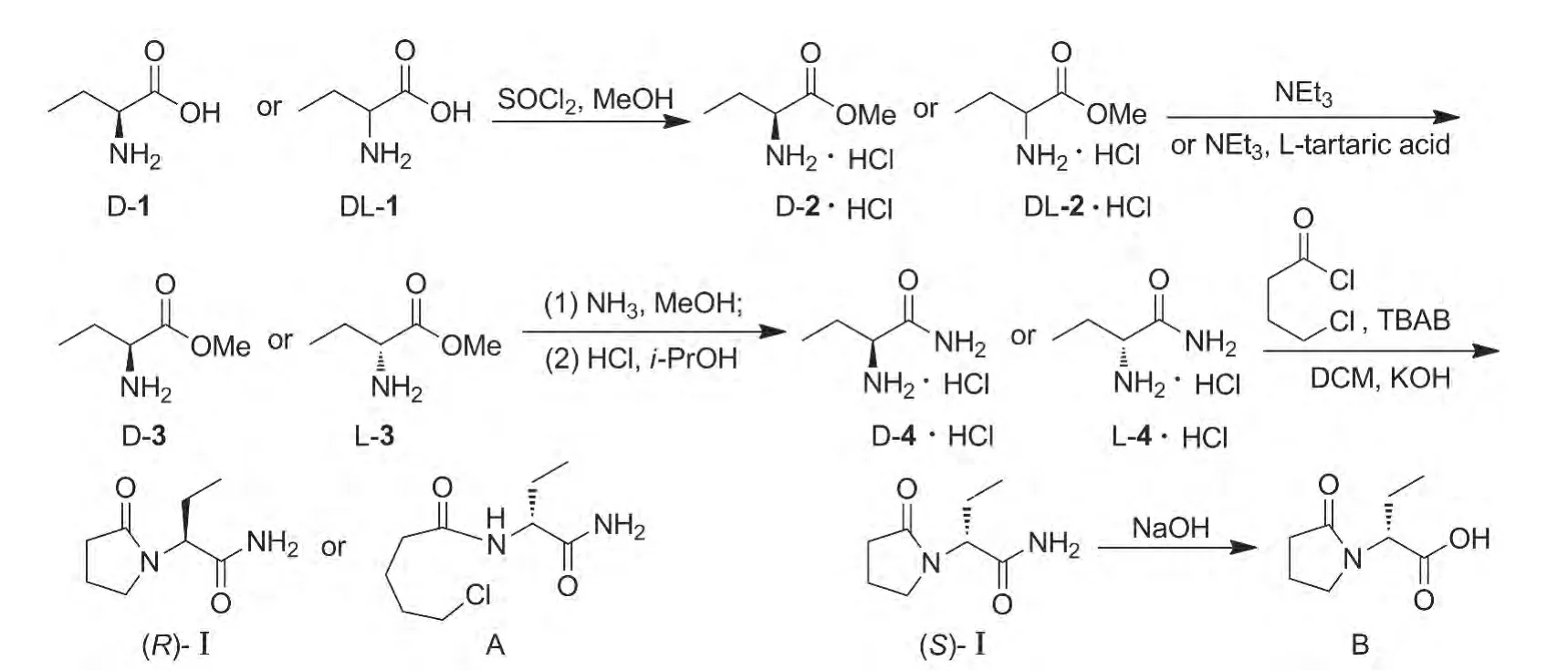
Scheme 1
AM-2600 MHz型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Agilent 6120型质谱仪;Shimadzu 2010型液相色谱仪。
D-1和DL-1,宜兴市康源化工有限公司;其余所用试剂均为化学纯或分析纯。
1.2 合成
(1)D-2·HCl和 DL-2·HCl的合成
在反应瓶中依次加入D-1 20 g(0.194 mol)和无水甲醇140 mL,搅拌使其呈混悬液;于-5℃滴加氯化亚砜16.9 mL,滴毕,于室温反应6 h。旋蒸脱溶,残余物用混合溶剂[A=V(乙酸乙酯)∶V(石油醚)=1∶1]200 mL溶解,析出白色固体,过滤,滤饼真空干燥得 R-2-氨基丁酸甲酯盐酸盐(D-2·HCl)29.6 g,收率 99.3%。
用类似方法合成DL-氨基丁酸甲酯盐酸盐(DL-2·HCl),收率99.0%。
(2)D-3的合成
在反应瓶中依次加入 D-2·HCl 10 g(65 mmol)和甲醇25 mL,搅拌使其溶解;加人三乙胺9.02 mL(65 mmol),于室温反应1 h。加乙酸乙酯100 mL,过滤除去三乙胺盐酸盐,滤液蒸干后加乙醚50 mL,过滤,滤饼干燥得白色固体D-3 7.18 g,收率 94.3%。
(3)L-3的合成
在反应瓶中依次加入DL-2·HCl 20 g(0.13 mol)和甲醇50 mL,搅拌使其溶解;加人三乙胺18 mL(0.13 mol),于室温反应1 h;加乙酸乙酯200 mL,过滤,滤液蒸干得白色固体14.3 g,用95%乙醇80 mL溶解,加入L-酒石酸9.15 g(61 mmol),于35℃反应2 h。冷却至室温,过滤,滤饼悬浮于100 mL无水甲醇中,冷却至0℃,加入氨水20 mL,反应20 h。过滤,滤液蒸干后,于45℃真空干燥12 h得白色固体L-3 6 g。
(4)D-4·HCl和L-4·HCl的合成
在反应瓶中依次加入D-3 7.18 g(61.3 mmol)和甲醇45 mL,搅拌使其溶解;常压通入氨气至饱和,于室温反应2 d。于0℃滴加浓盐酸至pH 7,过滤,滤液旋蒸脱溶,加入乙醇50 mL,泡洗1 h后干燥得白色固体D-4·HCl 6.75 g,收率79.4%。
用类似方法合成L-4·HCl,收率85.0%。
(5)(R)-Ⅰ和A的合成
在反应瓶中依次加入D-4·HCl 4.08 g(29.4 mmol)和CH2Cl250 mL,搅拌使其溶解;加人无水Na2SO46.80 g,粉末 KOH 6.70 g(120 mmol)和四丁基溴化铵(TBAB)490 mg,于0℃缓慢滴加4-氯丁酰氯6.8 g(48.2 mmol)的 CH2Cl2(5 mL)溶液,滴毕,于室温反应5 h。加入粉末KOH 1.68 g,反应2 h。过滤,滤液用少量CH2Cl2洗涤,旋蒸脱溶,残余物用乙酸乙酯溶解,搅拌1 h(析出大量沉淀);过滤,滤饼经鼓风干燥得白色固体(R)-Ⅰ4.00 g。
用类似方法合成白色固体A。
(R)-Ⅰ:收率 80%,纯度 99.8%[HPLC,色谱条件:CHIRALCEL OD-H色谱柱(250 mm×4.6 mm,5 μm,DAICEL),流动相:正己烷/异丙醇(V/V=80/20),检测波长:210 nm,流速:1.0 mL· min-1,进 样 量:20 μL,柱 温:25 ℃];1H NMR δ:6.51(s,1H,CONH2),5.88(s,1H,CONH2),4.45(m,1H,CH),3.40(m,2H,NCH2),2.40(m,2H,COCH2),2.04(m,2H,CH2CH2CH2),1.95(m,1H,CH2CH3),1.66(m,1H,CH2CH3),0.87(t,J=7.6 Hz,3H,CH3);MS m/z:171.1{[M+H]+}。
A:收率80%,纯度97%[HPLC,色谱条件:C18 柱(250 mm ×4.6 mm,5 μm),流动相:0.2%磷酸氢二钾溶液/乙腈(V/V=95/5,用稀磷酸调pH 至 6.0),流速:1 mL·min-1,检测波长:210 nm];1H NMR δ:6.54(s,2H,CONH2),5.84(s,1H,NH),4.45(m,1H,CH),2.41(m,2H,COCH2),2.40(m,2H,CH2Cl),2.10(m,2H,CH2CH2Cl),1.89(m,1H,CH2CH3),1.68(m,1H,CH2CH3),0.96(t,J=7.6 Hz,3H,CH3);MS m/z:207.1{[M+H]+}。
(6)B的合成
在反应瓶中依次加入水60 mL,(S)-Ⅰ20 g(117.5 mmol)及 NaOH 7.1 g(117.5 mmol),搅拌下回流反应6 h。冷却至25℃,缓慢滴加浓盐酸至pH 1(析出大量固体);过滤,滤饼干燥得白色固体 B 15 g,收率 75.0%,纯度99.9%[HPLC,色谱条件同A];1H NMR(CDCl3)δ:12.34(s,1H,CO2H),4.51(dd,J=8.4 Hz,6.8 Hz,1H,CH),3.52(t,J=5.6 Hz,2H,NCH2),2.53(m,2H,COCH2),2.05(m,2H,CH2CH2CH2),2.01(m,1H,CH2CH3),1.81(m,1H,CH2CH3),0.91(t,J=7.6 Hz,3H,CH3);MS m/z:172.1{[M+H]+}。
2 结果与讨论
在(R)-Ⅰ和A的合成中,第一步采用石油醚和乙酸乙酯混合溶剂析晶,收率近100%,纯度99.4%;第四步直接于0℃在D-4·HCl或L-4·HCl的甲醇溶液中加入浓盐酸。该方法操作简便,避免了文献[5]方法中使用毒性较大的溶剂苯,经济环保。
成功合成了右乙拉西坦、左乙拉西坦杂质A及(S)-α-乙基-2-氧代-1-吡咯烷乙酸(左乙拉西坦酸),验证了杂质的产生机理,对左乙拉西坦片的质量研究起着重要作用;左乙拉西坦酸的合成为左乙拉西坦API贮存方法提供了理论依据,避免降解。
[1]Klitgaard H,Matagne A,Gobert J,et al.Evidence for a unique profile of levetiracetam in rodentmodels of seizures and epilepsy[J].Eur J Pharmacol,1998,353(2-3):191-196.
[2]Alma JG,Michel N.UCB L059,a novel anti-convulsant drug:Pharmacological profile in animals[J].Eur J pharmacol,1992,222:193.
[3]李丹,李晓宁,李春红.手性拆分左乙拉西坦原料药中的异构体[J].安徽医药,2008,12(12):1134-1136.
[4]孙启泉,施介华,等.左乙拉西坦右旋对映异构体的HPLC测定[J].中国医药工业杂志,2008,(8):613-614.
[5]周先波,徐广宇,周伊,等.抗癫痈治疗药物左乙拉西坦的合成研究[J].精细化工中间体,2005,35(2):27-28.
