不同MHC-DRB1单倍型哈萨克绵羊感染包虫病初期小肠组织差异表达基因筛选与分析
2015-04-18李鑫惠文巧蒋松贾斌张永生申红李洪涛王绪海韩国华刘帅兵石河子大学动物科技学院新疆石河子832000安徽省农业科学院安徽合肥230000
李鑫,惠文巧,2,蒋松,贾斌*,张永生,申红,李洪涛,王绪海,韩国华,刘帅兵(.石河子大学动物科技学院,新疆石河子832000;2.安徽省农业科学院,安徽合肥230000)
不同MHC-DRB1单倍型哈萨克绵羊感染包虫病初期小肠组织差异表达基因筛选与分析
李鑫1,惠文巧1,2,蒋松1,贾斌1*,张永生1,申红1,李洪涛1,王绪海1,韩国华1,刘帅兵1
(1.石河子大学动物科技学院,新疆石河子832000;2.安徽省农业科学院,安徽合肥230000)
前期研究发现哈萨克绵羊的单倍型MHC-DRB1基因单倍型MvaIbc-SacIIab-Hin1Iab与细粒棘球蚴病(包虫病)抗性密切相关,但具体分子抗病机制尚不明确。本研究旨在筛选和分析不同MHC基因型哈萨克绵羊感染包虫病早期小肠组织差异表达基因。以PCR-RFLP方法根据MHC-DRB1单倍型选择抗病和非抗病哈萨克绵羊,将实验动物分为包虫病抗性组(A)、包虫病非抗性组(B)和健康对照组(C),A、B两组分别于人工感染包虫病后2、3、4 h采集小肠组织,以C组为对照,采用基因芯片的方法分析不同各组间小肠差异表达基因。结果表明:A组与C组相比差异表达的基因共4 712个,其中表达量上调的有1 959个,表达量下调的有2 753个;B组与C组相比差异表达的基因4 944个,其中2 076个表达上调,2 868个表达下调;同C相比,A和B同为上调或下调,且表达量差异显著的基因有141个,其中32个基因表达上调,109个基因表达下调。综上,差异基因主要涵盖了代谢、细胞进程等方面,KEGG分析显示出现频率最高的补体凝集素通路代谢途径值得关注。
哈萨克羊;包虫病;小肠;差异基因;生物信息学分析
棘球蚴病(Echinocossosis),也称包虫病,是由棘球绦虫的幼虫-棘球蚴寄生在绵羊等宿主的内脏器官发育为包囊的一种人畜共患病[1]。该疾病呈世界性分布,新疆是包虫病的主要发病区之一[2],而目前屠宰管理和免疫接种等主要防治方法都有很大局限性。项目组在前期研究中发现新疆哈萨克绵的单倍型MHC-DRB1:MvaIbc-SacIIab-Hin1Iab与包虫病抗性相关,并证明具有该单倍型的哈萨克绵羊对于包虫病具有较强的抵抗力,但具体分子作用机制尚不清楚。细粒棘球绦虫的幼虫-六钩蚴在感染宿主时,首先要通过的第一道物理防线就是小肠黏膜,推测不同MHC基因型哈萨克绵羊的抗病性差异可能与宿主感染包虫病后小肠差异表达基因具有密切相关性[3]。
近年来,基因芯片技术已被应用到生物科学众多的研究领域之中,例如基因表达检测、突变检测、基因组多态性分析和基因文库作图以及杂交测序等方面[4-5],有助于科学家发现和了解疾病的感染途径和宿主的抗病机制,便于有针对性地研究开发相应诊疗方法[6-7]。
目前,基因芯片技术对分析寄生虫感染后的宿主基因表达变化具有很好的应用价值[8],但在包虫病方面仅仅围绕小鼠感染泡球蚴(AE)的动物模型上开展了相关研究[9]。因此,采用基因芯片技术对哈萨克绵羊人工感染包虫病后小肠差异表达基因进行分析,有助于探讨宿主对包虫病的分子抗病机制,也可为筛选潜在的分子遗传育种标记奠定基础。
1 材料与方法
1.1 实验材料于新疆兵团农九师165团哈萨克绵羊中心产区选择饲养环境和体重相近的哈萨克绵羊250只带上耳号,颈静脉采血后提取基因组DNA,以RFLP-PCR方法进行MHC-DRB1:MvaIbc-SacIIab-Hin1Iab抗包虫病单倍型分析;根据基因分型结果选择具有该单倍型的哈萨克绵羊作为实验组(A组),不具有该单倍型的绵羊作为对照组(B组)和空白对照组(C组),经ELISA免疫试剂盒和B超确认未感染包虫病,购买并饲养于石河子大学实验动物养殖场,饲养1周后进行人工攻虫试验。
选择当地健康土犬,驱虫后喂食感染包虫病的绵羊肝脏(含包囊),50 d后宰杀并从犬小肠中分离细粒棘球蚴含成熟孕节的绦虫,同时人工饲喂A组和B组全部6只绵羊,每只绵羊口服孕卵节片20个(前期研究已经证明人工感染成功),A、B两组绵羊于感染虫卵后2、3、4 h分别屠宰并采集小肠组织,C组绵羊亦屠宰并取其小肠,每组3只绵羊的小肠组织样本分别标记后置于液氮下保存。
1.2 药品和试剂哈萨克绵羊个体筛选所用的试剂:绵羊包虫病ELISA试剂盒购自深圳康百得生物科技有限公司;医用超声耦合剂购自天津市南开区华科医疗器械厂;Tris饱和酚、MHC-DRB1 exon2引物及溴酚蓝购自上海生工生物工程公司;DNA Marker DL2000、DNA Marker DL500、Taq酶、限制性内切酶Mva I、SacII、Hin1I、Hae III等购自宝生物(大连)有限公司;蛋白酶K(Sigma,美国)、琼脂糖(Merck,西班牙);DNA green购自北京天恩泽基因有限公司,QIAGEN RNeasy Kit。
1.3 仪器设备便携式兽用B超仪(50 S Tringa Vet_Pie Medical,荷兰);电子天平BL310(Sartorius公司,德国);PCR扩增仪(PTC-100TM型,BIO RAD公司);稳压稳流电泳仪(DYY-4型,北京六一仪器厂);BIO RAD凝胶成像分析系统(BIO RAD公司);台式高速离心机、Millipore超纯水器(密理博中国有限公司)。
1.4 基因芯片杂交与扫描分析小肠组织样本分别以Trizol法提取Total RNA,按照说明书利用QIAGEN RNeasy Kit纯化,合成cDNA后aaUTP标记cRNA合成,再次以QIAGEN RNeasy Mini kit纯化,经过cRNA浓度测定和cRNA样品荧光标记后纯化,计算荧光分子浓度及掺入率,进行cRNA样品片段化和芯片杂交、洗涤及芯片扫描和数据分析。以Agilent 2100 Bioanalyzer鉴定基因芯片检出率,用重复探针点(10次重复)信号的CV值来计算芯片的稳定性和技术的稳定性,根据不同的芯片,这样的探针点从20到100个不等。进行差异分析时,把每两组间t检验值P<0.05的,且差异倍数大于等于2倍的作为本研究的差异基因筛选标准。
该部分工作由北京华大蛋白质研发中心有限公司完成。
1.5 筛选获得差异基因的荧光定量验证
1.5.1 引物设计以持家基因GAPDH为内参和目的基因,用Primer Premier 6.0软件设计引物(表1),AHSG、ITLN2、MHC、ALB和GAPDH基因序列均来自NCBI,引物序列由北京华大基因公司合成。
1.5.2 实时定量PCR每个样品设3个重复实验以减少误差,以阳性克隆质粒稀释后作为标准品,将质粒10倍梯度稀释制作标准曲线。
反应体系为25 μL:质粒或cDNA产物1 μL,上、下游引物(10 μmol/L)各0.5 μL,2×SYBR green 11.25 μL,ddH2O 11.75 μL。95℃预变性4 min;PCR循环,95℃15 s,退火30 s,72℃1 min,共40个循环;然后95℃1 min;退火30 s;95℃30 s。
1.6 统计分析3次重复实验结果取平均值,用2-△CT相对定量的方法计算2个样本的相对表达量:△CT目的样品=CT目的样品-CT内参。结果均用平均值±标准差表示,用SPSS17.0软件进行数据分析。
2 结果
2.1 RNA样品质检信息RNA的质量直接关系到基因芯片实验的可靠性和完整性,使用Agilent 2100 Bioanalyzer对3个样本提取的RNA按照总量,A260/280,28S/18S亮度比值和RIN值等指标结合色谱分析进行质量判断,结果显示3个样本的RNA质量均符合实验要求(表2和图2)。
2.2 芯片实验
2.2.1 基因芯片检出率分析Agilent建议的质控标准是CV值小于15%,根据表3结果,各样品的芯片CV值均达到实验要求。
2.2.2 差异表达统计A组与C组相比,共有差异基因4 712个,其中1 959个呈表达上调,2 753个呈表达下调;B组与C组相比共有差异基因4 944个,表达上调和下调基因数分别为2 076个和2 868个,A组与B组相比差异基因有623个,其中274个表达上调,349个表达下调。
进一步分析发现,与C组相比,A组和B组在攻虫后表达均呈现上调趋势的基因为1 433个,其中A组表达量显著高于B组的6个,低于B的有26个;均下调的基因为1 958个。

图1 RNA电泳图
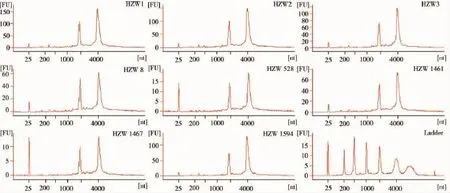
图2 用Agilent 2100 Bioanalyzer对每个样本进行质量检验
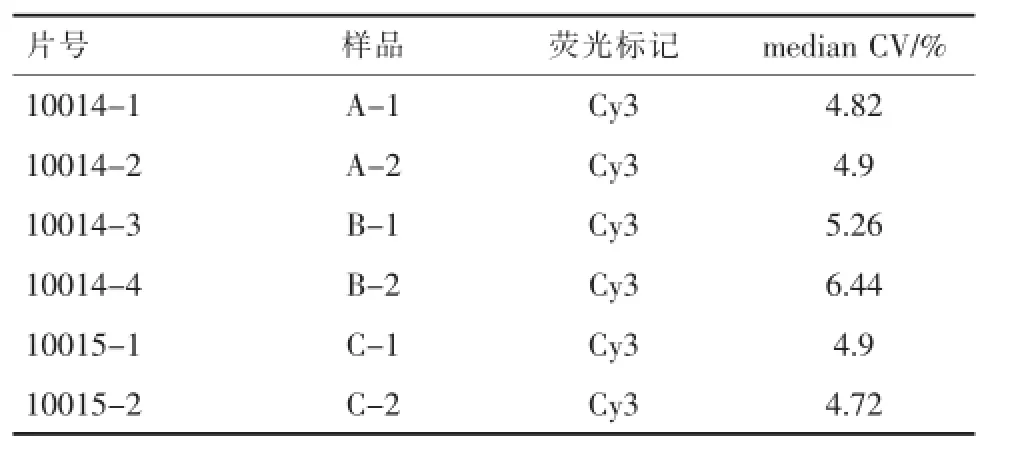
表3 荧光标记检测检出率
2.2.3 GO富集分析各组间差异表达的基因go富集结果比较相似,分子功能分析显示,大部分差异基因参与了代谢途径,生化分析显示外界刺激响应通路(reponse to stimulus)和代谢途径(metabolic process)出现的频率较高,参与这两个途径的各组间差异基因也较多,以上分析结果与预期结果较为接近。
2.2.4 KEGG代谢通路分析结果KEGG分析显示上述对比方式中各通路激活的模式比较相似,其中补体凝集素途径出现的基因最多,频率也最高。
2.3 荧光定量PCR结果统计
2.3.1 荧光定量溶解曲线检测如图8所示,本研究荧光定量检测包括每次对目的基因和内参基因的检测,样本扩增时各轮反应均设置了内参,荧光定量PCR结果均显示双峰,说明引物特异性好,实验结果可靠。
2.3.2 荧光定量柱状图分析由图8可知,在3个组中,ITLN2基因表达量B组>A组>C组(图8a);ALB基

表4 部分小肠组织差异表达基因
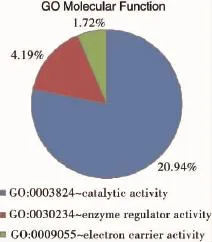
图3 aA组同B组间差异基因的go分子功能分析

图3 bA组同B组间差异基因go生化进程分析

图3 cA组同B组间差异基因的go细胞成分分析

图4 aA组同C组间差异基因go分子功能分析

图4 bA组同C组间差异基因go生化进程分析
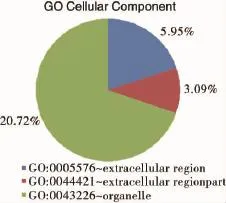
图4 cA组同C组间差异基因go细胞成分分析
S827.2
:A
:0258-7033(2015)19-0022-07
2014-11-27;
2015-01-03
国家自然科学基金(31260535、31060297);新疆重大疾病医学重点实验室开放课题(SKLIB-XJMDR-2012-1);石河子大学优秀青年项目(2013ZRKXYQ13、2012ZRKXYQ01)
李鑫(1983-),男,在读博士,讲师,研究方向为动物遗传育种与繁殖,E-mail:lixin2032433@qq.com
*通讯作者:贾斌(1965-),男,教授,博士生导师,研究方向为动物遗传育种与繁殖,E-mail:jiabin@shzu.edu.cn
