LRP-1调控血管完整性的研究进展*
2015-04-17吴剑波
杨 燕, 吴剑波
(泸州医学院药物与功能性食品研究中心, 四川 泸州 646000)
·综 述·
LRP-1调控血管完整性的研究进展*
杨 燕, 吴剑波△
(泸州医学院药物与功能性食品研究中心, 四川 泸州 646000)
低密度脂蛋白相关受体1(low-density lipoprotein receptor-related protein-1,LRP-1)属于低密度脂蛋白受体家族的成员,是一种定位于胞浆膜上介导胞吞作用的受体蛋白,目前发现其配体种类已超过40种,包括最近发现的金属蛋白酶组织抑制物1(tissue inhibitor of metalloproteinase-1,TIMP-1)[1]。部分研究显示LRP-1在平滑肌细胞、巨噬细胞、神经细胞和纤维细胞表面呈高水平表达。由于LRP-1能够与多种结构及功能各异的配体相互作用使得其不仅能介导胞吞作用,而且能够参与维持血脑屏障的完整性,调控巨噬细胞和平滑肌的增殖迁移[2],调节信号通路和介导黏着斑的降解等,从而有效保护和维持血管的稳定性。基因组学相关分析发现,LRP-1基因是腹主动脉瘤[3]、高脂血症[4]以及冠心病的易感位点。此外,近来陆续有研究表明表达于血管平滑肌[5]和巨噬细胞中[6]的LRP-1能有效阻碍血管动脉粥样硬化的形成,从而保护脉管系统。文章综述了LRP-1调节血管完整性的发现、作用机制及功能研究进展,揭示血管形成过程中以LRP-1介导的特异性胞内信号通路反应机制,展望LRP-1作为认识和研究血管壁性疾病的新靶点。
1 LRP-1结构及其与配体的识别机制
LRP-1是由低密度脂蛋白A型受体(low-density lipoprotein receptor type A,LDLa)重复域组成的模块结构所构成的,其结构中包括表皮生长因子样重复域,β螺旋结构域,跨膜结构域,及胞内结构域(intracellular domain,ICD)。LRP-1系低密度脂蛋白受体家族的成员,该家族中所有受体都包含了2个或以上富含半胱氨酸的补体型重复域(complement type repeats,CR),大多数配体都通过与该重复域结合而发挥作用。此外,所有低密度脂蛋白受体还包含了一个或多个与表皮因子前体同源的区域——YWTD重复域,其可以折叠成β螺旋结构域。低密度脂蛋白受体都包含有单向的跨膜结构域和不同长度的胞质域,这些胞质域由100个氨基酸残基组成,包括双亮氨酸基序和2个NPxY基序。在信号通路中,LRP-1的胞质域可与多个适配分子作用,而ICD则有转录调节功能。
和其它低密度脂蛋白配体识别方式相同,当LRP-1的LDLa重复域上天冬氨酸残基的羧基末端与其配体的赖氨酸残基的ε氨基端形成盐桥时,LRP-1便开始识别其配体。相互作用时,天冬氨酸残基在钙离子的作用下形成酸性口袋。在该酸性口袋中,赖氨酸残基的脂肪族相互之间形成范德华力,促进LRP-1与配体的结合。通常,当第2个赖氨酸残基出现时,便可与LDLa重复域上的氨基酸残基相互作用产生弱静电作用。目前已证实至少有8种配体是通过这种模式与LRP-1结合的[7-9]。
2 LRP-1的胞吞作用维持血管稳定性
血液循环中产生的乳糜微粒和蛋白,大多在肝脏中被降解,这与肝脏中高表达的LRP-1介导的胞吞作用直接联系。在被清除掉的蛋白中,包括凝血因子Ⅷ(coagulation factor Ⅷ,FⅧ)。FⅧ是体内一种重要的凝血因子蛋白,若体内该基因缺失,则会导致A型血友病的发生。正常情况下FⅧ处于非激活状态,与血浆血管性血友病因子(von Willebrand factor,vWF)结合成复合物在血液中循环,并且其在vWF上的结合区域已被证实,主要位于类胰蛋白酶抑制因子(trypsin-inhibitor-like,TIL)功能域易变区[10]。当血管受损时,FⅧ被激活,通过水解作用与vWF分离,随后激活态的FⅧ分布到血小板、内皮细胞和巨噬细胞表面并激活fIX,促进凝血。循环中FⅧ水平不仅受到其生物合成的调节,也与肝受体介导的清除相关。
肝脏中的LRP-1与FⅧ的降解是直接相关的。当用125I标记FⅧ后,在表达LRP-1的细胞中可明显看到fⅧ被清除掉,而在不表达LRP-1 的细胞中,FⅧ则几乎不被清除,且在体内不表达LRP-1的转基因小鼠血浆中发现FⅧ的表达水平是普通小鼠的2倍。当向该种小鼠血浆中输入125I标记的FⅧ后,FⅧ的清除时间延长,提示我们FⅧ的清除与LRP-1的表达是相关的。然而,LRP-1是怎样介导FⅧ的降解的,机制尚不够明确。目前广泛被接受的解释是FⅧ被激活后,肝脏中的乙酰肝素蛋白聚糖(heparan sulfate proteoglycans,HSPG)促进FⅧ/vWf复合物聚集到细胞表面并加快FⅧ与vWf分离,随后FⅧ与细胞膜上的LRP-1结合,通过胞吞作用,FⅧ即被降解,而vWf则重新被结合利用。除FⅧ外, LRP-1可通过HSPG途径而抑制金属蛋白酶组织抑制物3(tissue inhibitor of metalloproteinase-3,TIMP-3)的分泌[11]。
此外,最近研究发现LRP-1可能也参与了vWf的清除。体内实验发现,敲除小鼠肝脏中的LRP-1基因后,vWF水平明显升高。Rastegarlari等[12]在删除巨噬细胞中LRP-1的小鼠体内观察到vWF清除功能显著延迟的现象。而vWF清除位点主要是在肝脏,提示这可能是肝巨噬细胞中LRP-1的作用结果。
3 LRP-1调节细胞表面的水解活性维持血管稳定性
LRP-1通过调节细胞表面的受体水平而调节细胞介导的水解作用。组织因子(tissue factor,TF)就是其中一种受体。其是外源凝血途径中的重要成分,当血管壁的完整性遭到破坏时,TF暴露于循环血液,启动外源凝血途径,TF与凝血因子Ⅶ结合,激活凝血因子Ⅹ,促进凝血酶的形成。组织因子通道抑制剂(TF pathway inhibitor,TFPI)是该途径的主要抑制剂。TFPI包含3个库尼型蛋白酶抑制域,前2个与激活的凝血因子Ⅶ和Ⅹ结合成紧密复合物,抑制水解活性,羧基端的蛋白酶抑制域则与LRP-1结合,形成FⅦa/FXa/TF复合物,调节凝血活性。
除调节TF水平外,在LRP-1的介导作用下,发现尿激酶型纤溶酶原激活物(urokinase-type plasminogen activator, uPA)可以促进荷脂血管平滑肌的迁移[13]。uPAR与uPA紧密结合提供一个细胞层面的蛋白水解通路,而LRP-1则是通过调节该水解通路来发挥作用的[14]。
4 LRP-1调节PAI-1维持血管稳定性
纤溶酶原激活物抑制剂1(plasminogen activator inhibitor 1,PAI-1)是一种通过抑制纤溶酶原的激活来调节纤维蛋白溶解的多功能蛋白,在心血管系统中,PAI-1表达水平异常可直接导致心血管疾病的发生。目前,已证实,动脉粥样硬化、肥胖、糖尿病、高血压都与PAI-1的异常表达有关。近来发现,其可在LRP-1的作用下参与调控信号通路而上调细胞运动性[15]。在动脉硬化的斑块组织中,发现与形成斑块相关的细胞中PAI-1的表达是增高的,其机制可能是PAI-1通过稳定纤维蛋白基质使其成为一种支持蛋白,从而为细胞迁移或促进平滑肌细胞增殖提供了支架。而LRP-1除介导胞吞作用和调节信号通路外,同时还能促进其适配因子与支持蛋白间发生相互作用。当LRP-1与细胞表面的配体如整合素、生长因子受体和蛋白多糖结合形成复合物时,可以激活有丝分裂素激活蛋白和非受体Src蛋白激酶,影响细胞的增殖迁移。PAI-1也可通过与LRP-1直接结合,作为一种信号调节分子影响细胞迁移。实验发现,PAI-1的3种构象体(激活态、未激活态和裂解态)都能通过激活Jak/Stat1信号通路增加LRP-1依赖途径的细胞迁移[16]。
在LRP-1参与下,PAI-1调节细胞的迁移主要通过以下2种形式:uPA/uPAR非依赖途径和uPA/uPAR依赖途径。其中,在uPA/uPAR非依赖途径中,PAI-1直接与LRP-1结合,促发Jak/Stat1信号通路进而加快细胞迁移[17]。而在uPA/uPAR依赖途径中,当PAI-1与uPA/uPAR相互结合形成PAI-1/uPA/uPAR复合物后,随后在LRP-1的作用下发生内质化[18]。PAI-1/uPA/uPAR复合物促发细胞表面整合素αVβ3与细胞外基质(extracellular matrix,ECM)配体分离,进而调节细胞增殖迁移及分化功能。之后,整合素αVβ3、uPAR、LRP1循环到细胞表面被重新利用,而uPA 和PAI-1被降解掉,如图1所示。
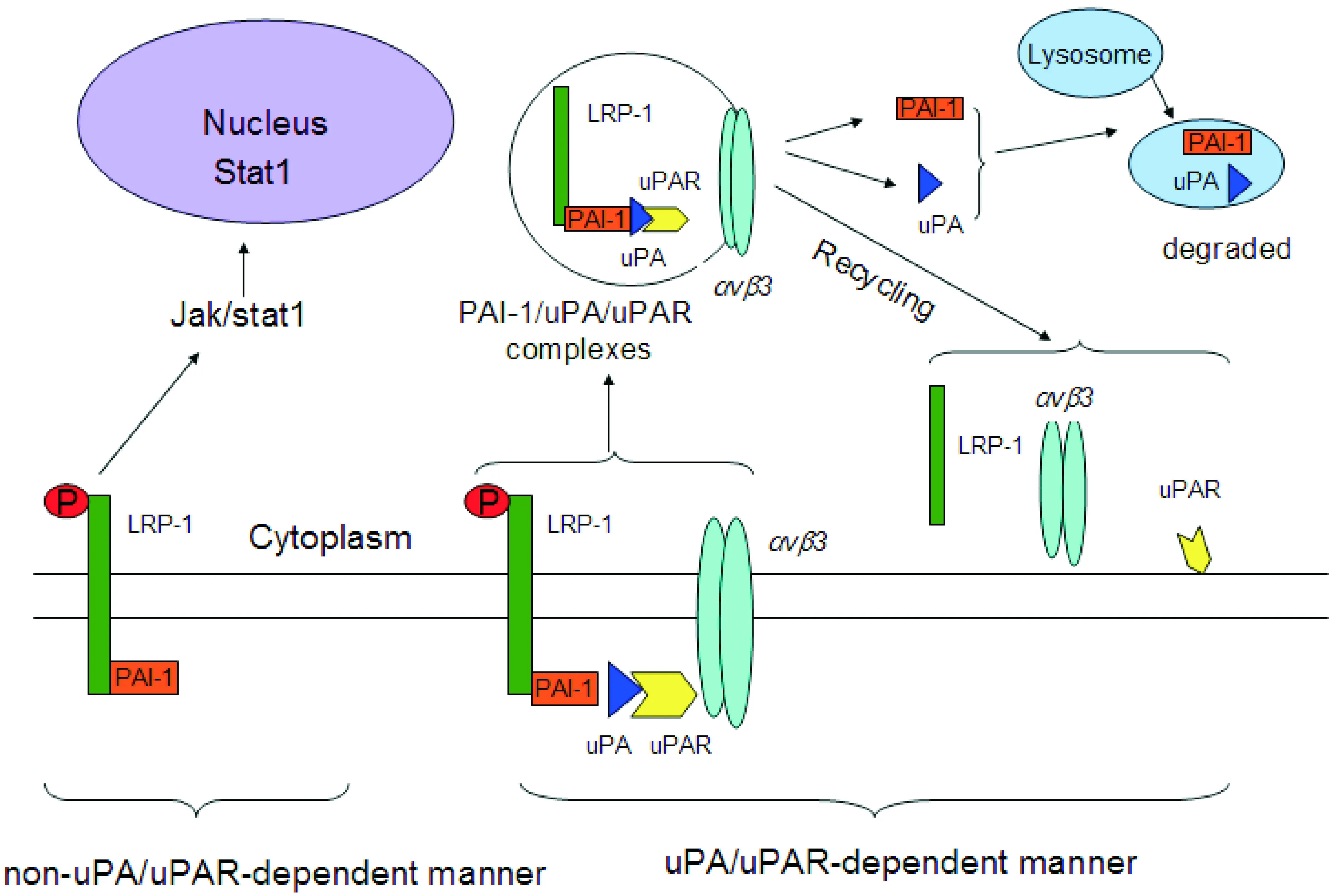
Figure 1.The two pathways by which LRP-1 regulates PAI-1.
图1 LRP-1调节PAI-1的2种途径
5 LRP-1调节信号通路维持血管稳定性
近年来发现,LRP-1还能调节炎症、动脉粥样硬化以及肿瘤形成中的一些信号通路,而这些通路对维持血管的稳定性有着重要意义[19]。在缺乏LRP-1的小鼠血管平滑肌中,其主动脉壁增厚,弹性板增厚,有主动脉瘤形成,且动脉粥样硬化易感性增高。研究发现,LRP-1在血管平滑肌发挥作用的机制主要是通过调节血小板源性生长因子(platelet-derived growth factor,PDGF)信号通路和转化生长因子β(transforming growth factor-β,TGF-β)信号通路。
5.1 平滑肌中LRP-1调控PDGF信号通路抑制动脉粥样硬化的形成 很多研究已陆续揭示了在动脉粥样硬化和内膜新生过程中,PDGF是纤维母细胞和平滑肌细胞的强启动子[20]。当PDGF与其受体PDGFR-β结合时,PDGF信号通路被激活。PDGFR-β是一种酪氨酸激酶受体,与PDGF结合后,PDGF信号通路即被激活,进而促进细胞增殖迁移。但过多地激活PDGF信号通路后,通常会引发肿瘤。调节PDGFR是一种防止PDGF信号通路过度激活的重要途径,LRP-1就是其中一种通过调控PDGFR而抑制PDGF信号通路过多被激活的分子[21-22]。缺乏LRP-1的小鼠动脉壁上发现平滑肌增生,且PDGFR-β表达量增加,PDGFR-β和Smad2磷酸化增加,表明LRP-1与PDGFR-β的过表达相关。在喂食高胆固醇情况下,发现敲除了LRP-1和LDLR的小鼠(smLRP-1-/LDLR- mice)比普通小鼠更容易形成动脉粥样硬化,且PDGF表达量也明显增高。此外,smLRP1小鼠血管弹性板明显被破坏,且有动脉瘤形成,但当用酪氨酸激酶抑制剂gleevec阻断PDGF-β后,对血管的损害作用便得到明显改善。提示我们,LRP-1可以抑制PDGF信号通路的过度表达,从而发挥其保护血管的作用。
然而,LRP-1是如何调节PDGF通路的,机制尚不完全清楚。当PDGFRβ被激活时,LRP-1胞内域的NPxY末端序列被酪氨酸磷酸化,从而为酪氨酸磷酸化结合域及Src家族同源区2结构域的适配蛋白构建了一个结合位点[23]。其中一种适配蛋白是Shp-2,这是一种酪氨酸磷酸酶,在激活大鼠肉瘤或大鼠基质瘤时,作为PDGFR信号通路的信号调节激酶。Shp-2与磷酸化的LRP-1胞内域有高亲和力,其在LRP-1减弱PDGF介导的信号通路时扮演着重要作用。另一种分子是与LRP-1胞内域相关的c-Cbl,这是一种泛素-E3-连接酶,其可以调节酪氨酸激酶受体PDGFRβ的泛素化。而在缺乏LRP-1的小鼠胚胎纤维母细胞中PDGFRβ的泛素化总是高于表达LRP-1的小鼠胚胎纤维细胞。这些都表明了,LRP-1与PDGFβ的泛素化相关。在特定敲除小鼠平滑肌细胞中的LRP-1后(即smLRP-1小鼠),这些数据目前却无法解释该种小鼠体内观察到的激活态PDGFRβ增加、PDGF信号也增强的现象。
5.2 LRP-1调控TGF-β信号通路 TGF-β可以调节体内诸多生化过程如,增殖迁移,胞外基质的生物合成,血管新生,免疫应答及细胞的凋亡与分化。在血管受损时,TGF-β也参与了其修复过程。TGF-β的激活主要是通过其受体来调节的,LRP-1就是其中一种最新发现的TGF-β受体。与其它TGF-β受体如TGF-βRⅠ、TGF-βRⅡ和TGF-βRⅢ极其相似,因此LRP-1被命名为第Ⅴ型TGF-β受体,它们都主要表达于细胞表面。用125I标记TGF-β,发现TGF-β与LRP-1之间确有交联作用,并且该作用可被LRP-1的阻断剂RAP阻断。目前发现其发生交联的位点主要是位于饰胶蛋白聚糖中第5和第6区域[24]。Muratoglu等[25]通过表面等离子体共振实验也证实了TGF-β1和TGF-β2是直接与LRP-1结合的。在血管修复过程中,巨噬细胞中的LRP-1通过下调TGF-β2的蛋白和基因表达水平从而调节TGF-β信号通路抑制内膜新生。 此外,smLRP-1小鼠LDLR的缺失使其管脉系统的细胞核中Smad2/3表达增加,这主要是因为TGF-β信号通路过多地被激活。由于缺乏LRP-1,TGF-β信号通路过多被激活,同时也会增加动脉壁上的PDGFR-β的表达量,进而过多激活PDGF-BB信号通路,促进动脉粥样硬化病变的发生。
综上所述,LRP-1可以通过调节信号通路,或影响通路与通路之间的相互作用而保护和维持血管的完整性。胞浆LRP-1能够与多种特有生理作用的配体相互作用,不仅介导内吞作用,而且参与调节细胞水解活性、细胞增殖、迁移以及复杂信号通路,进而维持血脂动态及纤溶系统稳定性,同时通过调控多类细胞生长因子、细胞激酶等,与动脉粥样硬化、心肌梗死及中风等疾病密切相关,提示LRP-1可能是潜在的心血管类疾病新的致病因子。
当前血管稳定性相关LRP-1功能及作用机制研究已取得较大进展,如最近研究已发现LRP-1影响着巨噬细胞的极化从而促进M1型巨噬细胞向M2型巨噬细胞的转化,这可能对血管性疾病的治疗是一个新思路[26]。但仍存在诸多疑问,例如,LRP-1作为调节FⅧ水平的关键受体,其功能作用途径及相关机理研究仍不清楚;并且TFPI途径中LRP-1介导FⅦ/TF复合物的清除到底有何意义,仍是未来研究的重要方向。另外,部分研究揭示LRP-1可以介导炎症中产生的生长因子和蛋白酶的摄取,但该功能途径具体是通过LRP-1介导的胞吞作用还是通过直接激活该生长因子或蛋白酶的信号通路产生的结果,尚待进一步探究。
随着对LRP-1配体及其作用方式的深入研究,已陆续揭示LRP-1在维持血脑屏障的完整性,调控巨噬细胞及平滑肌的增殖迁移,调节信号通路等生理过程中扮演着重要作用,这将为腹主动脉瘤、高脂血症以及冠心病等血管性疾病的防治提供新突破口。此外, 已发现增加VLDLR基因表达可改善2型糖尿病大鼠脂代谢紊乱,并可在此基础上减轻主动脉粥样斑块程度[27]。因此,进一步以LRP-1为靶点的抗动脉粥样硬化及其它血管类疾病药物研发也可能成为未来新药研发的新方向。
[1] Thevenard J, Verzeaux L, Devy J, et al. Low-density lipoprotein receptor-related protein-1 mediates endocytic clearance of tissue inhibitor of metalloproteinases-1 and promotes its cytokine-like activities[J]. PLoS One, 2014, 9(7): e103839.
[2] Ranganathan S, Cao C, Catania J, et al. Molecular basis for the interaction of the low density lipoprotein receptor-related protein 1 (LRP1) with the integrin αMβ2: identification of binding sites within αMβ2for LRP1[J]. J Biol Chem, 2011, 286(35): 30535-30541.
[3] Bown MJ, Jones GT, Harrison SC, et al. Abdominal aortic aneurysm is associated with a variant in low-density li-poprotein receptor-related protein 1[J]. Am J Hum Genet, 2011, 89(5):619-627.
[4] Teslovich TM, Musunuru K, Smith AV, et al. Biological, clinical and population relevance of 95 loci for blood lipids[J]. Nature, 2010, 466(7307):707-713.
[5] Muratoglu SC, Belgrave S, Hampton B, et al. LRP1 protects the vasculature by regulating levels of connective tissue growth factor and HtrA1[J]. Arterioscler Thromb Vasc Biol, 2013, 33(9): 2137-2146.
[6] Muratoglu SC, Belgrave S, Lillis AP, et al. Macrophage LRP1 suppresses neo-intima formation during vascular remodeling by modulating the TGF-β signaling pathway[J]. PLoS One, 2011, 6(12):e28846.
[7] Lee CJ, De Biasio A, Beglova N. Mode of interaction between β2GPI and lipoprotein receptors suggests mutually exclusive binding of β2GPI to the receptors and anionic phospholipids[J]. Structure, 2010, 18(3):366-376.
[8] Guttman M, Prieto JH, Handel TM, et al. Structure of the minimal interface between ApoE and LRP[J]. J Mol Biol, 2010, 398(2):306-319.
[9] Dagil R, O’Shea C, Nykjr A, et al. Gentamicin binds to the megalin receptor as a competitive inhibitor using the common ligand binding motif of complement type repeats: insight from the NMR structure of the 10th complement type repeat domain alone and in complex with gentamicin[J]. J Biol Chem, 2013, 288(6): 4424-4435.
[10]Shiltagh N, Kirkpatrick J, Cabrita LD, et al. Solution structure of the major factor VIII binding region on von Willebrand factor[J]. Blood, 2014, 123(26): 4143-4151.
[11]Troeberg L, Lazenbatt C, Anower-E-Khuda MF, et al. Sulfated glycosaminoglycans control the extracellular trafficking and the activity of the metalloprotease inhibitor TIMP-3[J]. Chem Biol, 2014, 21(10):1300-1309.
[12]Rastegarlari G, Pegon JN, Casari C, et al. Macrophage LRP1 contributes to the clearance of von Willebrand factor[J]. Blood, 2012, 119(9):2126-2134.
[13]Lugano R, Pea E, Casani L, et al. UPA promotes lipid-loaded vascular smooth muscle cell migration through LRP-1[J]. Cardiovasc Res, 2013, 100(2):262-271.
[14]Gonias SL, Gaultier A, Jo M. Regulation of the urokinase receptor (uPAR) by LDL receptor-related protein-1 (LRP1)[J]. Curr Pharm Des, 2011, 17(19): 1962-1969.
[15]Simone TM, Higgins SP, Higgins CE, et al. Chemical antagonists of plasminogen activator inhibitor-1: mechanisms of action and therapeutic potential in vascular disease[J]. J Mol Genet Med, 2014, 8: 3.
[16]Kamikubo Y, Neels JG, Degryse B. Vitronectin inhibits plasminogen activator inhibitor-1-induced signalling and chemotaxis by blocking plasminogen activator inhibitor-1 binding to the low-density lipoprotein receptor-related protein[J]. Int J Biochem Cell Biol, 2009, 41(3):578-585.
[17]Garg N, Goyal N, Strawn TL, et al. Plasminogen activator inhibitor-1 and vitronectin expression level and stoichiometry regulate vascular smooth muscle cell migration through physiological collagen matrices[J]. J Thromb Haemost, 2010, 8(8):1847-1854.
[18]Czekay RP, Loskutoff DJ. Plasminogen activator inhibitors regulate cell adhesion through a uPAR-dependent mechanism[J]. J Cell Physiol, 2009, 220(3): 655-663.
[19]Gonias SL, Campana WM. LDL receptor-related protein-1: a regulator of inflammation in atherosclerosis, cancer, and injury to the nervous system[J]. Am J Pathol, 2014, 184(1):18-27.
[20]Caglayan E, Vantler M, Leppänen O, et al. Disruption of platelet-derived growth factor-dependent phosphatidylinositol 3-kinase and phospholipase Cγ1 activity abolishes vascular smooth muscle cell proliferation and migration and attenuates neointima formationinvivo[J]. J Am Coll Cardiol, 2011, 57(25): 2527-2538.
[21]Muratoglu SC, Mikhailenko I, Newton C, et al. Low density lipoprotein receptor-related protein 1 (LRP1) forms a signaling complex with platelet-derived growth factor receptor-beta in endosomes and regulates activation of the MAPK pathway[J]. J Biol Chem, 2010, 285(19):14308-14317.
[22]Zhou L, Takayama Y, Boucher P, et al. LRP1 regulates architecture of the vascular wall by controlling PDGFRβ-dependent phosphatidylinositol 3-kinase activation[J]. PLoS One, 2009, 4(9):e6922.
[23]Craig J, Mikhailenko I, Noyes N, et al. The LDL receptor-related protein 1 (LRP1) regulates the PDGF signaling pathway by binding the protein phosphatase SHP-2 and modulating SHP-2-mediated PDGF signaling events[J]. PLoS One, 2013, 8(7):e70432.
[24]Cabello-Verrugio C, Santander C, Cofré C, et al. The internal region leucine-rich repeat 6 of decorin interacts with low density lipoprotein receptor-related protein-1, modulates transforming growth factor (TGF)-β-dependent signaling, and inhibits TGF-β-dependent fibrotic response in skeletal muscles[J]. J Biol Chem, 2012, 287(9):6773-6787.
[25]Muratoglu SC, Belgrave S, Lillis AP, et al. Macrophage LRP1 suppresses neo-intima formation during vascular remodeling by modulating the TGF-β signaling pathway[J]. PLoS One, 2011, 6(12):e28846.
[26]May P, Bock HH, Nofer JR. Low density receptor-related protein 1 (LRP1) promotes anti-inflammatory phenotype in murine macrophages[J]. Cell Tissue Res, 2013, 354(3):887-889.
[27]刘永健, 张木勋, 张建华, 等. 重组腺相关病毒介导的VLDLR基因对2型糖尿病大鼠脂代谢紊乱的作用[J]. 中国病理生理杂志, 2009, 25(2):344-350.
Advances in LRP-1-regulated vascular integrity
YANG Yan, WU Jian-bo
(DrugDiscoveryResearchCenter,LuzhouMedicalCollege,Luzhou646000,China.E-mail:jbwucn@163.com)
Low-density lipoprotein receptor-related protein-1 (LRP-1) is a transmembrane receptor protein located on the plasma membrane of the cells and involved in receptor-mediated endocytosis. LRP-1 binds to distinct ligands that are structurally and functionally unrelated, which makes it not only mediates endocytosis, but also regulates cell surface proteolytic activity and specific intracellular signaling pathways related to multiple links in the process of development of atherosclerosis. Moreover, LRP-1 plays an important role in maintaining vascular stability. This review focuses on the progress in LRP-1-regulated vascular integrity, and provides new insights to the target of the blood vessel diseases.
低密度脂蛋白相关受体1; 凝血因子Ⅷ; 胞吞; 信号通路
Low-density lipoprotein receptor-related protein-1; Gogultion factor Ⅷ; Endocytosis; Signal pathway
1000- 4718(2015)04- 0759- 05
2014- 12- 01
2015- 01- 22
国家自然科学基金资助项目(No. 81172050);四川省科技厅资助项目(No. 14ZC2765)
R363
A
10.3969/j.issn.1000- 4718.2015.04.033
△通讯作者 Tel: 0830-3161673; E-mail: jbwucn@163.com
