帕立骨化醇抑制糖尿病肾病大鼠肾小管间质纤维化*
2015-04-17王来亮蔡珂丹周芳芳高燕红
王来亮, 罗 群, 蔡珂丹, 周芳芳, 高燕红
(宁波市第二医院肾内科,浙江 宁波 315010)
帕立骨化醇抑制糖尿病肾病大鼠肾小管间质纤维化*
王来亮, 罗 群△, 蔡珂丹, 周芳芳, 高燕红
(宁波市第二医院肾内科,浙江 宁波 315010)
目的: 探讨帕立骨化醇(paricalcitol,P)对糖尿病肾病(DN)肾小管间质纤维化的干预作用及可能机制。方法: 大鼠禁食后,采用单次无菌腹腔注射链脲佐菌素建立DN模型。将DN大鼠随机分为:(1) 帕立骨化醇干预组(P组):帕立骨化醇溶于丙二醇中,于造模成功后第2天以0.4 μg/kg的剂量腹腔注射,每周3次;(2) 糖尿病肾病组(D组):给予等体积的丙二醇腹腔注射。设置正常对照组(C组)。帕立骨化醇连续干预12周后,测血、尿生化指标;进行肾脏病理学检查;利用免疫组化及Western blotting检测肾组织TGF-β1、Wnt-4、β-catenin及Klotho蛋白的表达;并进行指标间的相关分析。结果: (1) 与C组比较,D组大鼠SCr、BUN及24 h尿蛋白水平均升高,而P组均较D组降低(P<0.05)。(2) 与C组比较,D组大鼠肾小管间质纤维化面积增加,而P组较D组减小(P<0.05)。(3) D组大鼠肾组织Klotho蛋白表达低于C组,而P组高于D组(P<0.05);与C组比较,D组大鼠肾组织TGF-β1、Wnt-4及β-catenin蛋白表达增加,而P组表达均较D组减少(P<0.05)。(4) Klotho与纤维化面积、TGF-β1、Wnt-4及β-catenin均呈负相关(P<0.05)。结论: 帕立骨化醇可抑制DN大鼠肾小管间质纤维化,其作用可能与增加肾组织Klotho表达,抑制Wnt/β-catenin信号通路激活,同时减少TGF-β1合成相关。
帕立骨化醇; 糖尿病肾病; 肾小管间质纤维化; Wnt/β-catenin信号通路; Klotho蛋白
糖尿病肾病(diabetic nephropathy,DN)是糖尿病患者最主要的微血管病变,在我国已迅速上升为终末期肾病的重要原因。近年研究发现,DN肾小管间质改变并非继发于肾小球的病变,而是早期病变及原始特征之一,对肾功能的预后较肾小球病变更为重要[1-2]。帕立骨化醇(paricalcitol,P)为新型的维生素D类似物,对肾脏具有多方面的保护作用[3-4],但其对DN肾小管间质纤维化的作用及机制尚未阐明。本研究利用帕立骨化醇作用于DN大鼠,通过观察肾组织病理学改变及转化生长因子β1(transforming growth factor β1,TGF-β1)蛋白、Wnt/β-catenin信号途径与Klotho蛋白表达的变化,以探讨帕立骨化醇对肾小管间质纤维化的作用及可能机制,最终为DN肾小管间质纤维化的防治提供新靶点。
材 料 和 方 法
1 实验动物与主要试剂
雄性Sprague Dawley大鼠24只,清洁级封闭群,体重200~220 g,由浙江省动物中心提供,于宁波大学实验动物中心饲养。兔抗Klotho多克隆抗体(Prosci);兔抗β-catenin多克隆抗体(Gene Tex);兔抗Wnt-4多克隆抗体、兔抗TGF-β1多克隆抗体及兔抗β-actin多克隆抗体(Santa Cruz);山羊抗兔IgG荧光II抗(Odyssey);链脲佐菌素(Sigma);帕立骨化醇(Abbott);免疫组化检测试剂盒、DAB显色试剂盒(武汉博士德)。
2 动物模型的建立与分组
大鼠适应性喂养1周,禁食12 h后单次无菌腹腔注射1%链脲佐菌素(65 mg/kg)。1%链脲佐菌素溶液临用前用0.1 mmol/L柠檬酸-柠檬酸二钠缓冲液(pH4.5)配制,30 min内注射完。72 h后夜间禁食(≥8 h),晨起断尾取血测空腹血糖,空腹血糖≥16.7 mmol/L并能维持1周者确定为糖尿病模型;3周后测尿蛋白≥30 mg/24 h者确定为糖尿病肾病造模成功。16只大鼠糖尿病肾病造模全部成功。将糖尿病肾病大鼠按随机数字表法分为2组,每组8只:(1) 帕立骨化醇干预组(P组):帕立骨化醇溶于丙二醇中,于造模成功后第2 天以0.4 μg/kg的剂量腹腔注射,每周3次,连续12周;(2) 糖尿病肾病组(D组):DN大鼠给予等体积的丙二醇腹腔注射。另设正常对照(control,C)组:正常大鼠给予等体积的丙二醇腹腔注射。
3 标本收集
连续干预12周后大鼠禁食,代谢笼收集24 h尿液,记录尿量后留取样品5 mL,2 000 r/min离心10 min,取上清待检。用10%水合氯醛3 mL/kg腹腔注射麻醉后处死大鼠,心脏采血3~5 mL,3 500 r/min离心10 min,留取血清待检。采血后立即开腹取双肾,清除肾蒂结缔组织及肾脏包膜,纵向剖开肾脏:取部分组织置于4%多聚甲醛溶液固定24 h,常规脱水、透明,石蜡包埋;其余肾组织用液氮冻存。
4 实验方法
4.1 生化指标检测 血糖采用快速血糖仪检测;血清肌酐、血尿素氮、尿蛋白、血钙磷及全段甲状旁腺激素(intact parathyroid hormone,iPTH)采用Beckcoulter UniCel DxC 800 Synchron全自动生化分析仪检测。
4.2 肾脏病理学检查 肾组织石蜡切片(厚3~4 μm),进行常规HE染色及Masson染色,光镜下观察肾组织形态结构的变化。用Image-Pro Plus 6.0图像分析软件对肾小管间质纤维化进行半定量分析:每张切片随机选取10个不重复视野(×200),分别检测每个视野中肾小管间质纤维化的特异染色面积,用平均染色面积作为组织纤维化的替代指标。
4.3 免疫组化实验 肾组织石蜡切片(厚3~4 μm),脱蜡、水化,3% H2O2阻断内源性过氧化物酶,微波修复抗原,5% BSA封闭;分别滴加Klotho(1∶300)、Wnt-4(1∶200)、β-catenin(1∶200)和TGF-β1(1∶100)I抗,4 ℃孵育过夜;滴加HRP标记的II抗,显微镜下控制DAB显色;苏木素复染,脱水、透明并封片。用PBS替代I抗作阴性对照。用Image-Pro Plus 6.0图像分析软件对蛋白的表达进行半定量分析:每张切片随机选取10个不重复视野(×200),分别检测每个视野中指标的阳性区积分光密度(integral optical density,IOD),并取IOD均值作为阳性物质的相对表达量。
4.4 Western blotting实验 取液氮冻存的肾组织,加适量裂解液后充分研磨,4 ℃裂解组织,12 000×g低温离心2 min,取上清液,BCA 法测蛋白浓度;取总蛋白30 μg,100 ℃加热变性5 min后上样,进行SDS-PAGE,并湿转至PVDF膜;5% BSA室温封闭2 h,加入Klotho(1∶400)、Wnt-4(1∶200)、β-catenin(1∶200)和TGF-β1(1∶200) I抗,4 ℃孵育过夜;加荧光标记的II抗(1∶10 000)室温反应1 h后,采用Odyssey红外激光成像系统扫描成像,并测量条带灰度值,以β-actin为内参照,进行定量分析。
5 统计学处理
所有资料应用Stata 12.0统计学软件进行数据分析。计量资料以均数±标准差(mean±SD)表示,组间差异比较采用单因素方差分析及LSD-t检验,指标间相关分析采用Pearson’s直线相关性检验,以P<0.05为差异有统计学意义。
结 果
1 生化指标
DN第12周,D组的空腹血糖水平显著高于C组(P<0.05),但与P组比较,差异无统计学意义(P>0.05);D组的Scr、BUN及24 h尿蛋白水平均高于C组,但P组均低于D组(P<0.05);与C组比较,D组的血磷与iPTH水平均上升,血钙水平下降,但相较于D组,P组的血磷与iPTH水平均回降,血钙水平回升(P<0.05),见表1。

表1 各组生化指标情况
*P<0.05vsgroup C;#P<0.05vsgroup D.
2 HE染色与Masson染色观察肾组织的病理改变
C组大鼠肾小管结构完整清晰,无明显病理改变;D组可见肾小管间质局部炎症细胞浸润,肾小管上皮细胞脱落,小管扩张,基底膜断裂,与C组比较,纤维化面积(绿色)增大(P<0.05),P组肾小管间质病理改变较D组减轻,纤维化面积减小(P<0.05),见图1。
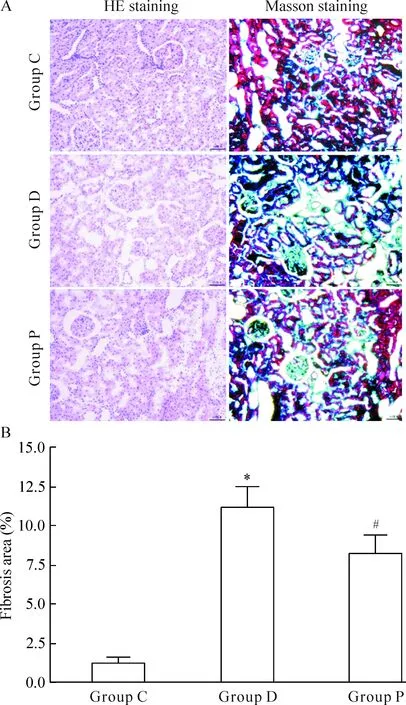
Figure 1.The pathological changes of the renal tissues. A: the pathological images of the renal tissues with HE staining and Masson staining (×200); B: the quantitative analysis of the fibrosis area in the renal tissues. Mean±SD.n=8.*P<0.05vsgroup C;#P<0.05vsgroup D.
图1 肾组织HE与Masson染色结果
3 各组肾组织TGF-β1蛋白的表达
免疫组化结果显示,与C组比较,D组肾小管间质TGF-β1表达上调,积分光密度升高(P<0.05);而P组TGF-β1表达较D组下调,积分光密度降低(P<0.05),见图2。Western blotting结果也显示,与C组比较,D组肾组织TGF-β1蛋白表达增加,而P组较D组表达减少(P<0.05),见图3。
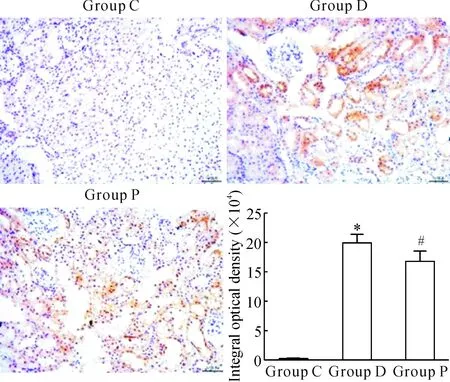
Figure 2.The expression of TGF-β1 in the renal tissues determined by immunohistochemical staining (×200). Mean±SD.n=8.*P<0.05vsgroup C;#P<0.05vsgroup D.
图2 免疫组化检测肾组织TGF-β1的表达情况
4 各组肾组织Wnt-4及β-catenin蛋白的表达
免疫组化结果显示,与C组比较,D组肾小管间质Wnt-4与β-catenin表达上调,积分光密度升高(P<0.05),而P组表达较D组下调,积分光密度降低(P<0.05),见图4。Western blotting结果也显示,与C组比较,D组肾组织Wnt-4与β-catenin蛋白表达增加(P<0.05),而P组较D组表达减少(P<0.05),见图5。
5 各组肾组织Klotho蛋白的表达
免疫组化结果显示,C组Klotho蛋白在肾小管呈高表达,与C组比较,D组肾小管Klotho蛋白表达下调(P<0.05);而P组Klotho蛋白表达较D组上调(P<0.05),见图6。Western blotting结果同样显示,与C组比较,D组肾组织Klotho蛋白表达减少(P<0.05),而P组较D组表达增加(P<0.05),见图7。
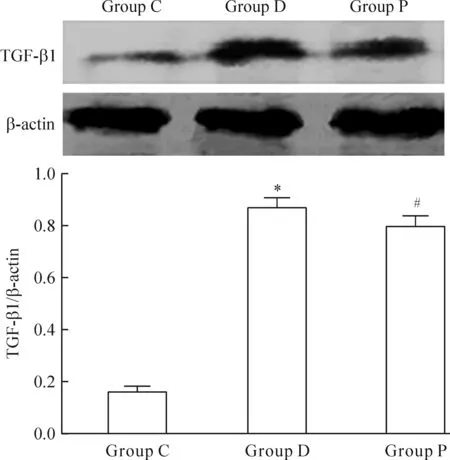
Figure 3.The expression of TGF-β1 in renal tissue determined by Western blotting. Mean±SD.n=8.*P<0.05vsgroup C;#P<0.05vsgroup D.
图3 Western blotting检测肾组织TGF-β1的表达情况
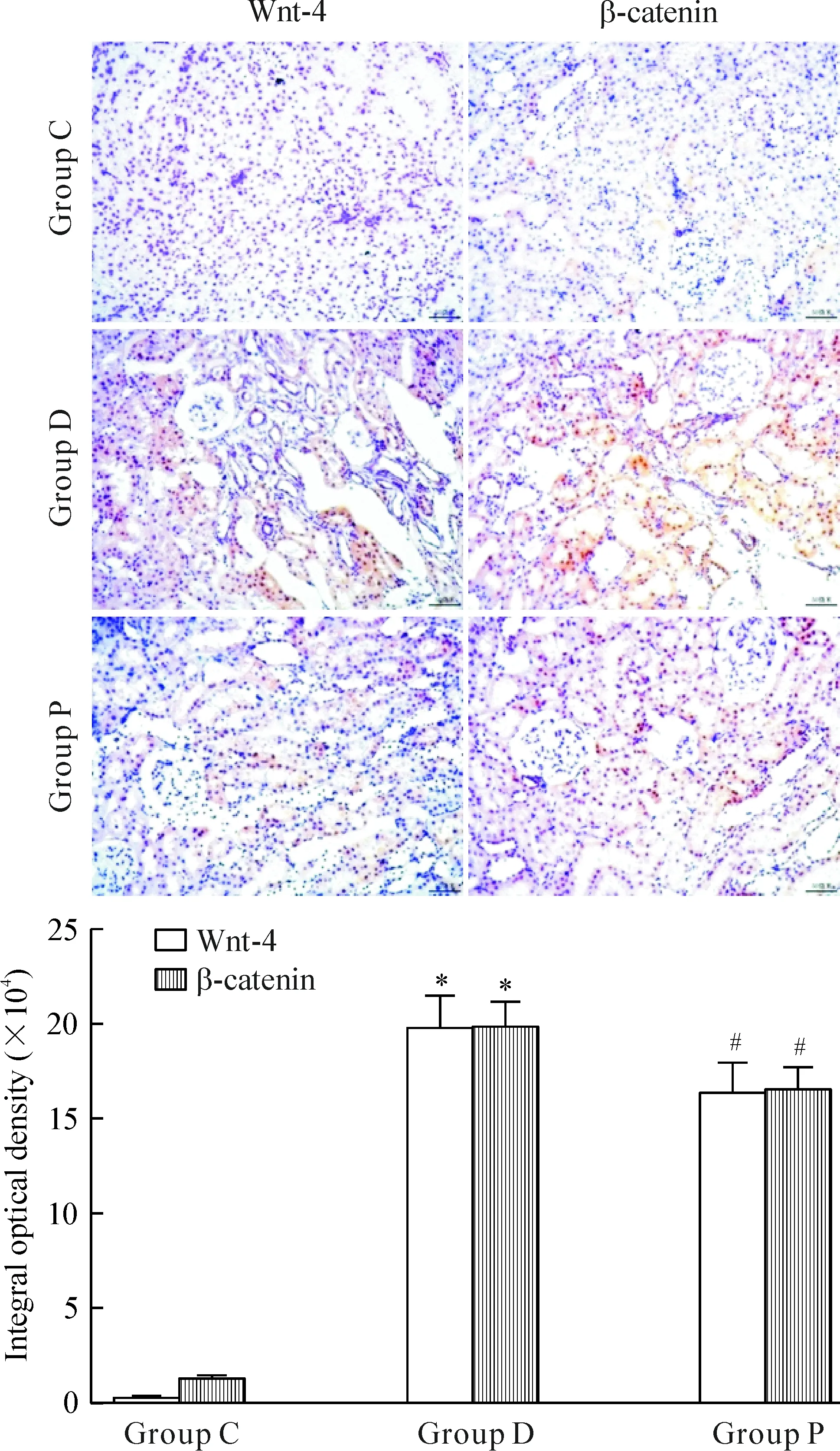
Figure 4.The expression of Wnt-4 and β-catenin in the renal tissues determined by immunohistochemical staining (×200). Mean±SD.n=8.*P<0.05vsgroup C;#P<0.05vsgroup D.
图4 免疫组化检测肾组织Wnt-4与β-catenin的表达情况

Figure 5.The expression of Wnt-4 and β-catenin in the renal tissue determined by Western blotting. Mean±SD.n=8.*P<0.05vsgroup C;#P<0.05vsgroup D.
图5 Western blotting检测肾组织Wnt-4与β-catenin的表达情况

Figure 6.The expression of Klotho protein in the renal tissues determined by immunohistochemical staining (×200). Mean±SD.n=8.*P<0.05vsgroup C;#P<0.05vsgroup D.
图6 免疫组化检测肾组织Klotho蛋白的表达情况
6 指标相关性分析
Klotho与纤维化面积、TGF-β1、Wnt-4及β-catenin均呈负相关(P<0.05)。
讨 论
Wnt/β-catenin信号通路参与DN肾小管上皮间质转化(epithelial-mesenchymal transition,EMT)及肾脏纤维化。研究发现,高糖激活肾小管上皮细胞Wnt/β-catenin信号通路[5-6],引起β-catenin在胞浆及核内聚积,诱导下游基因(Snail、Twist等)的表达,从而促使小管EMT的发生[6]。肾小管EMT是小管间质纤维化的重要机制[7-9]。值得注意的是,Wnt蛋白受体单克隆抗体或β-catenin、Snail抑制剂均能逆转肾小管EMT[5,10]。Wnt-4为Wnt家族的重要一员,主要由肾脏小管间质的成纤维细胞表达。研究发现,Wnt-4在肾小管间质纤维化时表达明显增加,使β-catenin在肌成纤维细胞胞浆聚积,同时影响小管上皮的结构和功能[11]。本实验结果显示,DN大鼠肾组织Wnt-4与β-catenin蛋白表达增加,均高于正常对照组;而经帕立骨化醇干预,肾组织Wnt-4与β-catenin蛋白表达减少;提示帕立骨化醇可通过调控Wnt/β-catenin信号通路的激活,参与DN肾小管EMT介导的肾小管间质纤维化。
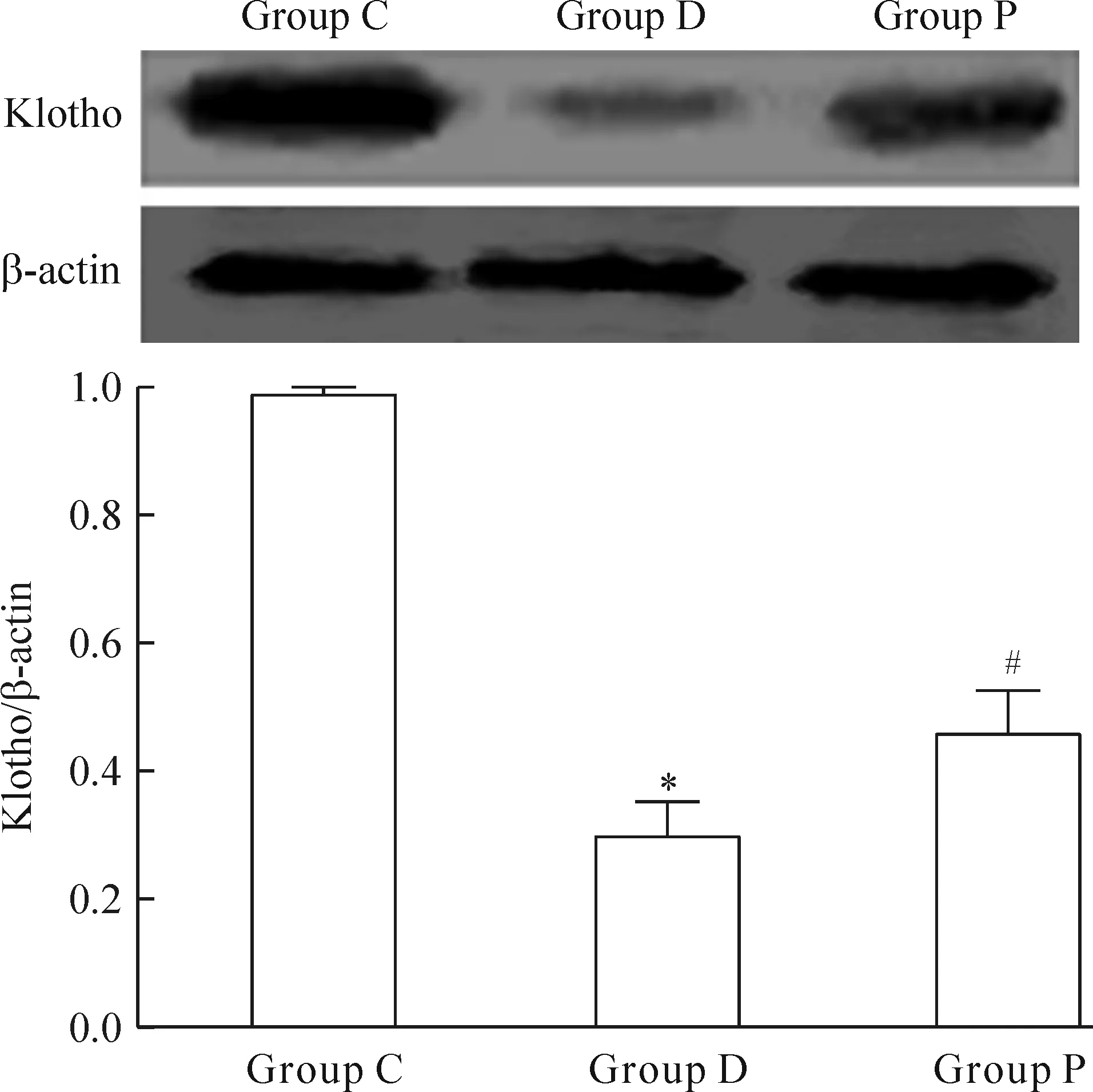
Figure 7.The expression of Klotho protein in the renal tissues determined by Western blotting. Mean±SD.n=8.*P<0.05vsgroup C;#P<0.05vsgroup D.
图7 Western blotting检测肾组织Klotho蛋白的表达情况
TGF-β1在纤维化肾组织呈高表达,可激活Wnt/β-catenin信号通路,介导肾小管EMT及肾脏纤维化。研究显示,TGF-β可通过p38依赖途径直接激活Wnt/β-catenin信号通路,并下调Wnt受体拮抗剂DKK-1的表达水平[12]。此外,DN中Wnt/β-catenin信号通路与TGF-β信号途径存在交联作用,而β-catenin可能是信号交联的重要枢纽。研究表明,抑制Wnt下游基因β-catenin可阻断高糖诱导的近端肾小管EMT[10],其中机制可能与β-catenin作为Smad的辅助因子[13],同时调控Wnt/β-catenin与TGF-β/Smad信号通路相关。因此,靶向调控β-catenin表达可能成为治疗DN肾小管间质纤维化的重要途径。已有研究证实,PPAR-γ激动剂可减少β-catenin的表达,从而抑制高糖诱导的肾小管EMT[10]。本实验结果提示,通过对TGF-β与Wnt信号通路下游交联蛋白β-catenin的调控,成为帕立骨化醇抑制DN肾小管间质纤维化的另一重要机制。
Klotho基因发现于1997年,为一种新型抗衰老基因,功能缺陷可导致衰老综合征。慢性肾脏病早期即可出现Klotho缺乏[14]。Klotho缺乏与肾小管间质纤维化密切相关。研究表明,在单侧输尿管梗阻动物模型中,肾脏Klotho缺乏可加重肾小管间质纤维化,TGF-β1、α-平滑肌肌动蛋白及纤连蛋白表达明显增加,而补充外源性Klotho可抑制此过程[15]。这可能与Klotho直接结合TGF-β1 II型受体从而抑制TGF-β1信号通路的转导有关[15-16]。TGF-β1除了受Klotho水平调控外,本身也可抑制Klotho的表达[15-16]。本实验结果显示,DN肾组织Klotho蛋白表达明显降低,同时伴TGF-β1蛋白表达增加;而予帕立骨化醇干预后,可逆转此结果,提示帕立骨化醇可通过促进肾组织Klotho的表达,抑制TGF-β1蛋白的合成,从而阻断DN肾小管间质纤维化。
此外,Klotho为Wnt信号通路的负调节因子[17-18],其抗肾脏纤维化作用与调控Wnt信号通路的转导紧密相关。Satoh等[19]研究发现,单侧输尿管梗阻小鼠中Klotho低表达可引起肾组织Wnt信号通路激活,促进肾小管间质纤维化。Zhou等[17]在单侧输尿管梗阻与阿霉素肾病小鼠模型中也发现,在肾组织中Klotho水平与Wnt/β-catenin信号通路表达呈负相关。本实验发现,DN肾组织Klotho表达下降伴Wnt-4及β-catenin水平的升高,而帕立骨化醇可逆转Klotho、Wnt-4及β-catenin的表达。可见,通过促进肾小管Klotho的表达,从而抑制Wnt/β-catenin信号通路激活,为帕立骨化醇阻断DN肾小管间质纤维化内在机制之一。
总之,糖尿病肾病中Klotho、Wnt/β-catenin信号通路及TGF-β信号途径相互调控,其中Klotho缺乏介导的Wnt/β-catenin信号通路激活及TGF-β1表达增加,是调控肾小管间质纤维化的重要机制。帕立骨化醇可通过促进肾组织Klotho表达,抑制Wnt/β-catenin信号通路激活及TGF-β1蛋白合成,从而阻断肾小管间质纤维化。但目前帕立骨化醇对肾脏Klotho表达的调控机制尚未阐明,仍需进一步研究。
[1] Tang SC, Leung JC, Lai KN. Diabetic tubulopathy: an emerging entity[J]. Contrib Nephrol, 2011,170:124-134.
[2] Tang SC, Lai KN. The pathogenic role of the renal proximal tubular cell in diabetic nephropathy[J]. Nephrol Dial Transplant, 2012, 27(8):3049-3056.
[3] Tan XY, Li YJ, Liu YH. Paricalcitol attenuates renal interstitial fibrosis in obstructive nephropathy[J]. J Am Soc Nephrol, 2006, 17(12):3382-3393.
[4] 兰 凯,罗 群,周芳芳,等. 帕立骨化醇对糖尿病肾病大鼠蛋白尿的影响[J]. 中华肾脏病杂志, 2012, 28(7):524-527.
[5] Zhou T, He X, Cheng R, et al. Implication of dysregulation of the canonical wingless-type MMTV integration site (WNT) pathway in diabetic nephropathy[J]. Diabetologia, 2012, 55(1):255-266.
[6] Liu Y. New insights into epithelial-mesenchymal transition in kidney fibrosis[J]. J Am Soc Nephrol, 2010, 21(2):212-222.
[7] Ng YY, Huang TP, Yang WC, et al. Tubular epithelial-myofibroblast transdifferentiation in progressive tubulointerstitial fibrosis in 5/6 nephrectomized rats[J]. Kidney Int, 1998, 54(3):864-876.
[8] Iwano M, Plieth D, Danoff TM, et al. Evidence that fibroblasts derive from epithelium during tissue fibrosis[J]. J Clin Invest, 2002, 110(3):341-350.
[9] 王来亮,罗 群. 肾小管上皮间充质转化与肾脏纤维化[J]. 中国病理生理杂志, 2014, 30(10):1910-1914, 1920.
[10]Lee YJ, Han HJ. Troglitazone ameliorates high glucose-induced EMT and dysfunction of SGLTs through PI3K/Akt, GSK-3β, Snail1, and β-catenin in renal proximal tubule cells[J]. Am J Physiol Renal Physiol, 2010, 298(5):F1263-F1275.
[11]Surendran K, McCaul SP, Simon TC. A role for Wnt-4 in renal fibrosis[J]. Am J Physiol Renal Physiol, 2002, 282(3):F431- F441.
[12]Akhmetshina A, Palumbo K, Dees C, et al. Activation of canonical Wnt signaling is required for TGF-β-mediated fibrosis[J]. Nat Commun, 2012,3:735.
[13]Tian X, Zhang J, Tan TK, et al. Association of β-catenin with P-Smad3 but not LEF-1 dissociatesinvitroprofibrotic rom anti-inflammatory effects of TGF-β1[J]. J Cell Sci, 2013, 126(Pt 1):67-76.
[14]Hu MC, Shi M, Zhang J, et al. Klotho deficiency causes vascular calcification in chronic kidney disease[J]. J Am Soc Nephrol, 2011, 22(1):124-136.
[15]Sugiura H, Yoshida T, Shiohira S, et al. Reduced Klotho expression level in kidney aggravates renal interstitial fibrosis[J]. Am J Physiol Renal Physiol, 2012, 302(10): F1252-F1264.
[16]Doi S, Zou Y, Togao O, et al. Klotho inhibits transforming growth factor-beta1 (TGF-beta1) signaling and suppresses renal fibrosis and cancer metastasis in mice[J]. J Biol Chem, 2011, 286(10):8655-8665.
[17]Zhou L, Li Y, Zhou D, et al. Loss of Klotho contributes to kidney injury by derepression of Wnt/β-catenin signaling[J]. J Am Soc Nephrol, 2013, 24(5):771-785.
[18]Liu H, Fergusson MM, Castilho RM, et al. Augmented Wnt signaling in a mammalian model of accelerated aging[J]. Science, 2007, 317(5839):803-806.
[19]Satoh M, Nagasu H, Morita Y, et al. Klotho protects against mouse renal fibrosis by inhibiting Wnt signaling[J]. Am J Physiol Renal Physiol, 2012, 303(12):F1641-F1651.
Influence of paricalcitol on renal tubulointerstitial fibrosis in diabetic nephropathy
WANG Lai-liang, LUO Qun, CAI Ke-dan, ZHOU Fang-fang, GAO Yan-hong
(DepartmentofNephrology,NingboNo. 2Hospital,Ningbo315010,China.E-mail:nbluoqun@163.com)
AIM: To investigate the effect of paricalcitol (P) on renal tubulointerstitial fibrosis and the underlying mechanisms in diabetic nephropathy (DN). METHODS: DN rat model was induced by a single intraperitoneal injection of streptozotocin after fasting. The animals were randomly divided into 2 groups: the DN rats in paricalcitol-intervened group (group P) were injected intraperitoneally with paricalcitol dissolved in propylene glycol after the day when the model was induced successfully at a dose of 0.4 μg/kg (3 times a week); the DN rats in DN group (group D) were given isopyknic propylene glycol. Normal control group (group C) was also set up. The samples of blood, urine and renal tissue were collected after intervention of paricalcitol for 12 weeks. The biochemical indexes were measured. The renal tissues were used for pathologic observation and determining the expression of transforming growth factor-β1 (TGF-β1), Wnt-4, β-catenin and Klotho by immunohistochemistry and Western blotting. In addition, the correlation among the above indexes was analyzed. RESULTS: (1) Scr, BUN and 24 h urine protein increased significantly in group D compared with group C, while decreased in group P compared with group D (P<0.05). (2) The area of renal tubulointerstitial fibrosis increased in group D compared with group C, while decreased in group P compared with group D (P<0.05). (3) The expression of Klotho decreased, while the expression of TGF-β1, Wnt-4 and β-catenin increased in group D compared with group C (P<0.05). Compared with group D, the expression of Klotho increased, while the expression of TGF-β1, Wnt-4 and β-catenin decreased in group P (P<0.05). (4) The expression of Klotho was negatively correlated with the fibrosis area, TGF-β1, Wnt-4 and β-catenin (P<0.05). CONCLUSION: Paricalcitol inhibits renal tubulointerstitial fibrosis in DN by promoting the expression of renal Klotho, and inhibiting Wnt/β-catenin signaling pathway activation and TGF-β1 synthesis.
Paricalcitol; Diabetic nephropathy; Renal tubulointerstitial fibrosis; Wnt/β-catenin signaling pathway; Klotho protein
1000- 4718(2015)04- 0719- 06
2014- 11- 10
2015- 01- 14
浙江省医药卫生科研基金资助项目(No. 2012KYB175);宁波市自然科学基金资助项目(No. 2014A610245)
R363
A
10.3969/j.issn.1000- 4718.2015.04.026
△通讯作者 Tel: 0574-83870217; E-mail: nbluoqun@163.com
