GLP-1对非酒精性脂肪肝病大鼠胰岛素抵抗及PKCε的影响*
2015-04-17周小俐李东风徐丽姝
周小俐, 李东风, 徐丽姝△
(1南方医科大学,广东 广州 510515; 2广东省人民医院,广东省医学科学院,广东省老年医学研究所消化科,广东 广州 510080)
GLP-1对非酒精性脂肪肝病大鼠胰岛素抵抗及PKCε的影响*
周小俐1, 李东风2, 徐丽姝2△
(1南方医科大学,广东 广州 510515;2广东省人民医院,广东省医学科学院,广东省老年医学研究所消化科,广东 广州 510080)
目的: 探讨胰高血糖素样肽1(GLP-1)对非酒精性脂肪肝病SD大鼠的治疗作用及可能的机制。方法: 32只SPF级雄性SD大鼠(体重约130 g)随机抽取21只予高脂饮食(88%普通饲料+10%猪油+2%胆固醇),余下11只予普通饲料饮食作为空白对照组;12周后,将高脂饮食大鼠随机分为2组,每组10只:高脂组予高脂饮食并腹腔注射等体积的无菌生理盐水,治疗组予高脂饮食并腹腔注射利拉鲁肽(GLP-1类似物)注射液(0.6 mg·kg-1·d-1)。治疗4周后处死全部大鼠抽取静脉血并取肝脏组织。全自动生化仪检测血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、甘油三酯(TG)、总胆固醇(TC)及葡萄糖(GLU)含量;ELISA法测定血清胰岛素含量。石蜡包埋肝组织做病理切片及HE染色;real-time PCR法测定肝组织蛋白激酶Cε(PKCε)mRNA的表达,Western blot 测定肝组织胞浆PKCε蛋白表达。结果: 与正常对照组相比,高脂组的ALT、AST、TG、TC、胰岛素抵抗指数及肝脂数均明显升高;GLP-1治疗组与高脂组相比ALT、AST、TG、TC、胰岛素抵抗指数及肝脂数均下降,差异有统计学意义(P<0.05); real-time PCR及Western blot结果提示高脂组PKCε mRNA及蛋白表达减少 (P<0.05);GLP-1治疗组PKCε mRNA及蛋白表达增多(P<0.05)。结论: GLP-1类似物可改善非酒精性脂肪肝的脂质代谢及胰岛素抵抗,该过程可能与PKCε有关。
胰高血糖素样肽1; 非酒精性脂肪肝; 胰岛素抵抗; 蛋白激酶Cε
非酒精性脂肪肝(non-alcoholic fatty liver di-sease,NAFLD)是一种以肝脏内甘油三酯(triglyceride,TG)积聚为特征的肝脏疾病,病理组织学光镜下约5%的肝细胞可以看到脂肪样变,或者甘油三酯较正常人高出95%以上[1]。随着人们生活水平的提高,该病发病率逐年上升,在发达国家成年人的发病率约30%,儿童的发病率近10%[2]。 非酒精性脂肪肝的发病机制尚未明确,目前推崇“二次打击学说”即胰岛素抵抗和氧化应激。目前的治疗方法主要以改变生活方式和调整饮食结构及加强运动为主,尚缺乏有效的治疗药物。因此近年非酒精性脂肪肝的发病机制及寻求治疗药物的研究成为热点[3]。蛋白激酶Cε(protein kinase Cε,PKCε)是胰岛素抵抗高度相关的一种蛋白,在胰岛素抵抗发生发展的细胞内信号通路中起着重要的作用。胰高血糖素样肽1(glucagon-like peptide 1,GLP-1)是一种内源性肠促胰岛素激素,能够促进胰腺β细胞葡萄糖浓度依赖性地分泌胰岛素[4]。最近研究发现人肝细胞存在GLP-1受体;在HepG2和Huh7肝细胞株的培养液中加入GLP-1受体兴奋剂后可以减少脂肪的产生[5]。利拉鲁肽是一种GLP-1类似物,与人GLP-1具有97%的序列同源性,人GLP-1可以结合并激活GLP-1 受体。此外,它能够以葡萄糖浓度依赖的模式刺激胰岛素的分泌,同时以葡萄糖浓度依赖的模式降低过高的胰高血糖素的分泌。因此,当血糖升高时,胰岛素分泌受到刺激,同时胰高血糖素分泌受到抑制。与之相反,在低血糖时利拉鲁肽能够减少胰岛素分泌,且不影响胰高糖素的分泌。那么利拉鲁肽能否有望成为NAFLD的一种治疗药物呢?本研究通过利拉鲁肽干预NAFLD大鼠模型,来探讨GLP-1对NAFLD大鼠脂质代谢、肝功能、胰岛素抵抗等的影响,并进一步探讨其对PKCε的影响。
材 料 和 方 法
1 动物与试剂
32只SPF级雄性SD大鼠体重为(120±10)g,购自中山大学实验动物中心,实验动物合格证编号为44008500003375,动物实验得到伦理委员会批准;高脂饲料购自广东省动物实验中心,配方为88%普通饲料+10%猪油+2%胆固醇;动物实验场所为中山大学北校区实验动物中心,实验合格证编号为00061632。
GLP-1(商品名为利拉鲁肽)购自丹麦诺和德公司; 葡萄糖测定试剂盒、甘油三酯测定试剂盒和胆固醇试剂盒购自北京中生北控生物科技有限公司;胰岛素测定试剂盒购自上海依科赛生物科技有限公司;逆转录试剂盒、荧光染料均购自Thermo;细胞浆蛋白抽提液购自凯基生物技术有限公司; PKCε的 I 抗购自Abcam;II 抗购自北京博森生物科技有限公司;其它常用试剂均由广东省人民医院医学实验中心提供。
2 方法
2.1 高脂饮食诱导SD大鼠形成NAFLD模型的判断标准[6]高脂喂养12周后,随机抽取2只处死,检测到血清TG、总胆固醇(total cholesterol,TC)、谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)异常升高,肝组织HE染色有大量脂滴形成者可认为NAFLD造模成功。
2.2 动物喂养、造模及病变观察 32只雄性SD大鼠适应性喂养1周后,随机分为2组,标准普通饲料喂养11只,高脂饲料喂养21只,各组均自由饮水。第12周末2组分别随机抽取1只大鼠,禁食12 h后,水合氯醛麻醉后抽取静脉血5 mL用来检测血清TC、TG、AST、ALT、空腹血糖(fasting plasma glucose,FPG)。动物处死后取出肝脏做病理切片,HE染色观察肝组织脂肪变情况。
2.3 实验分组及干预 第13周开始,标准饲料喂养组10只作为正常对照(normal control,NC)组,高脂饮食的20只大鼠随机分为2组,其中一组为高饮食(high-fat diet,HFD)组,另一组为GLP-1干预(HFD+GLP-1)组。各组分别按下述进行干预:NC组10只,标准饲料喂养+生理盐水0.6 mg·kg-1·d-1腹腔注射,时长4周;HFD组10只,高脂饲料喂养+生理盐水0.6 mg·kg-1·d-1腹腔注射, 时长4周;HFD+GLP-1干预组10只,高脂饲料喂养+利拉鲁肽注射液0.6 mg·kg-1·d-1,时长4周。干预期间注意观察大鼠的毛发改变,食欲、大小便、活动、体重等变化情况,根据体重及大鼠的体质调整药物剂量。
2.4 标本采集 在干预4周后,禁食12 h。称取体重,10%水合氯醛3.5 mL/kg腹腔注射进行麻醉,腹主静脉抽取10 mL静脉血置4 ℃ 30 min,3 500 r/min离心15 min后取上层血清至1.5 mL EP管中并做好标记,-80 ℃保存待测生化指标及胰岛素。快速完整剥离肝组织,生理盐水漂洗血液,滤纸吸干后称量体重并做好记录;取肝左叶内侧大小约1.0 cm×0.5 cm肝组织各1块,10%中性甲醛固定用于石蜡包埋切片,HE染色。肝右叶同等部位取多块肝组织,重约0.5 g~1.0 g放入1.5 mL EP管中标记好放入液氮罐速冻后转移至-80 ℃冰箱,用于real-time PCR及Western blot检测。
2.5 生化指标检测 用全自动生化仪检测血清TG、TC、FPG、AST、ALT。
(3)焊接变形控制 高强度厚板的焊接变形后期矫正很困难,因此采取合理的焊接工艺是控制小直径钢管焊接变形的关键。
2.6 血清胰岛素测定 ELISA法检测血清空腹胰岛素(fasting insulin,FIN)。计算胰岛素抵抗指数(insulin resistance index,HOMA-IR)。计算公式为: HOMA-IR=(FPG×FIN)/22.5(FPG 单位为mmol/L;FIN 单位为mIU/L)。
2.7 肝组织石蜡包埋切片和HE染色普通光镜下观察肝脏形态 取大小约0.5 cm×0.5 cm×0.5 cm 的肝组织,用10%中性甲醛固定24 h,石蜡包埋、切片,HE染色,光镜下观察肝脏形态学的改变对脂肪变性进行评估。
2.8 提取肝组织RNA,real-time PCR检测PKCε mRNA表达 取50~100 mg肝组织研钵中液氮下磨成粉末状转移至无酶EP管中,加入1 mL TRIzol吹打混匀,冰上静置10 min,加入0.2 mL氯仿,剧烈振荡15 s,静置3 min,4 ℃ 1 200×g离心15 min;取上清加入等体积异丙醇,静置5 min,4 ℃ 1 200×g离心15 min;弃上清加入1 mL 75%乙醇充分洗涤沉淀后,4 ℃ 1 200×g离心8 min;室温干燥,加入30~70 μL DEPC水溶解沉淀。RNA浓度测定后进行逆转录,real-time PCR检测PKCε mRNA 表达。PKCε上游引物序列为5’-GAGGTCATCTGCTCTCATGTTTA-3’,下游引物序列为5’-TCCTTGCACATCCCAAAGTCA-3’。以GAPDH为内参照。PCR循环参数为95 ℃ 1 min;随后95 ℃ 5 s,55 ℃ 15 s,72 ℃ 5 s,共45个循环;95 ℃ 60 s,50 ℃ 30 s,60 ℃,30 s。每个样本重复3次,每次包括3个不加cDNA模板的阴性对照和只加DEPC水的空白对照。取Ct平均值,采用相对定量法分析结果,以2-ΔΔCt方法判定HFD组及GLP-1干预组相对于空白对照组肝组织中PKCε基因的相对表达倍数。Ct代表目标扩增产物达到设定阈值所经历的循环数,ΔΔCt=(CtPKCε-CtGAPDH)处理组-(CtPKCε-CtGAPDH)对照组。
2.9 细胞浆蛋白抽提及Western blotting检测PKCε蛋白的表达 取适量肝组织液氮下研磨成粉末,加入1 mL浆蛋白抽提液冰上裂解1 h。4 ℃ 14 000×g离心30 min取上清。BCA法测定蛋白浓度,按上样量50 μg进行SDS-PAGE,60 V恒压30 min,110 V恒压60 min。采用湿转法进行转膜(250 mA,150 min);5%脱脂奶进行封闭2 h;I 抗(1∶500)4 ℃孵育大于12 h,II 抗(羊抗兔1∶3 000)室温孵育1 h,ECL液进行曝光。
3 统计学处理
数据以均数±标准差(mean±SD)表示,采用SPSS 13.0 统计软件进行正态性、方差齐性检验,若资料符合正态性、方差齐,采用完全随机设计的方差分析;方差不齐时采用近似F检验的Welch法;多重比较用LSD法;以P<0.05为差异有统计学意义。
结 果
高脂饮食第12周,普通饲料饮食组及高脂饮食组各随机处死1只,HFD组大鼠肝病理检查有明显脂肪变性。干预过程中正常对照组活动度好,饮食正常,皮毛整洁。HFD组活动减少,饮食增多,毛发凌乱黄腻。GLP-1干预组大鼠的一般情况与正常对照组相似。
2 各组大鼠体质量、肝重量、肝指数的改变
与正常对照组比,HFD组的肝指数明显升高(P<0.05);与HFD组相比,给药4周后,GLP-1干预组的肝指数显著降低(P<0.05),见表1。

表1 各组体质量、肝质量、肝指数
*P<0.05vsNC group;#P<0.05vsHFD group.
3 各组血清脂质及肝功能的改变
与正常对照组比,HFD组血清的TG、TC、ALT和AST明显升高(P<0.05);与HFD组比,给药4周后,GLP-1干预组血清的TG、TC、ALT和AST均明显减低(P<0.05),见表2。
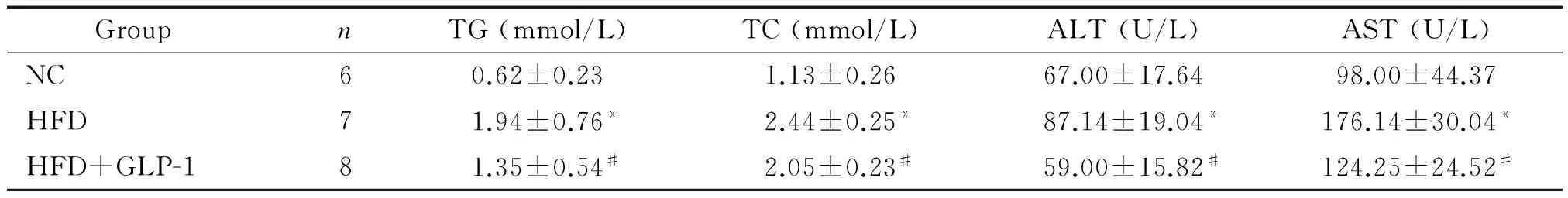
表2 各组血清脂质与肝功能
*P<0.05vsNC group;#P<0.05vsHFD group.
4 各组血糖、胰岛素、HOMA-IR的变化
与正常对照组比,HFD组的胰岛素、HOMA-IR均明显升高(P<0.05);与HFD组比,给药4周后,GLP-1干预组的胰岛素、HOMA-IR均降低(P<0.05),见表3。

表3 各组血糖、胰岛素变化
*P<0.05vsNC group;#P<0.05vsHFD group.
5 各组病理变化情况
HE染色观察各组病理变化。正常对照组大鼠的肝脏组织结构正常,肝小叶结构明显,肝细胞索呈放射状排列,肝细胞无变性。HFD组的肝细胞弥漫小泡性脂肪空泡变性、重度水样变性,细胞核被挤压变形部分消失,肝索紊乱,肝窦狭窄或消失,但未见明显炎症、纤维化、坏死等病灶。GLP-1干预组的肝脏组织可见脂肪变性和水样变性,程度较HFD组明显减轻,见图1。
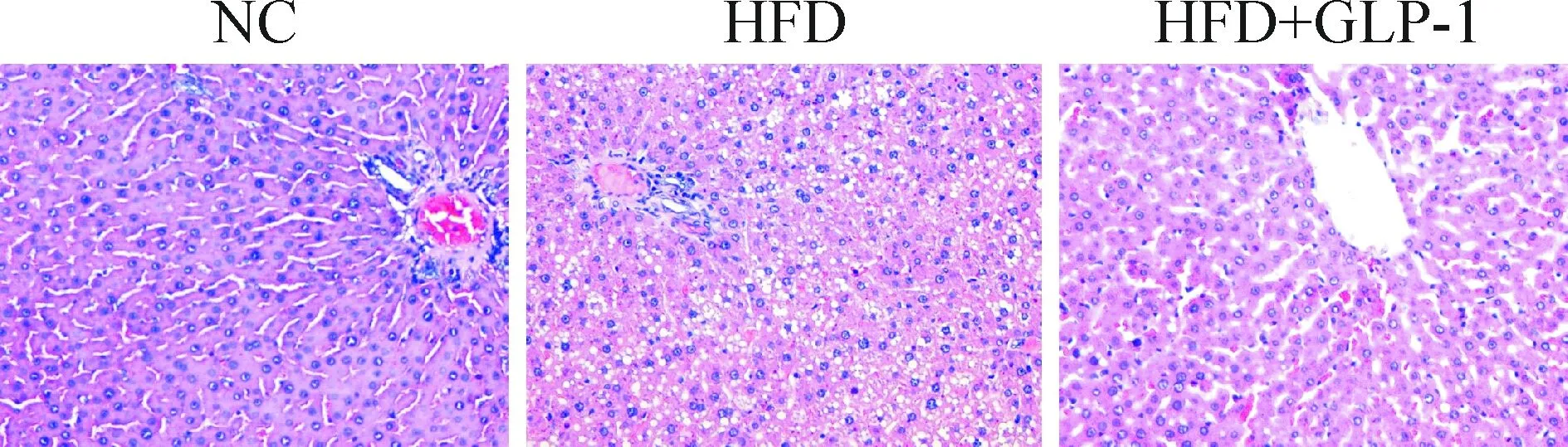
Figure 1.HE staining of the liver tissues (×200).
图1 各组肝组织HE染色观察
6 各组PKCε mRNA的表达
Real-time PCR结果可见PKCε mRNA HFD组较正常对照组表达下降(P<0.05),而GLP-1干预组较HFD组表达升高(P<0.05),见图2。
7 各组PKCε蛋白的表达
Western blot结果可见PKCε蛋白HFD组较正常对照组表达下降,而GLP-1干预组较模型对照组表达升高,见图3。
讨 论
非酒精性脂肪肝发病机制复杂,目前较为经典的机制是“二次打击学说”,即肝脏胰岛素抵抗和氧化应激[2]。在NAFLD的病程进展中,胰岛素抵抗扮

Figure 2.The mRNA expression of PKCε in the liver tissues detected by real-time PCR. Mean±SD.n=8.*P<0.05vsNC group;#P<0.05vsHFD group.
图2 Real-time PCR 检测肝脏组织PKCε mRNA表达
演着重要的角色,研究表明在高脂饮食的大鼠模型中产生了胰岛素抵抗,同时肝脏也存在胰岛素抵抗[7],长期高脂饮食大鼠甚至还存在胰岛炎症[7-8]。当营养输入过多时,肝脏中脂质积聚,异位脂质的积聚可引起NAFLD的病理生理进展及胰岛素抵抗[9]。PKCε是PKC家族的一种亚型,通常PKC在肝脏中的表达较低,但是PKCε在肝脏中的表达较高,研究已经表明在非酒精性脂肪肝中PKCε可被激活,主要表现为PKCε由胞浆转位至包膜上呈现表达下降,在啮齿类动物模型实验中已经证实PKCε与肝脏胰岛素抵抗密切相关[10]。当PKCε相关基因下调时,胰岛素抵抗可被抑制。人体及NAFLD动物模型均表明肝脏内脂质、二酰甘油(diacylglycerol,DAG )的积聚可活化PKCε从而引起肝脏的胰岛素抵抗。此外,近期研究还发现肝细胞内过多的DAG是促成肝脏胰岛素抵抗的关键性因素,DAG激活PKCε可能是NAFLD相关胰岛素抵抗的重要途径[11]。PKCε的激活主要是通过该蛋白的膜转位实现的,当PKCε由胞浆转移到胞膜时其活性增加。研究证明非酒精性脂肪肝病动物模型肝组织中PKCε的活性增加,表现为PKCε膜转位增加[10]。因此,如果药物可以抑制PKCε的活性,则对非酒精性脂肪肝的胰岛素抵抗可有一定的改善作用。

Figure 3.The protein expression of PKCε in the liver tissues detected by Western blot. Mean±SD.n=8.*P<0.05vsNC group;#P<0.05vsHFD group.
图3 Western blot 检测肝脏组织胞浆中PKCε的蛋白表达
GLP-1已广泛用于2型糖尿病的治疗,在小鼠模型中可降低转氨酶水平和甘油三酯的积聚并改善胰岛素抵抗[12]。前期研究已证明利拉鲁肽不仅可改善非酒精性脂肪肝大鼠模型的氧化应激水平和降低TNF-α及TGF-β1炎症因子水平[13],还能改善胰岛素抵抗[14]。本实验利用GLP-1类似物利拉鲁肽腹腔注射治疗NAFLD SD大鼠模型4周后,可以使转氨酶水平下降;同时甘油三酯及总胆固醇水平下降;病理组织染色也提示肝脂肪变性明显改善;HFD组胰岛素水平明显高于GLP-1治疗组的胰岛素水平;这是由于GLP-1的作用机制是通过葡萄糖依赖性的调节来刺激胰岛β细胞释放胰岛素,当血糖水平较低时其刺激作用消失,这在治疗NAFLD时恰恰是种优势,不会出现低血糖的不良反应。同时HFD组中肝组织PKCε的活性增强,和文献报道相一致,GLP-1治疗组的PKCε活性下降,表明该药物可以影响胰岛素抵抗的相关信号通路从而阻止了胰岛素抵抗的进展,增强了胰岛素的敏感性。
[1] Stefan N, Haring HU. The metabolically benign and malignant fatty liver[J]. Diabetes, 2011, 60(8):2011-2017.
[2] Cohen JC, Horton JD, Hobbs HH. Human fatty liver disease: old questions and new insights[J]. Science, 2011, 332(6037):1519-1523.
[3] Malinowski SS, Byrd JS, Bell AM, et al. Pharmacologic therapy for nonalcoholic fatty liver disease in adults[J]. Pharmacotherapy, 2013, 33(2):223-242.
[4] Sharma S, Mells JE, Fu PP, et al. GLP-1 analogs reduce hepatocyte steatosis and improve survival by enhancing the unfolded protein response and promoting macroautophagy[J]. PLoS One, 2011, 6(9):e25269.
[5] Svegliati-Baroni G, Saccomanno S, Rychlicki C, et al. Glucagon-like peptide-1 receptor activation stimulates hepatic lipid oxidation and restores hepatic signalling alteration induced by a high-fat diet in nonalcoholic steatohepatitis[J]. Liver Int, 2011, 31(9):1285-1297.
[6] 潘 勤,范建高. 高脂饮食诱导非酒精性脂肪性肝病动物模型的研究进展[J]. 国际消化病杂志, 2009, 29(4):255-257.
[7] 李兰芳,郭 玉,唐国涛,等. 高脂饮食导致大鼠肝脏胰岛素抵抗的作用机制研究[J].中国病理生理杂志, 2011, 27(2):310-314.
[8] 李 新,袁 莉,李 进,等. 长期高脂喂养大鼠胰岛功能改变与胰岛炎症反应有关[J]. 中国病理生理杂志, 2009, 25(5):949-954.
[9] Birkenfeld AL, Shulman GI. Nonalcoholic fatty liver disease, hepatic insulin resistance, and type 2 diabetes[J]. Hepatology, 2014, 59(2):713-723.
[10]Samuel VT, Liu ZX, Qu X, et al. Mechanism of hepatic insulin resistance in non-alcoholic fatty liver disease[J]. J Biol Chem, 2004, 279(31):32345-32353.
[11]Samuel VT, Petersen KF, Shulman GI. Lipid-induced insulin resistance: unravelling the mechanism[J]. Lancet, 2010, 375(9733):2267-2277.
[12]Gupta NA, Mells J, Dunham RM, et al. Glucagon-like peptide-1 receptor is present on human hepatocytes and has a direct role in decreasing hepatic steatosisinvitroby modulating elements of the insulin signaling pathway[J]. Hepatology, 2010, 51(5):1584-1592.
[13]高慧亭,徐丽姝,李东风,等. GLP-1对非酒精性脂肪肝大鼠肝氧化应激及TNF-α、TGF-β1的影响[J]. 南方医科大学学报, 2013, 33(11):1661-1664.
[14]曾志刚,徐丽姝,关丽嫦,等. 利拉鲁肽对非酒精性脂肪肝大鼠脂联素及胰岛素抵抗的影响[J]. 中国病理生理杂志, 2014, 30(3):533-537.
Effect of GLP-1 on insulin resistance and PKCε in rats with nonalcoholic fatty liver disease induced by high fat diet
ZHOU Xiao-li1, LI Dong-feng2, XU Li-shu2
(SouthernMedicalUniversity,Guangzhou510515,China;2DepartmentofGastroenterology,GuangdongAcademyofMedicalSciences,GuangdongGeneralHospital,GuangdongProvincialInstituteofGeriatrics,Guangzhou510080,China.E-mail:xulishu70@163.com)
AIM: To observe the therapeutic effect of glucagon-like peptide 1 (GLP-1) analog on nonalcoholic fatty liver disease of rats and to investigate the underlying mechanism. METHODS: SD rats (n=21) were used to establish a nonalcoholic fatty liver disease model by feeding a high fat diet for 12 weeks, and other 11 rats were fed with a normal diet for 16 weeks. The model rats were randomly divided into 2 equal groups: one group was treated with glucagon-like peptide 1 analog (0.6 mg·kg-1·d-1) by intraperitoneal injection for 4 weeks, the other group using saline as a control. After treatment, fasting blood glucose, serum insulin, blood lipids, liver function and the pathological changes of the hepatic tissues were evaluated and the expression of PKCε at mRNA and protein levels in the liver tissues was detected by real-time PCR and Western blot, respectively. RESULTS: Compared with model group, the intervention of GLP-1 significantly reduced insulin resistance index (HOMA-IR), improved the liver function (P<0.05), decreased the liver index and blood lipids (P<0.05). HE staining showed obvious pathological changes of the hepatic tissues in model group, and the intervention of GLP-1 significantly reduced lipid droplets in the hepatocytes and improved the structural damage of the liver. The expression of hepatic protein kinase Cε (PKCε) at mRNA and protein levels significantly decreased which were reversed by treating with GLP-1. CONCLUSION: GLP-1 shows good therapeutic effect on nonalcoholic fatty liver disease of rats, possibly by controlling lipid metabolism and reducing insulin resistance, which may be related to PKCε expression.
Glucagon-like peptide 1; Non-alcoholic fatty liver disease; Insulin resistance; Protein kinase Cε
1000- 4718(2015)04- 0690- 05
2014- 12- 18
2015- 03- 11
广东省自然科学基金资助项目(No. S2012010010953)
R363.2
A
10.3969/j.issn.1000- 4718.2015.04.021
△通讯作者 Tel: 020-83827812; E-mail: xulishu70@163.com
