经bcl-2基因修饰的骨髓间充质干细胞移植对缺血性心功能不全兔心功能及血管新生的影响
2015-04-17李树仁荀丽颖苑可心谢悦陶张倩辉郝清卿齐晓勇
高 青, 李树仁, 荀丽颖, 苑可心, 谢悦陶, 张倩辉, 郝清卿, 党 懿, 齐晓勇
(1河北医科大学研究生学院, 2河北省人民医院心内一科,河北 石家庄 050051)
经bcl-2基因修饰的骨髓间充质干细胞移植对缺血性心功能不全兔心功能及血管新生的影响
高 青1, 李树仁2△, 荀丽颖2, 苑可心2, 谢悦陶2, 张倩辉2, 郝清卿2, 党 懿2, 齐晓勇2
(1河北医科大学研究生学院,2河北省人民医院心内一科,河北 石家庄 050051)
目的: 探讨经bcl-2基因修饰的骨髓间充质干细胞(BMSCs)移植对急性心肌梗死家兔心肌细胞凋亡、血管再生及心功能的影响。方法: 体外分离、培养、纯化兔BMSCs,分别转染腺病毒及重组腺病毒-Bcl-2。结扎兔冠状动脉前降支制作心肌梗死(MI)模型,2周后于心梗边缘区分别注射等量的腺病毒-Bcl-2-BMSCs(MI+Bcl-2-BMSCs组)、腺病毒-BMSCs(MI+BMSCs组)及DMEM液(MI组)。细胞移植4周后经超声测定心功能;荧光显微镜观察BMSCs的存活及分布;TUNEL法检测心肌细胞凋亡;real-time PCR检测VEGF mRNA表达;免疫组化染色法检测CD31表达,计算新生毛细血管密度。以上数据分别与心功能进行相关性分析。结果: 与MI组相比,MI+Bcl-2-BMSCs组和MI+BMSCs组的心功能改善、细胞凋亡率降低、VEGF mRNA表达增多、毛细血管密度增加,其中MI+Bcl-2-BMSCs组的变化更为显著(P<0.05)。相关性分析显示左室射血分数与心肌细胞凋亡率呈负相关;与VEGF mRNA的表达量及毛细血管密度呈正相关(P<0.01)。结论: 经bcl-2基因修饰的BMSCs移植可显著减少缺血性心功能不全兔心肌细胞凋亡、促进血管再生、改善心功能。
骨髓间充质干细胞; 基因治疗; 心肌梗死;bcl-2基因
急性心肌梗死是一种严重危害人类身体健康的疾病。心肌梗死(myocardial infarction,MI)导致局部心肌组织发生不可逆的生物学变化,如心肌细胞坏死、凋亡,成纤维细胞增生,胶原蛋白过量堆积,心肌间质纤维化等,最终引起心室重构和缺血性心力衰竭的发生[1]。心肌梗死后有效的细胞替代及血运重建对保护心脏功能,改善远期预后起关键作用。近年来有研究发现骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)可促进缺血心肌的功能恢复及改善左室重构[2],因此成为细胞移植治疗心肌梗死的常用干细胞类型之一。然而移植细胞在缺血缺氧心肌微环境中常发生大量的凋亡,严重影响干细胞疗效。bcl-2作为一种抗凋亡基因,可从多个水平抑制细胞凋亡的发生。本研究探讨采用bcl-2基因修饰的骨髓间充质干细胞移植对急性心肌梗死家兔心肌细胞凋亡、血管再生、心功能的影响。
材 料 和 方 法
1 实验动物
本实验动物选用健康3月龄新西兰雄兔共30只,体重约2.5~3.0 kg,由河北医科大学实验动物中心提供。其中2只作为骨髓间充质干细胞的供体,28只作为移植的受体。
2 主要实验试剂及仪器
含增强型绿色荧光蛋白(EGFP)报告基因及bcl-2基因的腺病毒载体(Ad-EGFP-Bcl-2)、含EGFP基因的腺病毒载体(Ad-EGFP)(本课题组前期构建留存);TUNEL细胞凋亡检测试剂盒(Roche);小鼠抗兔CD31单抗、山羊抗小鼠IgG II 抗试剂盒(Abcam);Percoll 细胞分离液(Pharmacia);低糖型DMEM(HyClone);DAPI(Sigma);TRIzol Reagent(Invitrogen);反转录试剂盒(Promega);荧光定量PCR试剂盒(BBI);随机引物(Promega);PCR引物(上海生工生物工程有限公司);心脏超声仪(Vivid I);7300 实时定量 PCR 仪(ABI);荧光倒置相差显微镜(Leica)。
3 方法
3.1 BMSCs的分离、培养、纯化 无菌条件下用骨穿针抽取兔股骨及胫骨处骨髓液共4~5 mL,与肝素混匀,1.073 kg/L Percoll 细胞分离液密度梯度离心+贴壁培养法分离、纯化BMSCs,加入含10%胎牛血清的DMEM培养基中,于37 ℃、5% CO2条件下培养。待细胞生长至80%融合时用0.25%的胰酶消化,按1∶2比例传代培养[3]。于倒置相差显微镜下逐日观察细胞生长情况和形态特征。
3.2 重组腺病毒载体的构建 重组腺病毒Ad-EGFP-Bcl-2、Ad-EGFP均由本课题组前期构建留存[4],经反转录聚合酶链式反应检测目的基因的表达,测序鉴定目的基因片段正确性。病毒扩增后置于-80 ℃保存(病毒滴度为T=2.5×1013PFU/L)。
3.3 重组腺病毒载体转染BMSCs 取生长状态良好的第9代BMSCs,消化后以3×108/L的细胞密度接种于培养瓶中,置于37 ℃、5% CO2、饱和湿度培养箱中培养24 h后弃细胞培养基,PBS冲洗3次,于培养瓶中加入无血清培养基1 mL,再加入含Ad-EGFP-Bcl-2或Ad-EGFP的病毒液(MOI=500)转染BMSCs,转染2 h内每隔15 min摇晃1次。2 h后弃转染的病毒液,以PBS冲洗后加入含10% 胎牛血清的培养基继续培养。细胞转染72 h后经荧光显微镜观察转染效率,测定最佳转染复数(MOI)。
3.4 实验动物分组及造模 将28只健康新西兰家兔按随机数字表法随机分为MI+Bcl-2-BMSCs组(n=9)、MI+BMSCs组(n=10)和MI组(n=9)。采用开胸结扎兔冠状动脉前降支的方法制作急性心肌梗死后心功能不全模型。将家兔仰卧固定于手术台上,连接针形电极至皮下1 cm,记录心电图检查结果。常规消毒、铺巾,3%戊巴比妥钠静脉麻醉(1 mL/kg)。剪开胸部左侧皮肤,钝性分离皮下组织及肌肉至肋骨。沿胸骨左缘切断第3、4、5肋骨,放置开胸器暴露并打开心包,暴露左冠状动脉前降支,于第1对角支近端处用丝线结扎前降支(建模成功标准为心尖部及部分左室前壁心肌由红色变为暗紫色,局部心肌收缩力减弱,心电图检查示ST段呈持续弓背向上性抬高[5-6]),最后逐层关胸。
3.5 细胞移植 造模2周后,收集1×107个细胞用DMEM浓缩至1 mL。再次开胸开通结扎的冠状动脉,选取心肌梗死边缘区域4个注射点,采用心肌注射的方法各组分别注射细胞悬液Ad-EGFP-Bcl-2-BMSCs(MI+Bcl-2-BMSCs组)和 Ad-EGFP-BMSCs(MI+BMSCs组)及DMEM液(MI组)(每点各注射0.25 mL)。术后3 d每天肌注青霉素8×105U预防感染。
3.6 超声影像技术检测心功能 采用Vivid I心脏超声仪在术前、术后2周及细胞移植后4周由同一专科医生行超声心动图检测,测量各组左室射血分数(left ventricle ejection fraction,LVEF)及左室短轴缩短率(left ventricle fractional shortening,LVFS),所有测量值均取3次测量的平均值。
3.7 免疫组化法染色并计算新生毛细血管密度 细胞移植4周后处死动物,剪开心包膜,暴露心脏,迅速取下心脏,冰生理盐水冲洗,切取梗死边缘区心肌组织,置于-80 ℃冰箱内保存备用。将留取的心肌组织制成 6 μm厚冰冻切片,荧光显微镜观察移植细胞存活情况。剩余心肌组织,用4%多聚甲醛液固定,常规石蜡包埋后制成厚约5 μm的切片,HE染色后光镜观察组织学形态变化。采用卵白素-生物素-过氧化物酶复合物(ABC)法,对血管内皮细胞标记抗体CD31进行染色。石蜡切片脱蜡至水,经热修复、3% H2O2去离子水孵育和山羊血清封闭后,滴加小鼠抗兔CD31 I 抗(1∶50)4 ℃过夜。室温下分别滴加山羊抗小鼠IgG II抗及辣根酶标记链酶卵白素(S-A/HRP)孵育。DAB显色,常规复染、脱水、中性树胶封片。阳性血管内皮细胞的胞质经染色呈棕褐色,根据染色结果于显微镜下观察并计数各组毛细血管数目,每张切片选5个梗死边缘区心肌组织中血管密度最高处,取平均单个视野(×100)血管数为毛细血管密度。将所得的新生毛细血管密度与LVEF进行相关性分析。
3.8 原位缺口末端标记法(TdT-mediated dUTP nick end labeling,TUNEL)检测心肌凋亡细胞 按照TUNEL细胞凋亡检测试剂盒说明书进行操作,并设阴性对照组 (TUNEL 反应液中不加 TdT)。光镜下可观察到正常心肌细胞核染成蓝色,凋亡心肌细胞核染成棕褐色。凋亡率的计算:随机选取梗死边缘区心肌组织中5个非重叠视野(×200),计数凋亡心肌细胞数和心肌细胞总数,心肌细胞凋亡率(%)=凋亡心肌细胞数/心肌细胞总数×100 % 。将所得的心肌细胞凋亡率与LVEF进行相关性分析。
3.9 Real-time PCR法检测心肌组织血管内皮生长因子(vascular endothelial growth factor, VEGF) mRNA的表达 取50 mg心梗边缘区心肌组织进行研磨,提取总RNA,琼脂糖凝胶检测其完整性;按反转录试剂盒说明书进行反转录,反应条件:42 ℃ 50 min,95 ℃ 5 min。引物序列: GAPDH的上游引物为5’-CAAGAAGGTGGTGAAGCAGG-3’,下游引物为5’-CACTGTTGAAGTCGCAGGAG-3’,扩增产物为 92 bp[5-6];VEGF的上游引物为5’-GTGGACATCTTCCAGGAGTACC-3’, 下游引物为5’-GATCCGCATGATCTGCATGGTG-3’,扩增产物为153 bp。将获得的cDNA按照荧光定量PCR试剂盒操作说明书方法扩增目的基因,PCR热循环参数为96 ℃ 4 min,然后3步反应:94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,40 个循环。以 GAPDH 为内参照,将目的基因表达的相对定量值用于统计分析。Real-time PCR 采用2-ΔΔCt(ΔCt=目的基因 Ct值-GAPDH Ct值,ΔΔCt=目的基因ΔCt 值-内参照基因ΔCt 值)法统计分析结果[7]。将所得的VEGF mRNA的表达量与LVEF进行相关性分析。
4 统计学处理
采用SPSS 17.0统计学软件分析结果。实验结果中计量资料以均数±标准差(mean±SD)表示,采用完全随机设计单因素方差分析(one-way ANVOVA),多个样本均数间的两两比较采用SNK-q检验。计数资料应用χ2检验,相关变量间采用直线相关分析,以P<0.05 为差异有统计学意义。
结 果
1 BMSCs的形态观察
骨髓液经Percoll分离液密度梯度离心后,取白色絮状物层接种于培养瓶,24~48 h后观察到散在贴壁的纺锤状BMSCs,7~10 d时BMSCs呈长梭状,部分呈三角或多角形,细胞间形成突起,胞核居中,细胞排列疏松。18~21 d可见形态规则的单层融合束状贴壁细胞,排列紧密呈漩涡状、放射状。采用胰蛋白酶消化融合的BMSCs,以1∶2比例进行传代培养,24 h后细胞完全贴壁,3~5 d后即达80%融合。传至第10代时细胞生长速度减慢。
2 荧光显微镜观察转染细胞
病毒转染24~48 h后,于荧光显微镜下观察到带有EGFP标记的BMSCs,细胞排列整齐,形态均一,呈长梭状,经预实验测定MOI值为500时转染效率最佳。
3 心肌梗死后心功能不全造模的结果
28只新西兰雄兔接受造模手术,术后共有24只存活,其中MI+Bcl-2-BMSCs组存活8只,死亡1只;MI+BMSCs组存活8只,死亡2只;MI组存活8只,死亡1只。共死亡4只,其中,2只于结扎前降支过程中因诱发室颤死亡,1只造模后因呼吸骤停死亡,1只于2次开胸细胞移植后48 h死亡。
4 心脏超声影像学的检查结果
造模前将各组新西兰雄兔行心脏超声影像学检查,各组兔心功能指标均正常,并于造模后2周(即移植前)及细胞移植后4周,再次行超声检查。
经统计学处理发现,术前及术后2周各组间LVEF、LVFS均无明显差异(P>0.05);BMSCs 移植后4周,MI+Bcl-BMSCs组和MI+BMSCs组的LVEF值及LVFS值与MI组相比均升高, 其中MI+Bcl-2-BMSCs组的LVEF值、LVFS值又明显高于MI+BMSCs组及MI组;并且细胞移植4周后,MI+Bcl-2-BMSCs组和MI+BMSCs组的LVEF值及LVFS值均较移植前升高,其中以MI+Bcl-2-BMSCs组的LVEF值及LVFS值升高的更为显著,差异有统计学意义(P<0.05),见图1。

Figure 1.The comparison of LVEF and LVFS in different groups 4 weeks after transplantation. Mean±SD.n=8.*P<0.05vsMI;#P<0.05vsMI+BMSCs.
图1 移植后4周各组LVEF及LVFS的比较
5 荧光显微镜下观察移植细胞的存活
细胞移植后4周,处死实验动物,切取梗死边缘
区心肌组织,制作冰冻切片,于荧光显微镜下观察,MI+Bcl-2-BMSCs组与MI+BMSCs组可见带有EGFP标记的移植BMSCs,并且MI+Bcl-2-BMSCs组EGFP表达高于MI+BMSCs组, MI组未见到绿色荧光,见图2。
6 病理学检查
切取正常及梗死边缘区心肌组织,经石蜡包埋、切片、HE染色后,于光镜下观察,可见正常心肌细胞形态均一、排列整齐。细胞质染色均匀,成淡蓝色,胞核大小一致,呈椭圆形或圆形,居胞质中央。梗死区域的心肌细胞排列紊乱,心肌纤维断裂,细胞间可见炎症细胞浸润。各组梗死边缘区心肌组织与正常心肌组织比较可发现: MI+Bcl-2-BMSCs组病理学改变较轻微,MI+BMSCs组其次,MI组较严重。

Figure 2.BMSCs labeled with enhanced green fluorescent protein (EGFP) in infarction marginal zone (×40). EGFP expression is indicated by red arrows.
图2 梗死边缘区心肌组织中增强型绿色荧光蛋白标记的BMSCs
7 细胞凋亡及其与心功能的关系
经TUNEL染色后,光镜下观察可见3组均存在染色阳性的凋亡细胞(染色质浓缩、边集呈棕褐色,核膜裂解,可见染色质被分割成颗粒状即凋亡小体)。阴性对照组细胞核均呈蓝色。经统计学分析,MI+Bcl-2-BMSCs组的凋亡率较MI+BMSCs组显著降低(P<0.05),而MI+BMSCs组的细胞凋亡率又明显低于MI组,见图3、表1。经统计学分析发现,心肌梗死后左室射血分数与心肌细胞的凋亡率呈负相关(P<0.01)。
8 血管新生情况及其与心功能的关系
细胞移植后4周,将各组石蜡切片经过CD31免疫组化染色,于光镜下观察,各组梗死边缘区心肌组织可见染色阳性的棕褐色血管内皮细胞,MI+Bcl-2-BMSCs组毛细血管密度明显高于MI+BMSCs组(P<0.05);而 MI+BMSCs组又显著高于MI组(P<0.05),见图4、表1。经统计学分析发现,心肌梗死后左室射血分数与梗死边缘区新生毛细血管密度呈正相关(P<0.01)。

Figure 3.Apoptosis of myocardial cells in infarction marginal zone measured by TUNEL (×200). The apoptotic cells are indicated by red arrows.
图3 梗死边缘区心肌组织TUNEL染色
表1 各组兔心肌梗死边缘区细胞凋亡率、新生血管密度及VEGF mRNA表达量的比较
Table 1.The levels of cardiocyte apoptosis rate, neovascular density and VEGF mRNA expression in infarction marginal zone (Mean±SD.n=8)
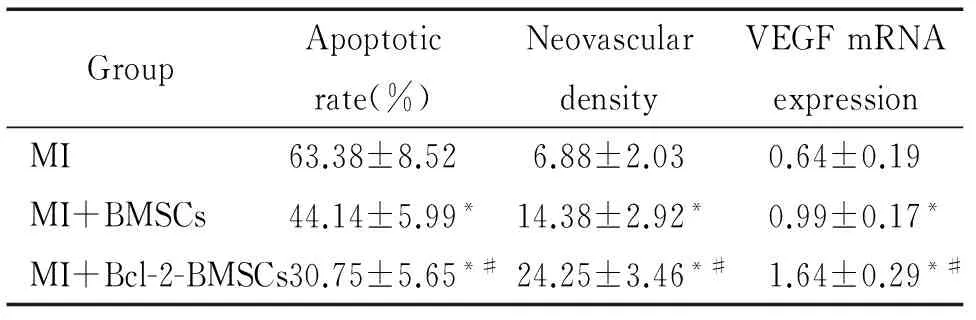
GroupApoptoticrate(%)NeovasculardensityVEGFmRNAexpressionMI63.38±8.526.88±2.030.64±0.19MI+BMSCs44.14±5.99*14.38±2.92*0.99±0.17*MI+Bcl-2-BMSCs30.75±5.65*#24.25±3.46*#1.64±0.29*#
*P<0.05vsMI;#P<0.05vsMI+BMSCs.

Figure 4.CD31 immunohistochemical staining of neovascular in infarction marginal zone (×100). The neovasculars are indicated by red arrows.
图4 心肌梗死边缘区新生血管CD31免疫组化染色
9 心肌梗死边缘区组织VEGF mRNA表达与心功能的关系
通过real-time PCR法测定心肌梗死边缘区组织中的VEGF表达量,检测结果表明MI+Bcl-2-BMSCs组VEGF mRNA表达量明显高于MI+BMSCs组(P<0.05),而后者又明显高于MI组(P<0.05),见图5、表1。经统计学分析发现,心肌梗死后左室射血分数与梗死边缘区心肌组织中VEGF的mRNA表达量呈正相关(P<0.01)。
讨 论
传统的药物治疗、冠脉介入治疗及外科手术治疗虽然广泛开展,但仅能有限地缓解症状而不能从根源上解决心肌细胞缺失的问题,心肌梗死后心衰的发生率及死亡率仍不断升高[8]。干细胞是一类具有自我更新能力和多向分化潜能未分化的细胞,因其具有较好细胞修复、替代和再生潜能,迅速成为心血管疾病治疗的新方法。干细胞种类繁多,经大量的相关对比研究发现,骨髓源性干细胞因其独特优势,受到研究者的重视[9]。

Figure 5.The level of VEGF mRNA in different groups. Mean±SD.n=8.*P<0.05vsMI;#P<0.05vsMI+BMSCs.
图5 各组心肌梗死边缘区VEGF mRNA表达量的比较
干细胞在治疗心肌梗死方面独具优势,然而移植后的干细胞在缺血、缺氧等恶劣环境下极低的存活率限制了其发展[10]。为此,人们尝试基因修饰的方法,即在细胞移植前将抗凋亡基因通过转染或转导的方式,使基因结构发生改变,进而从根源上解决干细胞的存活、代谢、增生或分化等能力。目前用于干细胞转染治疗缺血性心肌病研究的目的基因种类繁多,其中尤以抗凋亡基因颇受关注。研究表明,将Pim-1、GSK-3b或组织型激肽释放酶(tissue kallikrein,TK)等抗凋亡基因修饰的细胞移植到体内后均可使细胞凋亡减少,细胞的生存力增强[11-13]。
理想的细胞转染方法应具备操作简便、转染效率高、细胞毒性小等优点。病毒介导的转染技术,是目前转染效率最高的方法,且同时具有细胞毒性低的优势。因此,本实验采用腺病毒转染干细胞的方法,将目的基因bcl-2成功转染至BMSCs内,实验中未见明显毒副作用的发生,且转染效率高。
bcl-2是抗凋亡基因家族的一员,是细胞凋亡的关键调节分子,线粒体是其调控内在凋亡途径的靶点,主要作用于线粒体外膜[14],通过蛋白-蛋白相互作用形成异源或同源多聚体进而调节孔隙形成蛋白来发挥作用[15-16]。Li等[17]应用抗凋亡基因bcl-2修饰BMSCs后,观察到在体外低氧环境下经修饰后的BMSCs抗凋亡能力增强,同时VEGF分泌增多,移植体内后存活细胞数目显著增加,且心功能的改善更为显著。
本实验以腺病毒为载体,将bcl-2基因转导入BMSCs,通过增强型绿色荧光蛋白的表达来分别示踪2组BMSCs(重组EGFP-腺病毒载体可高效感染骨髓间质干细胞[18],并且不会影响BMSCs的分化及旁分泌机能[19-20]),细胞移植前于荧光显微镜下观察到MI+Bcl-2-BMSCs组及MI+BMSCs组均可见EGFP标记的绿色荧光蛋白在干细胞内表达,说明携带bcl-2基因及空载的腺病毒均已成功转染入细胞内。应用心肌内注射的方法将转染成功的各组干细胞分别移植入造模成功的心肌内,细胞移植后4周处死动物,留取梗死边缘区心肌组织,制备组织切片,再次于荧光显微镜下观察,结果发现MI+Bcl-2-BMSCs组及MI+BMSCs组仍可见EGFP标记的绿色荧光蛋白的表达,且前者明显多于后者,MI组则始终未见绿色荧光出现。说明移植的BMSCs可在梗死边缘区心肌组织内存活,且MI+Bcl-2-BMSCs组的BMSCs存活数量较MI+BMSCs组明显增多。经TUNEL法对心肌细胞凋亡进行检测发现,MI+Bcl-2-BMSCs组较MI+BMSCs组的细胞凋亡数目明显减少,而后者又明显低于MI组。说明BMSCs可使心肌梗死边缘区的部分缺血心肌细胞凋亡减少,而转染了bcl-2基因的BMSCs该作用更明显。超声影像学检测发现最终各组心功能产生了差异性变化,经统计分析证实,梗死边缘区心肌组织内细胞的凋亡率与心功能LVEF之间呈明确负相关关系。
此外,本研究还对各组心肌梗死边缘区的组织切片进行了免疫组织化学CD31染色,发现在该区有大量染色阳性(呈棕褐色)的血管内皮细胞存在,提示该区域存在血管新生,微循环丰富。并且MI+Bcl-2-BMSCs组染色阳性的毛细血管较MI+BMSCs组及MI组明显增加,同时在细胞移植4周后MI+Bcl-2-BMSCs组VEGF mRNA的表达量较MI+BMSCs组也明显增加,心功能明显改善,经统计学分析证实,VEGF mRNA的相对表达量及新生毛细血管数与心功能LVEF之间存在明显的正相关关系。由此我们推测bcl-2基因修饰BMSCs移植改善心功能的可能机制为bcl-2基因的导入抑制了部分BMSCs的凋亡,使最终移植后BMSCs的存活量增加;而移植到心肌梗死边缘区局部的BMSCs除了自身定向分化为心肌细胞,增加了功能性心肌细胞的数量外,同时BMSCs还通过某种分泌方式产生VEGF等细胞因子,进而促进梗死边缘区心肌组织内毛细血管再生,改善局部微循环,最终导致了心功能的改善。同样,国外学者也有类似的报道,他们发现移植后的BMSCs与内皮细胞间存在联分泌及旁分泌样地相互作用[21],而移植后的BMSCs将通过该方式产生多种促血管生成因子,营造促进血管再生的微环境[22-23]。这可能是心肌梗死后BMSCs促使局部心肌组织血管生成增加及心功能改善的内在机制。然而最终心功能的改善是否仅与分泌机制相关的微循环改善有关,干细胞是否还可分泌其它种类的细胞因子,或者是通过分泌机制以外的其它方式发挥功能,这些问题都有待我们进一步验证。
终上所述,经Bcl-2基因修饰的BMSCs移植可较单纯BMSCs移植更显著地减少心肌细胞凋亡、促进血管再生、改善心功能。本实验为临床心肌梗死的治疗提供了新思路,诸多动物实验所取得的成就也肯定了干细胞巨大的发展潜力,然而基因修饰干细胞应用于临床前还存在许多问题亟待解决[24],例如动物实验所取得进展能否在临床复制、该疗效是否可以长期维持、移植后远期安全性问题以及干细胞分离方法、基因转染的载体选择、细胞移植途径及数量的进一步标化等。相信随着该领域研究的不断深入,基因修饰干细胞移植将被广泛应用于临床。
[1] van den Borne SW, Diez J, Blankesteijn WM, et al. Myocardial remodeling after infarction: the role of myofibroblasts[J]. Nat Rev Cardiol, 2010, 7(1):30-37.
[2] Williams AR, Trachtenberg B, Velazquez DL, et al. Intramyocardial stem cell injection in patients with ischemic cardiomyopathy: functional recovery and reverse remodeling[J]. Circ Res, 2011, 108(7):792-796.
[3] Alhadlaq A, Mao JJ. Mesenchymal stem cells: isolation and therapeutics[J]. Stem Cells Dev, 2004, 13(4):436-448.
[4] 王 曼. 经Bcl-2修饰的同种异体骨髓间充质干细胞移植对兔心梗后心功能不全的影响[D]. 石家庄:河北医科大学,2014.
[5] 胡 炜,李树仁,张素巧,等. 自体骨髓间充质干细胞移植对心肌梗死后兔Ryanodine受体及其稳定蛋白表达的影响[J]. 中国老年学杂志, 2012, 32(01):110-113.
[6] 乔建晶,李树仁,胡 炜,等. 自体骨髓间充质干细胞移植对心肌梗死后心衰家兔炎性因子表达的影响[J]. 中国老年学杂志, 2011, 31(11):2048-2051.
[7] Schmittgen TD, Livak KJ. Analyzing real-time PCR data by the comparative C(T) method[J]. Nat Protoc, 2008, 3(6):1101-1108.
[8] Velagaleti RS, Pencina MJ, Murabito JM,et al. Long-term trends in the incidence of heart failure after myocardial infarction[J]. Circulation, 2008, 118( 20) : 2057-2062.
[9] Clifford DM, Fisher SA, Brunskill SJ, et al. Stem cell treatment for acute myocardial infarction[J]. Cochrane Database Syst Rev, 2012, 2:CD006536.
[10]Hoover-Plow J, Gong Y. Challenges for heart disease stem cell therapy[J]. Vasc Health Risk Manag, 2012,8:99-113.
[11]Quijada P, Toko H, Fischer KM, et al. Preservation of myocardial structure is enhanced by pim-1 engineering of bone marrow cells[J]. Circ Res, 2012, 111(1):77-86.
[12] Cho J, Zhai P, Maejima Y, et al. Myocardial injection with GSK-3β-overexpressing bone marrow-derived mesenchymal stem cells attenuates cardiac dysfunction after myocardial infarction[J]. Circ Res, 2011, 108(4):478-489.
[13]Gao L, Bledsoe G, Yin H, et al. Tissue kallikrein-modified mesenchymal stem cells provide enhanced protection against ischemic cardiac injury after myocardial infarction[J]. Circ J, 2013, 77(8):2134-2144.
[14]Ola MS, Nawaz M, Ahsan H. Role of Bcl-2 family proteins and caspases in the regulation of apoptosis[J]. Mol Cell Biochem, 2011, 351(1-2): 41-58.
[15]Lindsay J, Esposti MD, Gilmore AP. Bcl-2 proteins and mitochondria-specificity in membrane targeting for death[J]. Biochim Biophys Acta, 2011, 1813(4):532-539.
[16]Korytowski W, Basova LV, Pilat A, et al. Permeabilization of the mitochondrial outer membrane by Bax/truncated Bid (tBid) proteins as sensitized by cardiolipin hydroperoxide translocation mechanistic implications for the intrinsic pathway of oxidative apoptosis[J]. J Biol Chem, 2011, 286(30):26334-26343.
[17]Li W, Ma N, Ong LL,et al. Bcl-2 engineered MSCs inhibited apoptosis and improved heart function[J]. Stem Cells, 2007, 25(8):2118-2127.
[18]李红乐,邢飞跃,孙学刚,等. 腺病毒介导的EGFP基因在大鼠骨髓间充质干细胞中的高效表达[J]. 中国病理生理杂志, 2003, 19 (3) :293-296.
[19]Gheisari Y, Azadmanesh K, Ahmadbeigi N, et al. Genetic modification of mesenchymal stem cells to overexpress CXCR4 and CXCR7 does not improve the homing and therapeutic potentials of these cells in experimental acute kidney injury[J]. Stem Cells Dev, 2012, 21(16):2969-2980.
[20]Liu N, Zhang Y, Fan L, et al. Effects of transplantation with bone marrow-derived mesenchymal stem cells modified by survivin on experimental stroke in rats[J]. Transl Med, 2011, 9:105.
[21]Rahbarghazi R, Nassiri SM, Khazraiinia P, et al. Juxtacrine and paracrine interactions of rat marrow-derived mesenchymal stem cells, muscle-derived satellite cells, and neonatal cardiomyocytes with endothelial cells in angiogenesis dynamics[J]. Stem Cells Dev, 2013, 22(6):855-865.
[22]余其贵,王 永,吴继雄. 自体骨髓间充质干细胞移植心肌梗死区后细胞因子分泌和血管新生及心肌细胞凋亡的变化[J]. 中国组织工程研究与临床康复,2008, 12(16):3001-3005.
[23]Rahbarghazi R, Nassiri SM, Ahmadi SH, et al. Dynamic induction of pro-angiogenic milieu after transplantation of marrow-derived mesenchymal stem cells in experimental myocardial infarction[J]. Int J Cardiol, 2014, 173(3):453-466.
[24]葛均波,黄浙勇. 干细胞治疗急性心肌梗死:离临床应用还有多远?[J]. 中国实用内科杂志, 2011, 31(10):739-742.
Transplantation of bcl-2 gene-modified bone marrow mesenchymal stem cells improves cardiac function and angiogenesis in rabbit ischemic car-diac insufficiency model
GAO Qing1, LI Shu-ren2, XUN Li-ying2, YUAN Ke-xin2, XIE Yue-tao2, ZHANG Qian-hui2, HAO Qing-qing2, DANG Yi2, QI Xiao-yong2
(1GraduateSchoolofHebeiMedicalUniversity,2DepartmentofCardiology,HebeiGeneralHospital,Shijiazhuang050051,China.E-mail:lsr64@126.com)
AIM: To investigate the effects of transplantation of bone marrow mesenchymal stem cells (BMSCs) modified bybcl-2 gene on myocardial cell apoptosis, angiogenesis and cardiac function in the rabbit after acute myocardial infarction (MI). METHODS: The rabbit BMSCs were isolated, cultured and purifiedinvitro. The BMSCs were transfected with adenovirus or adenovirus-Bcl-2. The rabbit model of MI was established by ligation of left anterior descending branch. The rabbits were injected with Ad-Bcl-2-BMSCs (MI+Bcl-2-BMSCs group), Ad-BMSCs (MI+BMSCs group) and DMEM (MI group) in infarction marginal zone 2 weeks after ligation. The cardiac function was evaluated by echocardiography.The apoptosis of myocardial cells was measured by TUNEL. The mRNA expression of VEGF was detected by real-time PCR. The expression of CD31 was examined by immunohistochemical staining, and new blood capillaries were counted at 4 weeks after BMSCs transplantation. The correlation of the above values with cardiac function was analyzed. RESULTS: The cardiac function was better, the apoptotic rate was lower, the mRNA expression of VEGF and the capillary density were higher in both MI+Bcl-2-BMSCs group and the MI+BMSCs group than those in MI group, and those in MI+Bcl-2-BMSCs group increased more obviously .The left ventricular ejection fraction (LVEF) had a negative correlation with the myocardial cell apoptosis rate. A positive correlation with the mRNA expression level of VEGF and the capillary density was also observed. CONCLUSION: The transplantation of BMSCs modified bybcl-2 gene significantly reduces the myocardial cell apoptosis, promotes angiogenesis, improves heart function of the rabbits with MI.
Bone marrow mesenchymal stem cells; Gene therapy; Myocardial infarction;bcl-2 gene
1000- 4718(2015)04- 0640- 07
2014- 11- 13
2015- 01- 07
R363; R541.4
A
10.3969/j.issn.1000- 4718.2015.04.012
△通讯作者 Tel: 0311-85988732; E-mail: lsr64@126.com
