柚皮苷对高糖诱导的血管内皮细胞损伤及PI3K/AKT/eNOS信号通路的影响*
2015-04-17储佳佳李积东严国强沈小丹温见炳黄起壬
储佳佳, 李积东, 雷 霖, 孔 滢, 李 腾, 严国强, 沈小丹, 温见炳, 黄起壬△
(1江西省基础药理学重点实验室, 2南昌大学药学院药理学教研室,江西 南昌 330006; 3宜春市公安局刑事科学技术研究所,江西 宜春 336000)
柚皮苷对高糖诱导的血管内皮细胞损伤及PI3K/AKT/eNOS信号通路的影响*
储佳佳1, 2▲, 李积东1,2▲, 雷 霖3, 孔 滢1, 2, 李 腾1, 2, 严国强1, 2, 沈小丹1, 2, 温见炳1, 2, 黄起壬1, 2△
(1江西省基础药理学重点实验室,2南昌大学药学院药理学教研室,江西 南昌 330006;3宜春市公安局刑事科学技术研究所,江西 宜春 336000)
目的: 研究柚皮苷(naringin,Nar)对高糖(high glucose,HG)诱导人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)损伤的作用及对PI3K/AKT/eNOS信号通路的影响。方法: 利用 HG(33 mmol/L glucose)培养基孵育HUVECs不同时间(6、12、24、48、72 h)后,用胰岛素(5 mIU/L)刺激细胞15 min,建立内皮细胞损伤模型,分别测定各组上清液中NO水平、细胞中eNOS和磷酸化eNOS(p-eNOS)的水平。对损伤的HUVECs用不同浓度的Nar (5、10、25、50、100 mg/L)孵育不同时间(6、12、24、48和72 h),用胰岛素(5 mIU/L)刺激细胞15 min, 检测细胞上清中的NO水平,观察Nar对HG诱导HUVECs 损伤的作用。对损伤细胞先分别用PI3K抑制剂LY294002(10 μmol/L)和AKT抑制剂AKT inhibitor Ⅳ(0.5 μmol/L)预处理24 h,再用50 mg/L的Nar处理24 h,用胰岛素(5 mIU/L)刺激细胞15 min,检测细胞上清中NO的水平,以及 eNOS、p-eNOS、PI3K、AKT及p-AKT的蛋白水平,探讨Nar减轻HG对HUVECs 损伤作用的机制。结果: Nar的量效和时效结果显示,50 mg/L Nar预处理HUVECs 24 h后,其减轻HG对HUVECs 损伤的作用最为显著,表现为NO和p-eNOS的水平升高(P<0.05)。加入PI3K和AKT抑制剂后,Nar减轻HG致内皮细胞的损伤及上调p-eNOS和NO水平的作用完全取消(P<0.05)。结论: Nar能减轻HG诱导的血管内皮细胞损伤,其作用机制可能是通过PI3K/AKT/eNOS信号通路介导的。
人脐静脉内皮细胞; 高糖; 柚皮苷; 内皮型一氧化氮合酶
血管内皮是血液和血管壁之间的机械屏障,维持血管壁的完整性,也是全身最大的内分泌器官,可分泌多种血管活性物质,如内皮素(endothelin,ET),一氧化氮(nitric oxide,NO)等,从而调节血管的舒缩功能。但是吸烟、高脂血症、高血糖和高血压等心血管危险因素持续损伤血管内皮,从而产生了诸多心脑血管疾病[1-2]。因此,在血管内皮损伤时积极干预治疗,防止或延缓心血管疾病的发生发展尤为重要。
经研究发现,柚皮苷(naringin,Nar)为二氢异黄酮类化合物,具有明显的抗炎、抗氧化应激、改善胰岛素抵抗、调节糖类脂肪代谢等多种药理学作用[3];并且可有效地降低高糖(high glucose,HG)诱导的血管内皮炎症损伤[4]。但其保护血管内皮免于损伤的作用机制尚未完全阐明。因血管内皮细胞功能紊乱与PI3K/AKT/eNOS通路受到抑制有关[5]。因此,本研究拟探讨Nar是否是通过PI3K/AKT/eNOS/NO信号通路,从而有效减轻HG致内皮损伤的程度。
材 料 和 方 法
1 主要的试剂和仪器
Nar(中国成都西亚试剂有限公司);AKT inhibitor Ⅳ(Calbiochem);PI3K 抑制剂LY294002 (Sigma);人脐静脉内皮细胞株(human umbilical vein endothelial cells,HUVECs)购于ATCC;H-DMEM、L-DMEM和胎牛血清(HyClone);β-actin多克隆抗体(中国北京中杉金桥生物技术有限公司);p-eNOS、eNOS、AKT、p-AKT和PI3K单克隆抗体(CST);NO检测试剂盒(中国南京建成生物工程研究所);酶标仪(Bio-Rad)。
2 高糖诱导HUVECs损伤模型的建立
将HUVECs接种于6孔板上,待细胞长至90%的融合度后,换液;加入HG (33 mmol/L glucose) 培养基于37 ℃、5% CO2孵箱中孵育细胞不同时间(6、12、24、48和72 h)后换成无血清无双抗的PBS过夜,再用胰岛素(5 mIU/L)刺激细胞15 min,最后分别收集细胞上清液和细胞。上清液用于检测HG处理前和高糖处理后各时点的NO水平;细胞用于检测eNOS和p-eNOS水平。
3 Nar的最佳浓度和最佳孵育时间的确定
将培养的HUVECs接种于6孔板上,待细胞融合了90%后,除了正常(control, Ctrl)组,其它各组均用高糖诱导,为高糖(HG)组,并分别加入不同浓度的Nar(0、10、25、50、100 mg/L)孵育24 h后换成无血清无双抗的PBS过夜,再用胰岛素(5 mIU/L)刺激细胞15 min,收集上清,检测培养基上清中的NO水平,以确定Nar最佳的的孵育浓度。再用已筛选出的最佳浓度的Nar,分别处理细胞6、12、24、36和48 h,正常组则加入等体积的DMSO孵育后,换成无血清无双抗的PBS过夜,再用胰岛素(5 mIU/L)刺激细胞15 min,检测各时点细胞上清液中NO水平。
4 分组给药
实验共分5组。除了Ctrl组,其它4组均用HG孵育48 h成损伤模型后,各实验组分别加入DMSO、Nar(50 mg/L)、 10 μmol/L LY294002[6]+ Nar、0.5 μmol/L AKT inhibitor Ⅳ[7]+ Nar,孵育24 h后换成无血清无双抗的PBS过夜,再用胰岛素(5 mIU/L)刺激细胞15 min,检测培养基上清中的NO水平。用Western blot检测HUVECs的eNOS、p-eNOS、PI3K、AKT及p-AKT蛋白的水平。
5 培养上清液中NO水平的检测
参照南京建成生物工程研究所NO检测试剂盒的使用说明,先做出标准曲线,然后根据各组吸光度,计算出各组NO的水平。
6 Western blotting检测eNOS、p-eNOS、PI3K、AKT及p-AKT蛋白的水平
HUVECs处理后,经PBS清洗后,用RIPA裂解液进行裂解,蛋白浓度用BCA试剂盒进行测定,细胞裂解物溶于上样缓冲溶液后经10%的SDS-PAGE分离,并电转到PVDF膜上,取出后将膜放入5%脱脂牛奶或者5% BSA封闭中,封闭2 h,再用TBST洗膜3次,每次15 min。将PVDF膜放入相应 I 抗中(1∶1 000),4 ℃孵育过夜。TBST冲洗膜后,将膜放入相应的 II 抗(1∶2 000)中,室温平摇2 h后,漂洗3次,每次20 min,用ECL化学发光法进行检测。将曝光条带进行X光胶片扫描后,在医学图形分析系统Image Tool软件上进行灰度分析。结果以目的蛋白条带的综合密度分别除以对应组β-actin条带的综合密度所得的倍数表示。
7 统计学处理
各实验组数据以均数±标准误(mean±SEM)表示,采用系统统计软件 SPSS 17.0进行方差齐性检验,方差齐的各组采用单因素方差分析(one-way ANOVA),组间比较用LSD法。以P<0.05为差异有统计学意义。
结 果
1 高糖诱导不同时间对NO、eNOS和p-eNOS水平的影响
用HG(33 mmol/L glucose)诱导48 h和72 h后,NO和p-eNOS水平显著下降(P<0.01);但是诱导48 h和72 h两者之间比较,差异无统计学意义(P>0.05),所以选定48 h为诱导内皮损伤的最佳时间,见图1。

Figure 1.The HUVECs were treated with HG medium for the indicated time and then the levels of NO and p-eNOS were detected respectively. Mean±SEM.n=3.#P<0.05,##P<0.01vsCtrl.
图1 HG诱导不同时间后的NO和p-eNOS水平改变
2 Nar减轻内皮损伤作用的浓度效应和时间效应关系
如图2所示,HG组NO水平显著下降(P<0.01);随着Nar浓度增加,NO水平逐渐升高,在Nar浓度为50 mg/L时达到峰值,且与HG组比较具有统计学意义(P<0.01);Nar浓度为100 mg/L时的NO释放量与50 mg/L时比较差异无统计学意义(P>0.05),所以选择50 mg/L为 Nar的最佳效应浓度。在时间效应中,随着Nar处理时间延长,NO水平也逐渐升高,在 24 h时达到峰值且与HG组相比有显著差异(P<0.01),随后(36 h和48 h)又稍下降但与24 h比较差异无统计学意义(P>0.05),故选择24 h为Nar的最佳作用时间。
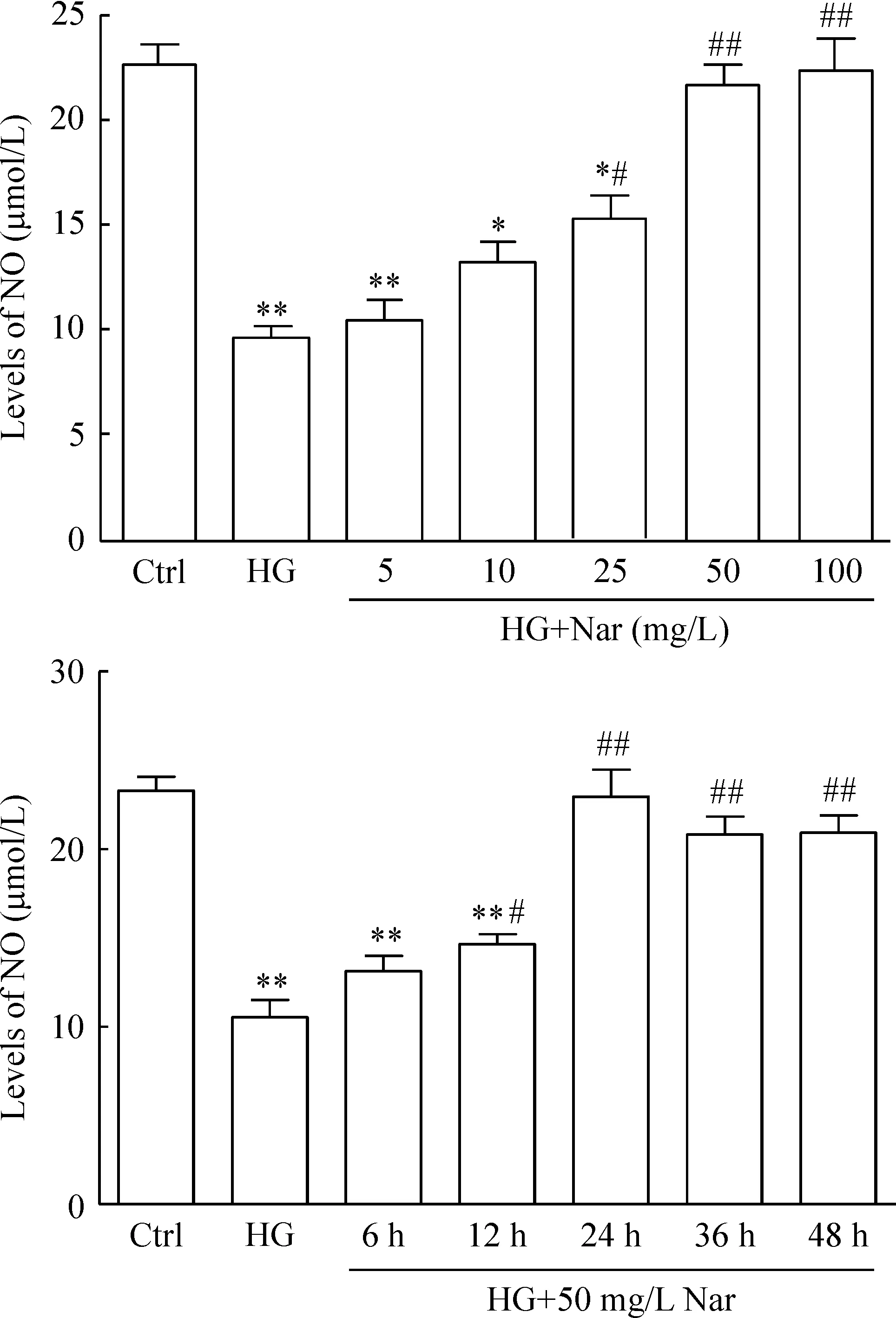
Figure 2.Effects of Nar on the NO level in HG-induced HUVECs. The HUVECs were treated with Nar at concentrations of 5, 10, 25, 50 and 100 mg/L, respectively for 24 h and the levels of NO in the supernatant were detected. Nar at concentration of 50 mg/L was used to treat the cells for different time (6, 12, 24, 36 and 48 h), and the levels of NO were detected. Mean±SEM.n=3.*P<0.05,**P<0.01vsCtrl;#P<0.05,##P<0.01vsHG.
图2 Nar 保护血管内皮细胞作用的浓度效应和时间效应关系
3 Nar、LY294002和AKT inhibitor Ⅳ对NO水平的影响
与Ctrl组比较,HG组的NO水平显著下降(P<0.01);HG+Nar(50 mg/L)组的NO水平较HG组显著升高(P<0.01);分别加入10 μmol/L LY294002和0.5 μmol/L AKT inhibitor Ⅳ后,NO水平较Ctrl组和Nar组下降(P<0.01),见图3。

Figure 3.The HUVECs were treated with Nar (50 mg/L), LY294002 (10 μmol/L) and AKT inhibitor Ⅳ (0.5 μmol/L), and the levels of NO in the supernatant were detected. Mean±SEM.n=3.**P<0.01vsCtrl;##P<0.01vsHG;&&P<0.01vsHG+Nar.
图3 Nar、LY294002和AKT inhibitor Ⅳ对NO水平的影响
4 Nar、LY294002和AKT inhibitor Ⅳ对eNOS、p-eNOS、PI3K、AKT及p-AKT蛋白水平的影响
与Ctrl组相比,各组AKT和eNOS蛋白表达的差异无统计学意义(P>0.05),说明Nar、LY294002和AKT inhibitor Ⅳ对上述蛋白表达无影响; 但各组的PI3K和磷酸化信号蛋白p-AKT和p-eNOS的水平显著改变,如HG组上述各磷酸化信号蛋白和PI3K的水平显著下降(P<0.01);HG+Nar (50 mg/L)组的各磷酸化信号蛋白和PI3K的水平显著升高(P<0.01);加入AKT inhibitor Ⅳ抑制剂和LY294002后,Nar增加上述各磷酸化信号蛋白和PI3K蛋白水平的作用被取消,表明Nar能恢复被高糖抑制的各信号蛋白活性,并且该作用是PI3K/AKT/eNOS依赖性的,见图4。
讨 论
研究表明在血管内皮细胞可分泌多种血管活性物质,如ET、NO等,参与IRS-1/PI3K/AKT/NO和IRS-1/RAS/MAPK/ET-1等信号通路,从而调节内皮的功能[8]。但在病理状态下(如高血糖、高胰岛素血症和高脂血症等),通路间的平衡可能被打破,导致内皮功能失常,从而诱发高血压、动脉粥样硬化和冠心病等心血管事件[9-10]。NO主要在由内皮型一氧化氮合酶(eNOS)催化作用下由内皮细胞产生,当体内的NO下降时,会改变内皮细胞的通透性,促使血管内皮功能紊乱[11]。实验中,我们使用含糖量为33 mmol/L的高糖培养基诱导HUVECs建立内皮损伤模型,研究柚皮苷对抗内皮损伤从而保护内皮细胞的作用机制。实验结果表明在使用高糖诱导HUVECs 48 h后,细胞上清中NO水平和p-eNOS的水平下降且差异具有统计学意义,说明我们成功建立内皮细胞损伤模型。
2型糖尿病内皮功能紊乱与PI3K/AKT/eNOS信号通路受到抑制有关,且临床常用的治疗药物罗格列酮增强eNOS的活性与上调PI3K/AKT通路有关[12]。研究表明柚皮苷具有抗炎,改善内皮损伤,胰

Figure 4.The HUVECs were treated with Nar (50 mg/L), LY294002 (10 μmol/L) and AKT inhibitor Ⅳ (0.5 μmol/L) respectively, and the protein levels of PI3K, p-AKT and p-eNOS in the HUVECs were detected by Western blotting. Mean±SEM.n=3.**P<0.01vsCtrl;##P<0.01vsHG.
图4 Nar、LY294002和AKT inhibitor Ⅳ对各组细胞PI3K、p-AKT和p-eNOS蛋白水平的影响
岛素抵抗以及心肌保护[3]等作用,那么柚皮苷对血管内皮的保护作用是否和PI3K/AKT/eNOS信号通路有关呢?本实验结果表明,在损伤的细胞中加入柚皮苷后,通过检测培养基上清中的NO和p-eNOS的水平发现,柚皮苷可改善HUVECs的损伤程度;但是在分别加入PI3K和AKT抑制剂后,发现细胞培养基上清中NO水平下降,PI3K、p-AKT、p-eNOS的水平也均降低,柚皮苷改善内皮功能的作用消失。
综上所述,本研究认为柚皮苷可以减轻HG诱导的内皮细胞损伤,且其保护作用是通过PI3K/AKT/eNOS信号通路介导的。目前研究表明临床上所用药物罗格列酮是通过依赖过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor gamma,PPARγ)的途径来改善内皮胰岛素抵抗程度,那么柚皮苷保护血管内皮细胞的作用与PPARγ是否有关,这是我们下一步的研究重点。随着柚皮苷对内皮细胞保护作用机制研究的深入,有望能为合成和开发新的治疗心脑血管疾病的药物提供实验基础。
[1] Mudau M, Genis A, Lochner A, et al. Endothelial dysfunction: the early predictor of atherosclerosis[J]. Car-diovasc J Afr, 2012, 23(4):222-231.
[2] Jia YN, Ji L, Zhang SA, et al. Total flavonoids fromRosaLaevigataMichx fruit attenuates hydrogen peroxide induced injury in human umbilical vein endothelial cells[J]. Food Chem Toxicol, 2012, 50(9):3133-3141.
[3] 梁建光,游 琼,吴 铿,等. 柚皮苷调控心肌核因子NF-κB炎症信号通路对糖尿病心肌病大鼠防治作用[J]. 中国免疫学杂志,2013, 29(2):121-124.
[4] 饶进军,熊 莺,王广发,等. 柚皮苷抑制高糖诱导的脐静脉内皮细胞与单核细胞的粘附作用[J]. 南方医科大学学报,2010, 30(2):321-325.
[5] Wu J, Lei MX, Xie XY, et al. Rosiglitazone inhibits high glucose-induced apoptosis in human umbilical vein endothelial cells through the PI3K/Akt/eNOS pathway[J]. Can J Physiol Pharmacol, 2009, 87(7):549-555.
[6] 王璐阳. PI3K/Akt/AP-1通路对高糖培养血管平滑肌细胞增殖及CRP、IL-6、TNF-α表达的影响[D]. 河北医科大学,2013.
[7] 王凤泽,费洪荣,许广群,等. PI3K/Akt抑制剂CCT128930抑制人脐静脉血管内皮细胞增殖与血管生成的实验研究[J]. 中国药理学通报,2012, 28(10):1413-1416.
[8] Celinski K, Dworzanski T, Fornal R, et al. Comparison of the anti-inflammatory and therapeutic actions of PPAR-gamma agonists rosiglitazone and troglitazone in experimental colitis[J].Physiol Pharmacol, 2012, 63(6):631-640.
[9] Jansson PA. Endothelial dysfunction in insulin resistance and type 2 diabetes[J].J Intern Med, 2007, 262(2):173-183.
[10]Wong C, Marwick TH. Obesity cardiomyopathy: pathogenesis and pathophysiology[J]. Nat Clin Pract Cardiovasc Med, 2007, 4(8):436-443.
[11]李自成,边 宁,龚博君,等.一氧化氮/诱导型一氧化氮合酶在动脉粥样硬化过程中的作用[J]. 中国病理生理杂志,2014, 30(3):414-418.
[12]吴 静,雷闽湘,冯湘玲,等. 罗格列酮对人脐静脉内皮细胞NO和PI3K/Akt/eNOS信号通路的影响[J]. 中南大学学报,2007, 32(5):824-830.
Naringin protects human umbilical vein endothelial cells against injury induced by high glucose through PI3K/AKT/eNOS pathway
CHU Jia-jia1, 2, LI Ji-dong1, 2, LEI Lin3, KONG Ying1, 2, LI Teng1, 2, YAN Guo-qiang1, 2, SHEN Xiao-dan1, 2, WEN Jian-bing1, 2, HUANG Qi-ren1, 2
(1JiangxiProvincialKeyLaboratoryofBasicPharmacology,2DepartmentofPharmacology,CollegeofPharmacy,NanchangUniversity,Nanchang330006,China;3InstituteofCriminalScienceinYichunPoliceBureau,Yichun336000,China.E-mail:qrhuang@ncu.edu.cn)
AIM: To investigate the protective effect of naringin (Nar) on the injury of human umbilical vein endothelial cells (HUVECs) induced by 33 mmol/L high glucose (HG) and to explore its possible mechanisms. METHODS: The injury model was established by treating HUVECs with HG medium for the indicated time (6, 12, 24, 48 and 72 h), and then the levels of NO, eNOS and p-eNOS were detected, respectively. The effects of Nar on high glucose-induced endothelial cell injury were observed. HUVECs were treated with Nar at concentrations of 5, 10, 25, 50 and 100 mg/L for 6 h, 12 h, 24 h, 36 h and 48 h. The levels of NO in the supernatants were measured. The effects of Nar on HG-injured HUVECs were explored by treating the cells with 10 μmol/L of LY294002, a PI3K inhibitor, or 0.5 μmol/L of AKT inhibitor Ⅳ, an AKT inhibitor, and then the levels of NO, PI3K, AKT, eNOS and their phosphorylated proteins were determined by Western blot. RESULTS: Nar at concentration of 50 mg/L significantly attenuated the injury of endothelial cells induced by high glucose (P<0.01), and the protective effects of Nar were abolished by pretreating with the inhibitor of PI3K or AKT (P<0.01). CONCLUSION: Nar protects endothelial cells against the injury induced by high glucose through PI3K/AKT/eNOS pathway.
Human umbilical vein endothelial cells; High glucose; Naringin; Endothelial nitric oxide synthase
1000- 4718(2015)04- 0625- 05
2014- 11- 21
2015- 03- 02
国家自然科学基金资助项目(No. 81360060; No. 81070633); 江西省主要学科学术和技术带头人培养计划项目(No. 20123BCB22005)
R363.2
A
10.3969/j.issn.1000- 4718.2015.04.009
△通讯作者 Tel: 0791-86361839; E-mail: qrhuang@ncu.edu.cn
▲并列第1作者
