三疣梭子蟹血清凝集素的生物学特性
2015-04-17郝贵杰王春琳林锋等
郝贵杰 王春琳 林锋 等
摘要:对三疣梭子蟹(Portunus trituberculatus)血清凝集素的凝集特性进行了研究。结果表明: 三疣梭子蟹血清凝集素对鲫鱼、中华鳖、草鱼、鸡和人类A、B、O型血细胞没有凝集作用,但是对小鼠、兔的血细胞表现出较强的凝集活性,其中对小鼠血细胞的血凝活性达到210,对兔血细胞的血凝活性达到28;盐度对其凝集活性有较大影响,NaCl浓度在0.6 mol/L以上时基本失活;凝集素活性最适pH 值为6.0~7.4;血清凝集素对Ca2+、Mg2+离子有明显的依赖性,EDTA可以明显抑制其凝集活性;糖抑制结果表明,血清凝集素活性能被N-乙酰葡萄糖胺及N-乙酰甘露糖胺特异性抑制;对血清凝集素进行硫酸铵分级沉淀分离后,发现凝集素活性主要分布在25%饱和度硫酸铵沉淀区;聚丙烯凝胶电泳(SDS-PAGE)结果表明,主要蛋白条带在72~95 ku。
关键词:三疣梭子蟹;血清凝集素;凝集活性;聚丙烯凝胶电泳
中图分类号: S966.16文献标志码: A文章编号:1002-1302(2015)01-0220-04
收稿日期:2014-08-14
基金项目:国家自然科学基金(编号:41106123);国家“863”计划(编号:2012AA10A409);浙江省自然科学基金(编号:LY12C19009);浙江省科技厅重大科技专项(编号:2012C12907-3) 。
作者简介:郝贵杰(1979—),女,安徽六安人,硕士,副研究员,主要从事水生动物病害及免疫学研究。 E-mail:melissa511@sina.com。
通信作者:沈锦玉,硕士,研究员,主要从事水生动物病害及免疫学研究。E-mail: shenjinyu@126.com。三疣梭子蟹(Portunus trituberculatus)是一种重要的海洋经济动物,隶属甲壳纲(Crustacea)、十足目(Decapoda)、梭子蟹科(Portunidae)、梭子蟹属(Portunus),广泛分布于中国、日本等海域[1],因其具有生长快、肉质好的特点,深受国内外消费者的喜爱。近年来随着育苗和养殖技术的日臻成熟,梭子蟹养殖面积和养殖产量逐年增加,目前已成为沿海各省海水养殖的主导产品。然而由于梭子蟹养殖规模的逐年增加,养殖环境的变化等已对其免疫防御系统造成了影响,导致梭子蟹自身抗病力下降,对病害的易感性增加。例如近年来由弧菌引起的“牙膏病”“乳化病”给梭子蟹带来较大危害,也造成了该产业重大经济损失,严重制约了梭子蟹养殖业的持续健康发展[2-3]。目前水产养殖户多用抗生素防治病害,但从使用抗生素等药物的安全性、抗药性以及对水环境的不良影响等方面考虑,研究梭子蟹的免疫机制,有效提高蟹本身的抗病能力,显得越来越重要。
三疣梭子蟹属于甲壳类动物,无特异性免疫应答,非特异性免疫包括细胞免疫和体液免疫,凝集素是甲壳类动物体液免疫中的一种重要免疫因子[4],其作用就相当于脊椎动物中的抗体[5-6],具有重要的免疫作用,例如可对外来病原菌具有选择性凝集作用,可通过调理和介导血细胞发挥吞噬外来物质的作用,能够协同机体的其他免疫因子抵御外来病原入侵[7]。随着甲壳类养殖的增加及病害的增多,对养殖对虾、贝类以及鲎的凝集素研究已有较多报道[8-14],但对三疣梭子蟹凝集素的研究较少[15-16],而同属蟹类的中华绒螯蟹(Eriocheir sinensis)、锯缘青蟹(Scylla serrata)的报道很多[17-22]。本研究对三疣梭子蟹血清凝集素开展相关研究,包括其血凝谱、凝集条件、影响因素及凝集素的盐析纯化等,旨在为深入研究三疣梭子蟹血清凝集素类型、分布、功能,阐明凝集素在三疣梭子蟹免疫中的作用机制提供基础资料。
1材料与方法
1.1材料
1.1.1供试动物及血液三疣梭子蟹取自浙江省宁波象山鑫亿鲜活水产品有限公司,体质量150 g左右;新西兰大白兔、ICR小鼠购自浙江省医学院动物中心;鲫鱼、草鱼、鸡、中华鳖购自浙江省湖州市农贸市场,人的A、B、O型血由湖州市中心血站提供。
1.1.2试验药品及试剂N-乙酰基氨基葡萄糖(N-acetyl-D-glucosamine,GlcNAc)、N-乙酰氨基甘露糖(N-acetyl-D-mannosamine,ManNAc)、葡萄糖、木糖、蔗糖、海藻糖、甘露糖、乳糖、D-半乳糖、果糖均为Sigma进口分装。Alservers抗凝剂、pH值7.4 Tris-HCl(TBS-Ⅰ 含Ca2+,TBS-Ⅱ不含Ca2+)等按文献[23]方法配制。
1.2方法
1.2.1三疣梭子蟹血清制备用剪刀剪断三疣梭子蟹的步足关节柔软处,收集血淋巴于玻璃平皿中,室温静置2~3 h,4 ℃ 冰箱过夜,将其分装于离心管中,6 000 r/min 、4 ℃离心10 min,吸取上层血清,-80 ℃保存备用。
1.2.2动物血细胞制备以Alservers抗凝剂润洗注射器抽血,小鼠和中华鳖为心脏采血,兔为耳静脉采血,鸡为翅下静脉采血,鲫鱼和草鱼为尾静脉采血。抗凝血液保存于4 ℃冰箱中,用前3 000 r/min 离心3 min,取血细胞以0.85%生理盐水洗3次后,配制成2%(体积比)血细胞悬液,用于凝集试验。
1.2.3血清凝集素凝集谱的测定在96孔微量血凝板中进行测定血清凝集素凝集谱。每孔加入25 μL TBS-Ⅰ,取 25 μL 血清样品进行连续2倍稀释,再加入25 μL 2%血细胞,室温静置1~2 h,按文献[24]方法观察记录红细胞凝集情况。
1.2.4盐度对血凝效价的影响配制不同盐度的TBS-Ⅰ(0.15~1.35 mol/L NaCl),各取25 μL加至微量板中,再以2倍梯度稀释待测三疣梭子蟹血清样品,加入相同体积的2%小鼠血细胞,按上述方法测定血清凝集效价。
1.2.5pH值对血凝效价的影响分别用1 mol/L HCl和 1 mol/L NaOH将TBS-Ⅰ的pH值调为3.0、4.0、5.0、6.0、70、7.4、8.0、9.0、10.0,取不同pH值的TBS-Ⅰ 25 μL分别加至微量板中,再以2倍梯度稀释待测血清样品,加入等量的2%小鼠血细胞,室温静置1~2 h,测定血清凝集效价。
1.2.6Ca2+、Mg2+、EDTA对血凝效价的影响分别以TBS-Ⅱ配制含20 mmol/L Ca2+、20 mmol/L Mg2+、20 mmol/L EDTA的3种溶液,另设1组对照,分别取上述4种溶液 25 μL 加至微量板中,再以2倍梯度稀释待测三疣梭子蟹血清样品,加入等体积2%小鼠血细胞,测定血清凝集效价。
1.2.7糖抑制试验分别以TBS-Ⅰ配制200 mmol/L葡萄糖、木糖、蔗糖、海藻糖、甘露糖、乳糖、D-半乳糖、果糖、GlcNAc溶液以及200、400 mmol/L ManNAc溶液,分别取各溶液25 μL加至微量板中,再以2倍梯度稀释待测三疣梭子蟹血清样品,先在37 ℃中温育30 min,加入 等体积的2%小鼠血细胞,测定血清凝集效价。
1.2.8血清的饱和硫酸铵溶液分级沉淀取血清样品 10 mL,用PBS溶液稀释至2倍,置于电磁搅拌器上搅拌,逐滴加入饱和硫酸铵溶液6.7 mL,边加边搅拌,4 ℃沉淀过夜。第2天把沉淀溶液分装于7 mL离心管,4 ℃、4 000 r/min离心30 min。将所得沉淀加入适量的PBS溶解,转移到透析袋中,透析2 d(间隔6~8 h换1次PBS溶液),最后得到的溶液就是血清经25%饱和硫酸铵沉淀的盐析成分。然后根据离心后上清液的量,加入适量饱和硫酸铵溶液,用相同方法分别得到30%、40%、50%、60%的饱和硫酸铵沉淀的血清盐析成分,用蛋白测定仪分别测定各组分蛋白浓度。
1.2.9不同盐析组分的凝集特性及糖抑制特性分别按照“1.2.3”节、“1.2.7”节的方法测定饱和硫酸铵溶液沉淀的各盐析组分对不同动物血细胞凝集效价及其糖抑制特性。
1.2.10SDS-PAGE电泳按照Laemmli方法[25],灌注 1 mm 厚5%浓缩胶和12%分离胶的不连续SDS-PAGE胶,根据浓度稀释各样品,并分别加入4×上样缓冲液,煮沸3~5 min,用微量取样器取10~20 μg蛋白上样,垂直电泳槽恒压80 V电泳,待跑至分离胶后,再将电压调至110 V。电泳结束后用考马斯亮蓝快速染色液染色蛋白条带,观察结果并拍照。
2结果与分析
2.1血清凝集素对动物红细胞的凝集谱
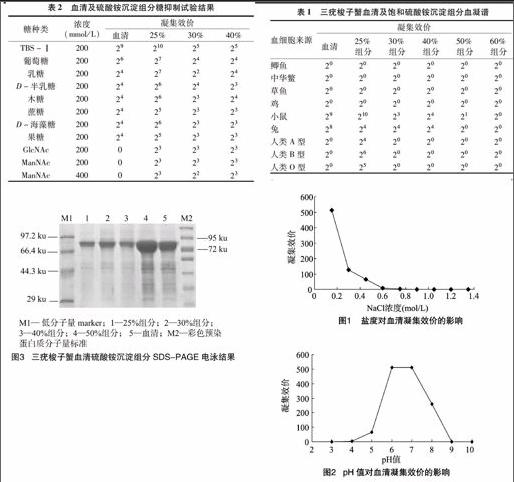
由表1可知,三疣梭子蟹血清凝集素对小鼠、兔、鲫鱼、中华鳖、草鱼、鸡和人类A、B、O型血细胞均有不同程度凝集,其中以对小鼠血细胞的凝集效价最高,达210;其次是兔血细胞,
表1三疣梭子蟹血清及饱和硫酸铵沉淀组分血凝谱
2.2盐度对血凝效价的影响
由图1可知,在NaCl浓度是0.15 mol/L 时凝集活力最高;而随着盐度升高,凝集活力逐渐下降;当盐度达到 0.6 mol/L 以上时,凝集活性被强烈抑制,凝集素已基本失去凝集活性。
2.3pH值对血凝效价的影响
由图2可知,三疣梭子蟹血清在pH值为 6.0~7.4时凝集效价最高,为29;pH值低于6.0时凝集效价逐渐下降,pH值为4.0时凝集活性被强烈抑制,凝集素已基本失去凝集活性;pH值为8.0时凝集效价是28,pH值为9时凝集效价急剧下降,为20,基本处于失活状态。
2.4Ca2+、Mg2+、EDTA对血凝效价的影响
测定了在三疣梭子蟹血清中分别添加Ca2+、Mg2+、EDTA对其凝集活力的影响,结果表明分别添加20 mmol/L Ca2+、20 mmol/L Mg2+均对其凝集活力具有增强作用,其凝集效价由28提高到29;但是添加20 mmol/L EDTA后,血清凝集效价降为23,几乎失去活性。这表明EDTA能够在血清环境下强烈抑制凝集素的凝集活性,三疣梭子蟹血清凝集素对Ca2+、Mg2+有明显的依赖性。
2.5糖抑制试验结果
由表2可知,葡萄糖等9种常见糖对三疣梭子蟹血清的凝集活性有不同程度的抑制作用,其中N-乙酰基葡萄糖胺(GlcNAc)和N-乙酰甘露糖(ManNAc)对三疣梭子蟹凝集素的抑制作用最强,200 mmol/L浓度即能完全抑制其凝集活性;其次为乳糖、D-半乳糖、果糖、木糖、蔗糖、D-海藻糖,200 mmol/L 葡萄糖对血清凝集素的抑制作用较小。从表2还可见,各沉淀组分和GlcNAc或ManNAc结合时,受到的抑制作用最强。表明三疣梭子蟹的血清凝集素对GlcNAc和ManNAc有特异性的结合能力。
表2血清及硫酸铵沉淀组分糖抑制试验结果
糖种类浓度
(mmol/L)凝集效价血清25%30%40%TBS-Ⅰ200292102525葡萄糖20026272424乳糖20024272224D-半乳糖20024262423木糖20024262324蔗糖20024252323D-海藻糖20024262323果糖20024252323GlcNAc2000232323ManNAc2000232323ManNAc4000232223
2.6饱和硫酸铵分级沉淀各组分的血凝谱
研究了25%、30%、40%、50%、60%饱和硫酸铵沉淀组分对动物血细胞的凝集活性,结果发现25%沉淀组分的凝集活性最高,显示三疣梭子蟹凝集素主要在25%硫酸铵饱和度析出。与血清的血凝谱相比,在30%、40%组分时凝集活性已经较低,而到50%和60%组分时已经基本没有凝集活性(表1)。
2.7SDS-PAGE电泳结果
各盐析组分样品以10 μg蛋白上样,用考马斯亮蓝快速染色液染色蛋白条带。由图3可见,各泳道均有大量蛋白存在于72~95 ku,还须进一步纯化得到单一凝集素条带。
3结论与讨论
目前关于三疣梭子蟹凝集素特性的研究较少,仅有报道比较了包括三疣梭子蟹在内的3种梭子蟹血清凝集素的细胞凝集活性[16]。本研究较为系统地研究了三疣梭子蟹血清凝集素的特性,结果表明:三疣梭子蟹血清凝集素对鲫鱼、中华鳖、草鱼、鸡和人类A、B、O型血细胞没有凝集作用,但是对小鼠、兔的血细胞具有较高的凝集活性,其中对小鼠血细胞的凝集活性高达210,这与梁青龙等的报道[16]一致,但该文没有选择小鼠红细胞,测出兔细胞的凝集活性最高。本研究结果也与郝珂等报道的有关锯缘青蟹血清凝集素的凝集特性[21-22]相似。因此,选择小鼠红细胞作为研究三疣梭子蟹血清凝集素特性的指示细胞,三疣梭子蟹凝集活性随着盐度的升高而降低,在盐度大于0.6 mol/L时基本失活;凝集素作用的最适pH值为 6.0~7.4。已有研究表明,无脊椎动物的血细胞凝集素在发挥凝集活动作用时,常须要一些二价金属离子的参与[5],本研究选择常见的二价金属离子Ca2+、Mg2+,结果表明梭子蟹的血清凝集素对Ca2+、Mg2+有明显依赖性,而且金属离子螯合剂EDTA可以明显抑制其凝集活性,说明在三疣梭子蟹血清凝集素的凝集活动中,二价金属离子是必不可少的。
甲壳类动物血清凝集素可与多种糖类发生特异性结合,凝集红细胞的特性实际是和糖基位点发生作用,所以其结合也会被相应的糖类所抑制。本研究分析了三疣梭子蟹血清凝集素对9种常见糖的敏感性,发现GlcNAc、ManNAc可特异性抑制血清凝集素的活性,表明梭子蟹凝集素的主要识别位点为GlcNAc、ManNAc,该结果与文献报道的N-乙酰基糖类和唾液酸类糖蛋白是甲壳类动物体内凝集素具有特异性结合的主要2种糖基位点的结果[26]一致。
本研究采用(NH4)2SO4分级沉淀法对梭子蟹血清进行了初步分离,发现其凝集素的活力区主要在25%饱和(NH4)2SO4区,具有很高的凝集活性,并且对GlcNAc、ManNAc 有特异性结合。SDS-PAGE结果表明,纯化蛋白集中存在于72 ~95 ku。50%饱和(NH4)2SO4区蛋白含量特别高,蛋白大小区域与25%饱和(NH4)2SO4区差不多,但其凝集活性很低,效价仅为21 ,推测该部分主要为梭子蟹的血蓝蛋白成分。这与以往报道的虾类血蓝蛋白具有一定的凝集活性,可与脊椎动物红细胞产生凝集反应的结果[27]有些不一致。本研究结果为进一步分离纯化提取三疣梭子蟹血清凝集素及研究其特性和功能奠定了良好基础。
参考文献:
[1]Hamasaki K,Fukunaga K,Kitada S. Batch fecundity of the swimming crab Portunus trituberculatus (Brachyura: Portunidae)[J]. Aquaculture, 2006, 25(1): 359-365.
[2]王国良,金珊,李政,等. 三疣梭子蟹(Portunus trituberculatus)乳化病的组织病理和超微病理研究[J]. 海洋与湖沼,2006,37(4):297-303.
[3]刘淇,李海燕,王群,等. 梭子蟹牙膏病病原菌——溶藻弧菌的鉴定及其系统发育分析[J]. 海洋水产研究,2007,28(4):9-13.
[4]孙册,朱政,奠汉庆. 凝集素[M]. 北京:科学出版社,1986.
[5]Dodd R B,Drickamer K. Lectin-like proteins in model organisms: implications for evolution of carbohydrate-binding activity[J]. Glycobiology, 2001, 11(5): 71R-79R.
[6]Vasta G R, Ahmed H, Odom E W. Structural and functional diversity of lectin repertoires in invertebrates, protochordates and ectothermic ertebrates vertebrates[J]. Current Opinion in Structural Biology, 2004, 14(5): 617-630.
[7]陈皓文,孙丕喜,宋庆云. 外源凝集索——水产动物御敌的有力兵器[J]. 黄渤海海洋,1995,13(3):61-70.
[8]彭其胜,郭文场,杨振国,等. 中国对虾血淋巴液中的凝集素[J]. 中国水产科学,2000,7(4):14-18.
[9]曹剑香,简纪常,吴灶和,等. 凡纳滨对虾血清凝集素、溶血素的特性研究[J]. 海洋科学,2006,30(6):1-5.
[10]Wang H,Song L S,Li C H,et al. Cloning and characterization of a novel C-type lectin from Zhikong scallop Chlamys farreri[J]. Molecular Immunology,2007,44(5): 722-731.
[11]Wang X W,Xu W T,Zhang X W,et al. A C-type lectin is involved in the innate immune response of Chinese white shrimp[J]. Fish & Shellfish Immunology,2009,27(4): 556-562.
[12]Sun Y D,Fu L D,Jia Y P,et al. A hepatopancreas-specific C-type lectin from the Chinese shrimp Fenneropenaeus chinensis exhibits antimicrobial activity[J]. Molecular Immunology,2008,45(2):348-361.
[13]Sun J,Wang L,Wang B J,et al. Purification and characterisation of a natural lectin from the serum of the shrimp Litopenaeus vannamei[J]. Fish & Shellfish Immunology,2007,23(2):292-299.
[14]Liu Y C,Li F H,Dong B,et al. Molecular cloning, characterization and expression analysis of a putative C-type lectin (Fclectin) gene in Chinese shrimp Fenneropenaeus chinensis[J]. Molecular Immunology,2007,44(4):598-607.
[15]Kong H J,Park E M,Nam B H,et al. A C-type lectin like-domain (CTLD)-containing protein (PtLP) from the swimming crab Portunus trituberculatus[J]. Fish & Shellfish Immunology,2008, 25(3):311-314.
[16]梁青龙,戴聪杰,陈寅山. 三种梭子蟹血清凝集素的细胞凝集活性比较[J]. 福建水产,2005(2):45-50.
[17]曹广力,朱越雄,薛仁宇,等. 中华绒螯蟹血清中外源凝集素的凝集作用及影响因素[J]. 水产养殖,1999(5):16-18.
[18]Zhang H,Chen L Q,Qin J,et al. Molecular cloning, characterization and expression of a C-type lectin cDNA in Chinese mitten crab, Eriocheir sinensis[J]. Fish & Shellfish Immunology,2011,31(2): 358-363.
[19]Na Y J,Kim Y J,Park B T,et al. A novel lectin isolated from the hemolymph of the Marine hair crab Erimacrus isenbeckii[J]. Protein and Peptide Letters,2007,14(8):800-803.
[20]戴聪杰,王桂忠,何剑锋,等. 锯缘青蟹(Scylla serrata)凝集素的分布及部分性质研究[J]. 厦门大学学报:自然科学版,2005,44(4):555-558.
[21]郝珂,钱冬,刘问,等. 锯缘青蟹血清凝集素的特性和盐析提取研究[J]. 淡水渔业,2008,38(4):7-11.
[22]郝珂,钱冬,刘问,等. 锯缘青蟹凝集素的提取及单克隆抗体制备[J]. 水产学报,2009,33(4):590-596.
[23]奥斯伯F,布伦特R,金斯顿R E,等. 精编分子生物学实验指南[M]. 金由辛,译. 北京:科学出版社,1999.
[24]戴华生. 新实验病毒学[M]. 北京:中国学术出版社,1983.
[25]汪家政,范明. 蛋白质技术手册[M]. 北京:科学出版社,2000.
[26]孙杰,安利国,王雷,等. 甲壳纲动物凝集素的结构特征和分离纯化方法[J]. 海洋科学,2006,30(6):73-76.
[27]Zhang Y L,Wang S Y,Xu A L,et al. Affinity proteomic approach for identification of an IgA-like protein in Litopenaeus vannamei and study on its agglutination characterization[J]. Journal of Proteome Research,2006,5(4):815-821.
