短期颈动脉压力感受器电刺激对犬心肌缺血再灌注损伤的影响
2015-04-14萨仁高娃
阳 康,廖 凯,萨仁高娃,黄 兵,江 洪
(武汉大学人民医院心内科,湖北 武汉 430060)
·论 著·
短期颈动脉压力感受器电刺激对犬心肌缺血再灌注损伤的影响
阳 康,廖 凯,萨仁高娃,黄 兵,江 洪
(武汉大学人民医院心内科,湖北 武汉 430060)
目的 评价短期颈动脉压力感受器电刺激(Carotid baroreceptors stimulation,CBS)对犬心肌缺血再灌注损伤的影响。方法36只成年杂种犬随机分为三组(n=12):假手术组(Sham组),缺血再灌注组(I/R组)和颈动脉压力感受器刺激组(CBS组)。I/R组和CBS组分别结扎左冠脉前降支1 h和再灌注6 h完成心肌缺血再灌注损伤模型,Sham组只穿线不结扎冠脉。CBS组在心肌缺血前2 h对右侧颈动脉窦开始进行高频电刺激,一直持续到实验结束,刺激参数:频率50 Hz,脉宽0.5 ms,刺激强度随血压进行调整,以保持血压较刺激前下降10%。于缺血前(基础状态)、缺血15 min、30 min、60 min和再灌注0.5 h、2 h、6 h时记录心率(HR)和平均动脉压(MAP)。各组随机抽取6只犬于于再灌注6 h后采用依文斯兰-氯化三苯基氮唑(TTC)双染色法检测心肌缺血和心肌梗死面积。各组剩余6只犬于再灌注6 h分别经颈内静脉采血,采用ELISA法检测血清TNF-α、IL-1β、IL-6。采血后,迅速取出缺血区心肌组织,检测髓过氧化物酶(MPO)活性观察中性粒细胞浸润情况。结果与Sham组比较,I/R组和CBS组心肌梗死面积,MPO活性,血清TNF-α、IL-1β、IL-6含量升高(P<0.05);与I/R组比较,CBS组心肌梗死面积,MPO活性,血清TNF-α、IL-1β、IL-6含量降低(P<0.05)。结论短期颈动脉压力感受器电刺激可减轻犬心肌缺血再灌注损伤,其机制与抑制中心粒细胞向缺血组织浸润以及抑制炎症反应有关。
颈动脉压力感受器电刺激;心肌缺血再灌注损伤;炎症反应
在发达国家,心肌梗死是引起死亡的主要原因[1]。再灌注治疗是应对急性心肌梗死的最佳方法,但是挽救缺血心肌的同时也会导致再灌注损伤[2]。炎症反应在心肌缺血再灌注(I/R)损伤的发生和发展过程中发挥着极为重要的作用。在心肌缺血时炎症介质对损伤组织的愈合必不可少,但是当缺血部位再灌注后,过度的炎症反应反而会加重心肌损伤[3]。现已证明,迷走神经刺激能够减小心肌I/R损伤,其机制与激活迷走神经后通过胆碱能抗炎通路(CAP)抑制炎症反应有关[4-5]。
动脉压力感受性反射(ABR)是心血管活动最重要的调节机制。既往的研究表明长期颈动脉压力感受器电刺激(CBS)治疗顽固性性高血压安全可行[6-9]。在犬心衰模型中,长期CBS可改善心功能,逆转心肌重塑,并与上调心脏β受体活性和NO合酶有关,提示长期CBS可能具有抗炎的作用[10-11]。因此,我们提出一个假设,短期CBS可能在心肌缺血再灌注损伤时同样具有保护心肌的作用,其机制可能与CBS抑制炎症反应有关。
1 材料与方法
1.1 实验动物及模型的建立 健康成年杂种犬36只,体重14~22 kg,均为雄性,由武汉大学人民医院动物中心提供。戊巴比妥钠30 mg/kg前肢静脉麻醉,以后每小时追加2 mg/kg维持麻醉状态。气管插管接动物呼吸机,分离一侧股、动静脉置入6F鞘管,动脉通道连接压力换能器监测血压,静脉通道用于滴注生理盐水补液。颈部脱毛备皮消毒后,在左侧锁骨上水平暴露左侧颈内静脉备采血标本。空调室温控制在25℃~30℃,整个实验过程中,犬下方放置电热板以维持犬正常体温。持续记录体表心电图(LEAD2000)。右颈动脉窦位于右颈总动脉和颈内动脉分叉处的膨大组织。在右侧下颌骨下方暴露左颈动脉窦,用一小片封口膜隔离周围组织。将一个特制的银-氯化银刺激电极围绕颈动脉窦植入,并连接到脉冲发生器(SEN-7103,日本光电,日本东京)。在3~5 min内预先刺激3~4次确认血压和心率明显下降,然后再妥善安置电极。颈动脉窦的刺激参数为:频率50 Hz,脉宽0.5 ms,刺激强度为引起血压下降10%的电压强度(3~7 V)[11]。然后经左侧第4肋间开胸,剪开心包,暴露心脏。于冠状动脉左前降支第对角支、第二对角支之间穿针引线(2-0#无创丝线),连同一小段硬质圆钝头的塑料管一起结扎,造成缺血,及时记录心电图的改变。结扎成功的标准:心肌缺血区局部发绀,同步Ⅱ导联ECG显示ST段明显抬高,缺血期间出现室性心律失常。结扎1 h后,在硬质塑料管上切断结扎线,恢复冠脉血流再灌注6 h。再灌注成功的标准:缺血区局部颜色变红,同步Ⅱ导联ECG显示ST段逐渐恢复到缺血前水平,并出现再灌注室性心律失常[12]。
1.2 实验分组及干预 36只犬随机分为3组(每组12只):(1)Sham组:分离右颈动脉窦,植入电极,不开启颈动脉窦刺激仪;开胸,分离左冠状动脉并穿线,但不结扎。(2)I/R组:分离右颈动脉窦,植入电极,不开启颈动脉窦刺激仪;结扎左冠脉前降支1 h,再灌注6 h。(3)CBS组:分离右颈动脉窦,植入电极,结扎冠脉前先预刺激颈动脉窦2 h,直至再灌注6 h;缺血1 h,再灌注6 h。
1.3 血流动力学监测 在实验全程中,采用LEDE2000多导电生理仪连续监测犬的心率(HR)、动脉收缩压,舒张压、平均动脉压(MAP)和Ⅱ导联心电图。记录心肌缺血前的HR和MAP,将该数值作为基础值。然后记录缺血15 min、30 min、60 min和再灌注0.5 h、2 h、6 h时的HR和MAP。
1.4 心肌梗死面积的测定 各组随机抽取6只犬,于再灌注6 h后处死动物,立即取下心脏,用生理盐水冲洗干净。采用依文斯兰-TTC双染色法测定心肌梗死面积。正常非缺血区染为蓝色,梗死区(AN)呈灰白色,缺血非梗死区呈砖红色,缺血心肌面积(AAR)为灰白色和砖红色之和。对获得的数码相片采用Photoshop CS3 Extended软件(Adobe公司,美国)进行测量处理,分别计算各部分的面积。缺血范围用AAR与左室面积之比表示,梗死范围以AN与AAR之比表示。
1.5 血清炎症因子和心肌MPO活性的检测 各组剩下的6只犬,于再灌注6 h经颈内静脉采血,采用ELISA法检测血清TNF-α、IL-1β、IL-6的浓度。具体操作步骤完全按照试剂盒说明书进行。采血结束后处死动物,迅速缺血区心肌组织,并用生理盐水冲洗干净。采用分光光度法测定髓过氧化物酶(MPO)活性,试剂盒均由武汉博士德生物工程有限公司提供。
1.6 统计学方法 所有计量资料首先采用进行正态分布检验,符合正态分布的计量资料采用均数±标准差(±s)表示。应用SPASS17.0统计软件对实验数据进行分析。多组间比较采用单因素方差分析,组间两两比较应用q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组犬血流动力学检测结果比较 各组犬的HR、MAP比较差异均无统计学意义(P>0.05),见表1。
2.2 各组犬心肌梗死面积检测结果比较 Sham组未观察到心肌梗死,CBS组心肌梗死面积和缺血面积明显低于I/R组,差异有统计学意义(P<0.05),见表2。
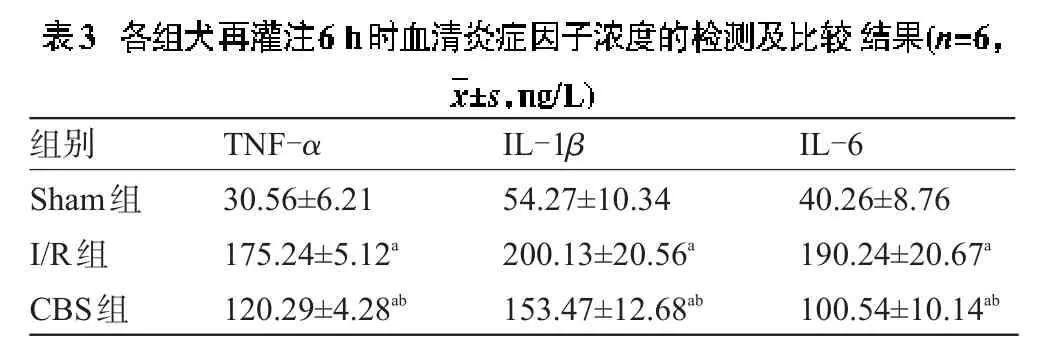
2.3 各组犬再灌注6 h时血清炎症因子浓度的检测结果比较 I/R组和CBS组心肌再灌注6 h时血清TNF-α、IL-1β和IL-6均明显高于Sham组,CBS组心肌再灌注6 h时血清TNF-α、IL-1α和IL-6浓度均明显低于I/R组,差异均有统计学意义(P<0.05),见表3。
表1 各组犬缺血期和再灌注期血流动力学指标(±s)
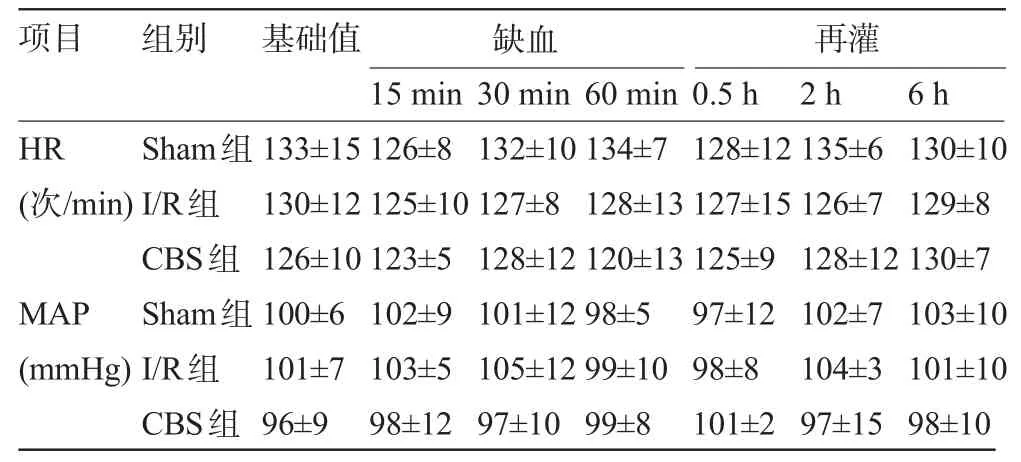
表1 各组犬缺血期和再灌注期血流动力学指标(±s)
注:1 mmHg=0.133 kPa。
130±10 129±8 130±7 103±10 101±10 98±10 HR (次/min) MAP (mmHg) Sham组I/R组CBS组Sham组I/R组CBS组133±15 130±12 126±10 100±6 101±7 96±9 126±8 125±10 123±5 102±9 103±5 98±12 132±10 127±8 128±12 101±12 105±12 97±10 134±7 128±13 120±13 98±5 99±10 99±8 128±12 127±15 125±9 97±12 98±8 101±2 135±6 126±7 128±12 102±7 104±3 97±15
表2 各组犬心肌梗死面积的检测及比较结果(n=6,±s,%)

表2 各组犬心肌梗死面积的检测及比较结果(n=6,±s,%)
注:与Sham组比较,aP<0.05;与I/R组比较,bP<0.05。
I/R组CBS组0±0 25.6±3.2a15.4±3.6ab0±0 32.4±5.1a20.5±3.2ab
注:与Sham组比较,aP<0.05;与I/R组比较,bP<0.05。
2.4 各组犬心肌缺血区中性粒细胞浸润情况比较 Sham组未进行心肌缺血,因此未见中性粒细胞浸润。I/R组可观察到大量密集的中性粒细胞浸润到心肌缺血区。CBS组心肌缺血区可见中性粒细胞的浸润程度显著下降。Sham组、I/R组、CBS组犬心肌缺血区MPO活性分别为(2.27±0.58)U/g,(20.14±3.27)U/g,(13.62±4.17)U/g。与Sham组比较,I/R组、CBS组MPO活性均显著增高(P<0.05)。CBS组的MPO活性显著低于I/R组(P<0.05)。
3 讨论
既往研究证实长期CBS能有效治疗顽固性性高血压和心力衰竭[6-11],但还没有研究报道短期CBS是否能够减低心肌I/R损伤。本研究结果表明短期CBS能明显减低心肌I/R损伤,表现为CBS降低心肌梗死面积。其次,短期CBS可以抑制心肌缺血区中性粒细胞的浸润,抑制全身炎症因子的表达,从而减轻缺血再灌注引起的组织损伤。
缺血再灌注时过度的炎症反应是导致心肌I/R损伤主要的致病机制之一[13]。再灌注后形成的大量活性氧自由基(ROS)和补体激活可以直接触发炎症反应,诱发心肌组织内大量炎症细胞浸润和炎症因子表达,进而导致心肌损伤[14-15]。在再灌注的早期阶段,大量募集至缺血区心肌组织的中性粒细胞可释放蛋白水解酶,氧化剂,表达炎症细胞因子,粘附分子和趋化因子等致病物质,最终导致心肌I/R损伤的形成[16]。既往研究也证实,通过抑制缺血区心肌组织内中性粒细胞聚集与浸润,降低MPO活性,能够减轻I/ R损伤所引起心肌细胞凋亡,减轻心肌梗死面积和改善再灌注后心功能[17]。中性粒细胞的活化和浸润是介导炎症反应的关键环节[18],我们的研究发现,在缺血再灌注6 h后心肌缺血区可见大量中性粒细胞浸润,MPO活性显著升高,说明中性粒细胞在炎症反应介导的心肌细胞损伤中发挥了重要作用。
再灌注早期阶段,可在犬心肌梗死区及周围发现大量由炎症细胞释放的细胞因子[19-20](TNF-α、IL-1β、IL-6等),细胞粘附分子[21](ICAM-1等)和趋化因子[22](IL-8等)及其他炎症介质。TNF-α、IL-1α可以结合至细胞表面受体并触发细胞内信号级联反应,激活NF-кB进一步诱导大量促炎因子的释放,包括TNF-α、IL-1β、IL-6等,从而引发“炎症瀑布”,促进细胞凋亡,加重心肌损伤[23]。
颈动脉压力感受器是ARB的感受装置。当动脉血压升高时,通过颈动脉压力感受器和ARB传入神经,中枢神经系统可感受刺激信号,随后减少ABR传出神经神经冲动,导致血压和交感神经活性降低。电刺激颈动脉压力感受器可以明显降低血压正是基于这一机理。近年来,利用新一代颈动脉压力感受器刺激仪Rheos,展开了一系列的动物实验和临床研究。研究表明,慢性CBS可以明显抑制血管、心脏、肾脏的交感神经活性,同时提高迷走神经活性,从而起到长期降低血压的作用[24]。Sabbah等[11]的研究提示CBS具有局部抗炎的作用并能改善心力衰竭衰犬的心功能。而本研究利用犬缺血再灌注模型证实了CBS能通过抑制急性炎症反应及细胞凋亡,减轻心肌I/R损伤,从而发挥心肌细胞保护作用。我们推测,CBS能够调控炎症反应的机制可能是激活迷走神经后通过胆碱能抗炎通路(CAP)抑制炎症反应[4-5],或是通过激活下丘脑-垂体-肾上腺(HPA)轴抗炎[25],或是两者之间的协同作用。这有待于我们进一步研究明确。
本研究的不足之处在于我们并不清楚电刺激左侧颈动脉压力感受器是否具有同样的效果。由于我们观察到电刺激右侧颈动脉窦对血压和心率的影响更加明显,且为了在一个给定的水平调整刺激强度,所以我们只选择了电刺激右侧颈动脉压力感受器。其次,我们并没有设置将心率固定的对照组用以研究CBS的心肌保护。既往研究表明,降低心率能够降低心肌氧耗量、增加心脏舒张灌注时间和增加侧枝冠脉血流分布,从而减轻心肌I/R损伤[26-27]。本研究中CBS对心肌的保护作用是否含有心率降低的效应?由于心率降低的幅度小于10%,因此我们推测心率减慢可能并不是主要机制。
综上所述,CBS同迷走神经刺激一样,具有明显调节炎症反应,维持机体稳态的功能。与应用药物抑制单纯某个炎症介质或细胞相比,CBS发挥机体生理功能的调节,具有快速、直接、局限、整合地调节炎症反应的特点。我们的研究结果加深了对CBS调节心血管疾病发挥的潜在作用及其机制的认识,同时为治疗缺血再灌注提供一个新策略,为临床治疗提供了试验依据和全新的研究思路。
[1]Roger VL,Go AS,Lloyd-Jones DM,et al.Executive summary:heart disease and stroke statistics—2012 update a report from the American HeartAssociation[J].Circulation,2012,125(1):188-197.
[2]Yellon DM,Hausenloy DJ.Myocardial reperfusion injury[J].New England Journal of Medicine,2007,357(11):1121-1135.
[3]Entman ML,Smith CW.Postreperfusion inflammation:a model for reaction to injury in cardiovascular disease[J].Cardiovascular research,1994,28(9):1301-1311.
[4]Steffens S,Montecucco F,Mach F.The inflammatory response as a target to reduce myocardial ischaemia and reperfusion injury[J]. Thromb Haemost,2009,102(2):240-247.
[5]Ottani A,Giuliani D,Galantucci M,et al.Melanocortins counteract inflammatory and apoptotic responses to prolonged myocardial ischemia/reperfusion through a vagus nerve-mediated mechanism[J]. European Journal of Pharmacology,2010,637(1):124-130.
[6]Wustmann K,Kucera JP,Scheffers I,et al.Effects of chronic baroreceptor stimulation on the autonomic cardiovascular regulation in patients with drug-resistant arterial hypertension[J].Hypertension, 2009,54(3):530-536.
[7]Heusser K,Tank J,Engeli S,et al.Carotid baroreceptor stimulation, sympathetic activity,baroreflex function,and blood pressure in hypertensive patients[J].Hypertension,2010,55(3):619-626.
[8]Scheffers IJM,Kroon AA,Schmidli J,et al.Novel baroreflex activation therapy in resistant hypertension results of a European multi-center feasibility study[J].Journal of the American College of Cardiology,2010,56(15):1254-1258.
[9]Bisognano JD,Bakris G,Nadim MK,et al.Baroreflex activation therapy lowers blood pressure in patients with resistant hypertensionresults from the double-blind,randomized,placebo-controlled rheos pivotal trial[J].Journal of the American College of Cardiology,2011,58(7):765-773.
[10]Zucker IH,Hackley JF,Cornish KG,et al.Chronic baroreceptor activation enhances survival in dogs with pacing-induced heart failure [J].Hypertension,2007,50(5):904-910.
[11]Sabbah HN,Gupta RC,Imai M,et al.Chronic electrical stimulation of the carotid sinus baroreflex improves left ventricular function and promotes reversal of ventricular remodeling in dogs with advanced heart failure[J].Circulation:Heart Failure,2011,4(1):65-70.
[12]Schulze CJ,Wang W,Suarez-Pinzon WL,et al.Imbalance between tissue inhibitor of metalloproteinase-4 and matrix metalloproteinases during acute myoctardial ischemia-reperfusion injury[J].Circulation,2003,107(19):2487-2492.
[13]Hausenloy DJ,Yellon DM.Myocardial ischemia-reperfusion injury: a neglected therapeutic target[J].The Journal of Clinical Investigation,2013,123(1):92-100.
[14]Zweier JL,Talukder MAH.The role of oxidants and free radicals in reperfusion injury [J].Cardiovascular Research,2006,70(2): 181-190.
[15]Hill JH,Ward PA.The phlogistic role of C3 leukotactic fragment in myocardial infarcts of rats[J].J Exp Med,1971,133(4):885-890.
[16]Vinten-Johansen J.Involvement of neutrophils in the pathogenesis of lethal myocardial reperfusion injury[J].Cardiovascular Research,2004,61(3):481-497.
[17]Zhang Y,Sun Q,He B,et al.Anti-inflammatory effect of hydrogen-rich saline in a rat model of regional myocardial ischemia and reperfusion[J].International Journal of Cardiology,2011,148(1): 91-95.
[18]Jordan JE,Zhao ZQ,Vinten-Johansen J.The role of neutrophils in myocardial ischemia-reperfusion injury[J].Cardiovascular Research,1999,43(4):860-878.
[19]Frangogiannis NG,Lindsey ML,Michael LH,et al.Resident cardiac mast cells degranulate and release preformed TNF-α,initiating the cytokine cascade in experimental canine myocardial ischemia/reperfusion[J].Circulation,1998,98(7):699-710.
[20]Gwechenberger M,Mendoza LH,Youker KA,et al.Cardiac myocytes produce interleukin-6 in culture and in viable border zone of reperfused infarctions[J].Circulation,1999,99(4):546-551.
[21]Youker KA,Hawkins HK,Kukielka GL,et al.Molecular evidence for induction of intracellular adhesion molecule-1 in the viable border zone associated with ischemia-reperfusion injury of the dog heart[J].Circulation,1994,89(6):2736-2746.
[22]Frangogiannis NG,Mendoza LH,Lindsey ML,et al.IL-10 is induced in the reperfused myocardium and may modulate the reaction to injury[J].The Journal of Immunology,2000,165(5):2798-2808.
[23]Kleinbongard P,Schulz R,Heusch G.TNFα in myocardial ischemia/ reperfusion,remodeling and heart failure[J].Heart Failure Reviews,2011,16(1):49-69.
[24]Lohmeier TE,Iliescu R.Chronic lowering of blood pressure by carotid baroreflex activation mechanisms and potential for hypertension therapy[J].Hypertension,2011,57(5):880-886.
[25]De Herdt V,Puimège L,De Waele J,et al.Increased rat serum corticosterone suggests immunomodulation by stimulation of the vagal nerve[J].Journal of Neuroimmunology,2009,212(1):102-105.
[26]Maroko PR,Kjekshus JK,Sobel BE,et al.Factors influencing infarct size following experimental coronary artery occlusions[J].Circulation,1971,43(1):67-82.
[27]Redwood DR,Smith ER,Epstein SE.Coronary artery occlusion in the conscious dog effects of alterations in heart rate and arterial pressure on the degree of myocardial Ischemia[J].Circulation, 1972,46(2):323-332.
Effect of short-term carotid baroreceptors stimulation on myocardial ischemia reperfusion injury in dogs.
YANG Kang,LIAO Kai,SA Ren-gao-wa,HUANG Bing,JIANG Hong.
Department of Cardiology,People's Hospitial of Wuhan University,Wuhan 430060,Hubei,CHINA
ObjectiveTo evaluate the effect of short-term carotid baroreceptors stimulation(CBS)on myocardial ischemia reperfusion injury(IRI).MethodsThirty-six adult dogs were randomly divided into three groups (n=12):Sham group,ischemia reperfusion group(I/R group)and carotid baroreceptors stimulation group(CBS group). Dogs in I/R group and CBS group were given respectively 1 h left anterior descending coronary artery(LAD)ligation and 6 h reperfusion to complete IRI models,while dogs in Sham group received only threading.In CBS group,high frequency stimulations were performed on the right carotid sinus from 2 h before myocardial ischemia to the end of experiment(stimulation parameters:frequency 50 Hz,pulse width:0.5 ms,stimulation intensity adjusted according to blood pressure so as to keep the blood pressure down 10%before stimulation).Heart rate(HR)and mean arterial pressure(MAP)were recorded before ischemia,15 min,30 min and 60 min after ischemia,and 0.5 h,2 h and 6 h after reperfusion.Six dogs from each group were randomly selected to test the area of myocardial ischemia and myocardial infarction by Evans blue-triphenyl tetrazolium chloride(TTC)double-staining method at 6h after reperfusion.Internal jugular vein blood of the rest 6 dogs from each group were collected at 6 h after reperfusion,and serum TNF-α,IL-1β and IL-6 were tested by ELISA.After blood collection,we quickly took out the ischemic myocardial tissues to detect the infiltration of neutrophil cells through myeloperoxidase(MPO)activity observation.ResultsCompared with Sham group,the infarction area,MPO activity,serum levels of TNF-α,IL1-β and IL-6 of I/R group and CBS group were increased(P<0.05);compared with IR group,all the above indexes of CBS group were lower(P<0.05).ConclusionCarotid baroreceptors stimulation can reduce myocardial ischemia reperfusion injury.And the mechanism may be associated with the suppression of neutrophil infiltration and inflammatory reaction.
Carotidbaroreceptorsstimulation;Myocardialischemiareperfusioninjury;Inflammatoryreaction
R-332
A
1003—6350(2015)02—0157—04
10.3969/j.issn.1003-6350.2015.02.0056
2014-10-07)
国家自然科学基金(编号:81270339;81170195;81300812)、湖北省自然科学基金(编号:2013CFB302)、武汉市科技攻关项目(编号:2013060602010271)、武汉大学青年教师自主科研项目(编号:2042012121087)、武汉大学2012年博士研究生自主科研项目(编号:2012302020206)
江 洪。E-mail:jianghong58@gmail.com
