L-NAME对实验性自身免疫性心肌炎的保护作用
2015-04-13彭锦李铁岭韩丽娜林晓明何爽
彭锦,李铁岭,韩丽娜,林晓明,何爽
(1.中国人民解放军第187中心医院心内科,海南海口571100;2.中国人民解放军总医院干部理疗科,北京100853;3.中国人民解放军总医院南楼心血管一科,北京100853)
L-NAME对实验性自身免疫性心肌炎的保护作用
彭锦1,李铁岭2,韩丽娜3,林晓明1,何爽3
(1.中国人民解放军第187中心医院心内科,海南海口571100;2.中国人民解放军总医院干部理疗科,北京100853;3.中国人民解放军总医院南楼心血管一科,北京100853)
目的观察NG-硝基-L-精氨酸甲酯(L-NAME)对实验性自身免疫性心肌炎(EAM)Lewis大鼠模型的治疗效果,并探索可能的治疗机理。方法20只Lewis大鼠建立EAM动物模型:双足底注射心肌C蛋白片段和完全弗氏辅佐剂的油状混合物,腹腔注射百日咳毒素。大鼠随机等分为治疗组和模型对照组,每组各10只。治疗组腹腔注射5 mg·kg-1·d-1L-NAME,从免疫注射术后第1天开始连续20 d,1次/d。对照组相同时间内给予相同剂量生理盐水腹腔注射。治疗结束后第1天处死动物,心脏取材,进行系列检测。其中组织病理学石蜡切片苏木素-伊红(HE)染色检测心肌炎症分级,免疫组织化学染色检测T淋巴细胞浸润,天狼星红染色检测心肌胶原纤维含量,硝酸还原酶法检测NO水平,明胶酶谱法检测胶原酶活性。结果与对照组比较,L-NAME治疗组心肌炎症级别下降[(3.42±0.31)vs(2.51±0.22),P<0.01]、T淋巴细胞浸润数目减少[(28.2±4.6)vs(13.2±1.9),P<0.01]、心肌间质纤维化级别下降[(2.33±0.26)vs(1.14±0.17),P<0.01]、血清NO水平降低[(68.34±8.61)μmol/L vs(45.71±6.53)μmol/L,P<0.01],明胶酶活性降低[(254 526±4 729)vs(184 712±3 869),P<0.01]。结论L-NAME抑制EAM病理发展过程,其机制可能与通过降低NO水平和明胶酶活性,从而降低心肌炎症细胞浸润,延缓心肌间质纤维化有关。
心肌炎;L-NAME;一氧化氮;基质金属蛋白酶
自身免疫性心肌炎是扩张型心肌病和心力衰竭的主要病因之一。自身免疫性心肌炎(Experimental autoimmune myocarditis,EAM)大鼠模型病情类似人类免疫性心肌炎向扩张性心肌病和心力衰竭发展的病理过程[1]。一氧化氮(Nitric oxide,NO)作为一种气体自由基在心肌炎病理机制中可能起双重机制作用,一方面内皮源性NO有抑制炎症过程的作用;另一方面炎症过程后期大量生成的NO又加剧炎症反应,表现出细胞毒作用[2]。NG-硝基-L-精氨酸甲酯(NG-nitro-L-arginine methyl ester,hydrochloride,L-NAME)属于左旋精氨酸类似物,能够竞争性抑制一氧化氮合酶(Nitric oxide synthase,NOS)的活性,从而抑制NO的合成。本研究利用Lewis大鼠免疫注射重组心肌C-蛋白片段建立EAM模型,并使用L-NAME治疗,通过活体观察,检测心肌炎症细胞浸润和间质纤维化,判断治疗效果;并从NO和细胞外基质等方面,探讨NO在EAM病理中的生物学作用,以及L-NAME治疗EAM的机制,为临床治疗EAM提供理论依据。
1 材料与方法
1.1 动物免疫、分组及给药6~8周龄Lewis大鼠(购自北京维通利华生物制品所)20只,雌雄不限,SPF级动物室培养,建立EAM模型:双足底注射100 μg/kg心肌C蛋白和2.5 mg/ml完全弗氏佐剂等体积油状混合物200 μl,腹腔注射1 μg/ml百日咳毒素0.5 ml。大鼠随机等分为治疗组(n=10)和模型对照组(n=10)。治疗组给予100 μg/ml L-NAME(Sigma公司产品)5 mg·kg-1·d-1,腹腔注射,从免疫注射后第1天开始连续20 d,1次/d。模型对照组相同时间内给予相同剂量生理盐水腹腔注射。
1.2 取材
1.2.1 血清标本在制模后第8天大鼠称重,第21天心脏取血3 ml置于离心管中,4℃、3 000 r/min离心取上清,-80℃保存,用于检测NO含量。
1.2.2 心脏组织标本免疫注射第21天心脏取材。用10%水合氯醛腹腔注射麻醉生效后取心脏,电子天平称量心脏重量(g)。心脏从上向下按照等分成二部分。其中上部分放入4%多聚甲醛固定,用于病理组织学苏木素-伊红(Hematoxylin-eosin,HE)染色检测心肌炎症积分,天狼星红染色检测心肌胶原纤维含量,免疫组织化学染色检测心肌T细胞浸润;下部分OCT油覆盖,液氮预冷的异戊烷中凝固后,-80℃长期保存,冰冻组织切片用于原位明胶酶谱法检测明胶酶活性。
1.3 临床分级在免疫后第1周开始测量大鼠体重,观察大鼠呼吸、毛发和运动等,确定临床评分。临床评分标准:1级为呼吸困难或耸毛;2级为呼吸困难和耸毛;3级为死亡。
1.4 炎症积分检测心脏组织石蜡薄切HE染色用于炎症组织学分级。0级:无炎症;1级:心肌组织内散在分布炎细胞;2级:炎性细胞聚集成灶;3级:炎性细胞浸润侵犯心肌外膜;4级:部分心肌全层受炎性细胞浸润;5级:炎性细胞心肌内广泛浸润。
1.5 心肌纤维化积分检测并测定胶原含量(1)心肌纤维化积分检测:心脏组织石蜡薄切行0.1%饱和苦味酸天狼星红染色用于检测纤维化积分。5 μm切片自动染色装置脱蜡,0.2%磷钼酸溶液5 min,0.1%饱和苦味酸天狼星红溶液染色90 min,0.01 N盐酸分化2 min,常规梯度酒复水,二甲苯媒浸,封片。Zeiss Axion Cam MRC5偏振光显微镜下观察,纤维化组织学分级标准。0级:无纤维化;1级:少量纤维增生;2级:纤维聚集成片;3级:纤维增生累及心肌外膜;4级:部分心肌全层纤维增生;5级:心肌广泛纤维化。(2)胶原含量计算:物镜20倍放大倍数下拍照,每个标本照相10张。在同一区域首先普通光源下拍照,作为心肌总面积;然后偏振光状态下拍照,作为心肌纤维含量。NIH J 1.63 image图象处理软件,检测心肌总面积和胶原像素。取其平均值,作为该切片的心肌总面积像素和胶原像素。心肌胶原含量(%)=胶原像素/心肌像素×100%。
1.6 心肌T细胞浸润检测采用SP法,依照厂家产品说明书严格操作。主要试剂:小鼠抗大鼠T细胞抗原受体α/β(TCRα/β,R73)(美国BD公司)及SP试剂盒(北京中山生物技术有限公司)。同时以PBS代替一抗作阴性对照。物镜20倍放大倍数下拍照。每个标本照相10张,在分别计算每个视野下R73染色阳性的细胞数,然后计算其均数。
1.7 NO含量检测取0.1 ml实验动物血清和0.4 ml混合试剂混匀,37℃准确水浴60 min。空白对照组用0.1 ml双蒸水代替待测标本,标准对照组用0.1 ml标准工作液代替待测标本。各组分别加入0.2 ml Buffer C、0.1 ml Buffer D,充分旋涡混匀30 s,室温静置40 min,3 500~4 000 r/min,离心10 min,取上清显色。取各组0.5ml上清中加入0.6 ml显色剂混匀,室温静置10 min,蒸馏水调零,550 nm处,0.5 cm光径,蒸馏水调零,测各管吸光度值。根据样品OD值按公式计算NO含量。
1.8 明胶酶活性测定切厚度10 μm冰冻切片,-20℃保存,使用时室温内风干,滴加40 μg/ml DZ明胶,37℃孵育30 min,PBS清洗,VECTASHIELD封片,LEICATCS SP激光共聚焦显微镜下观察,扫描图像。图像用Photoshop和NIH 1.63软件计算图像像素。
1.9 统计学方法采用SPSS13.0软件运算。心肌组织炎症积分、间质纤维化积分、纤维含量、心肌T细胞浸润、血清NO水平以及心肌明胶酶活性数据均采用平均数±标准差(±s)表示,方差齐时采用双侧Student t检验,方差不齐采用Mann-Whitney U检验,α=0.05,P<0.05认为差异有统计学意义。
2 结果
2.1 活体观察模型对照组Lewis大鼠在免疫注射后12~14 d出现呼吸困难和耸毛,L-NAME治疗组在免疫注射后12~14 d表现轻度呼吸困难或耸毛。
2.2 心肌组织炎症积分与模型对照组比较,L-NAME治疗组大鼠心肌组织石蜡切片显示心肌组织炎症积分下降,具体结果见表1,治疗前后心肌HE染色对比图像见图1和图2。
表1 L-NAME对EAM大鼠心肌炎症分级、T淋巴细胞、纤维化分级和含量的影响(±s)
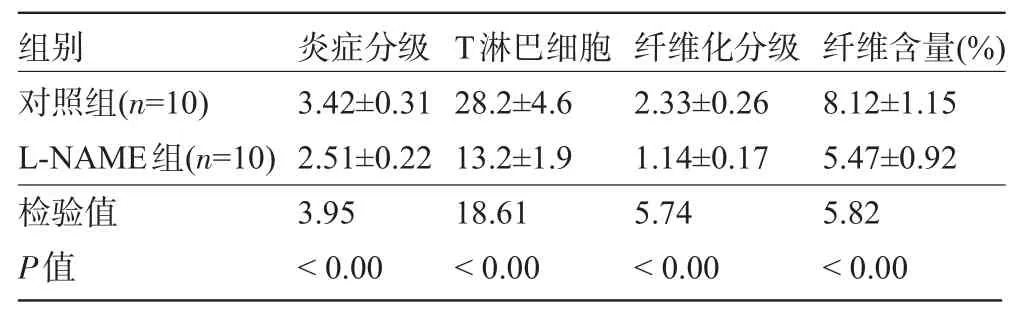
表1 L-NAME对EAM大鼠心肌炎症分级、T淋巴细胞、纤维化分级和含量的影响(±s)
组别对照组( n = 1 0 ) L -N A M E组( n = 1 0 )炎症分级3 . 4 2 ± 0 . 3 1 2 . 5 1 ± 0 . 2 2 T淋巴细胞2 8 . 2 ± 4 . 6 1 3 . 2 ± 1 . 9纤维化分级2 . 3 3 ± 0 . 2 6 1 . 1 4 ± 0 . 1 7纤维含量( % ) 8 . 1 2 ± 1 . 1 5 5 . 4 7 ± 0 . 9 2检验值P值3 . 9 5<0 . 0 0 1 8 . 6 1<0 . 0 0 5 . 7 4<0 . 0 0 5 . 8 2<0 . 0 0
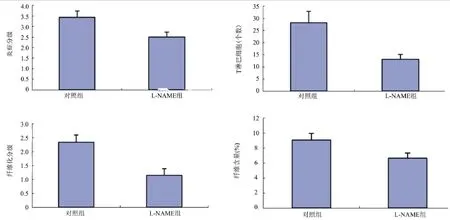
图1 L-NAME对EAM大鼠心肌炎症分级、T淋巴细胞、纤维化分级和含量的影响

图2 HE染色显示L-NAME治疗组(右图)和模型对照组(左图)心肌炎大鼠心肌炎症积分(×20)
2.3 心肌T淋巴细胞浸润与模型对照组比较,L-NAME治疗组大鼠心肌免疫组织化学染色显示T淋巴细胞浸润数目减少。具体结果见表1,治疗前后心肌T淋巴细胞浸润免疫组织化学染色见图1和图3。
2.4 心肌间质纤维化积分及纤维含量与模型对照组比较,L-NAME治疗组大鼠心肌组织天狼星红染色显示心肌间质纤维积分和纤维含量减少。具体结果见表1,治疗前后心肌间质纤维化天狼星红染色对比图像见图1和图4。
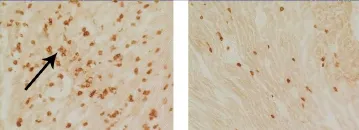
图3 免疫组织化学显示L-NAME治疗组(左图)和模型对照组(右图)心肌炎大鼠心肌T淋巴细胞浸润(×20)
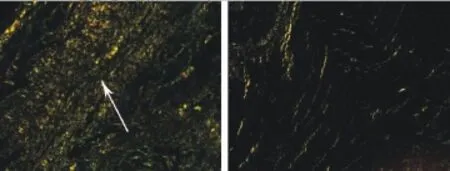
图4 苦味酸天狼星红染色显示L-NAME治疗组(左图)和模型对照组(右图)心肌炎大鼠心肌间质纤维含量(×20)
2.5 血清NO水平与模型对照组比较,L-NAME治疗组大鼠硝酸还原酶法检测血清NO水平降低,具体结果见表2和图5。
表2 L-NAME对EAM大鼠心肌iNOS mRNA、iNOS活性、NO浓度和胶原酶的影响(±s)
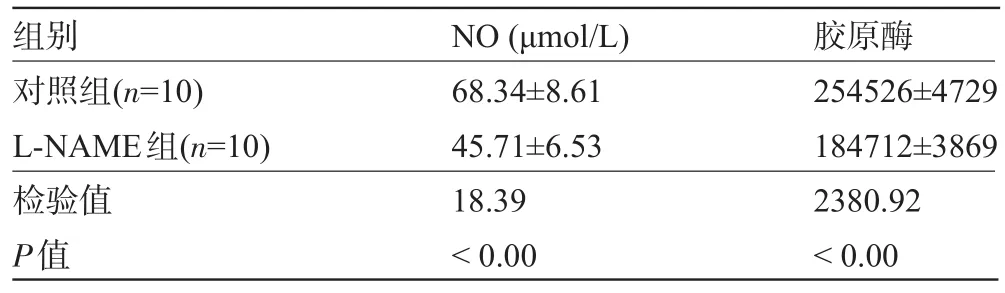
表2 L-NAME对EAM大鼠心肌iNOS mRNA、iNOS活性、NO浓度和胶原酶的影响(±s)
组别对照组(n=10) L-NAME组(n=10)检验值P值NO(μmol/L) 68.34±8.61 45.71±6.53 18.39<0.00胶原酶254526±4729 184712±3869 2380.92<0.00

图5 L-NAME对EAM大鼠血清NO浓度和心肌胶原酶的影响
2.6 明胶酶活性检测与模型对照组比较,L-NAME治疗组大鼠明胶酶谱法测定明胶酶活性降低,具体结果见表2和图5,治疗前后明胶酶活性对比见图6。

图6 胶酶谱法显示L-NAME治疗组(左图)和模型对照组(右图)肌炎大鼠明胶酶活性(×40)
3 讨论
实验动物免疫注射心肌自身抗原建立自身免疫性心炎动物模型是一种常用的研究方法。心肌C蛋白是心肌肌凝蛋白结合蛋白的一种,与心肌肌凝蛋白比较,具有更强致心肌炎作用[3]。
饱和苦味酸天狼星红染色,偏振光显微镜下可以显示心肌间质纤维。心脏间质胶原主要为Ⅰ、Ⅲ胶原相互联结组成,心肌Ⅰ型胶原纤维显示黄色或红色强的双折光性,负责维持心肌张力;心肌Ⅲ型胶原纤维显示绿色弱的双折光性,负责心肌弹性回缩储备能量。本研究对照组心肌天狼星红染色证实大鼠免疫注射后3周时心肌纤维化已经出现,特点是Ⅰ型胶原面积和含量较Ⅲ胶原增加更多;心肌内、外膜下和血管周围纤维化更突出。纤维化过程中的胶原纤维类型比例平衡的改变,导致心脏弹性和张力改变。
自身免疫性心肌炎的机理是抗原递呈细胞向T细胞递呈免疫注射的心肌自身抗原和提供共刺激分子,使T细胞激活,启动机体体液免疫和细胞免疫,导致细胞毒性T淋巴细胞等心肌局部浸润破坏心肌,Th2等刺激机体产生自身抗体[4]。因此,本实验选择心肌T淋巴细胞作为衡量心脏免疫功能激活状态指标。Αβ T细胞是参与免疫应答的主要细胞群,R73是其表面特异性标志。
NO是一种重要的调节生理功能的气体自由基,它是由NOS催化左旋精氨酸而合成的。NO具有本身生物功能和细胞毒性两面性。正常情况下,NO由构成型一氧化氮合酶(Constitutive nitric oxide synthase,cNOS)催化而成,浓较低,发挥生理作用。当内皮细胞受到外界刺激时,低活性状态下的iNOS被激活催化左旋精氨酸生成浓度较高NO[5]。NO穿过细胞膜和线粒体膜等生物膜,修饰蛋白的巯基、血红素辅基、铁硫中心及细胞膜磷脂等,抑制线粒体呼吸链复合体的作用或启动细胞凋亡程序,造成心肌损伤[6-7]。另外NO可诱发线粒体内膜脂质过氧化,导致内皮损伤从而激活了炎性细胞[8]。NO还可以和超氧阴离子自由基快速结合,生成过氧亚硝酸盐损伤生物体[9]。
近年来研究表明,基质蛋白酶(Matrix metalloprotein,MMP)在心肌炎发生和发展过程中起着重要作用,抑制该酶可以阻断对细胞外基质的破坏,从而阻断炎症的蔓延和发展[10]。但关于L-NAME与MMP关系的研究比较少。本实验证实L-NAME治疗能降低心肌炎大鼠心肌MMP活性。
综上所述,NO对于EAM病情发展发挥重要作用,L-NAME可以通过降低NO浓度以及降低MMP活性,从而缓解心肌炎心肌炎症和心室重构。
[1]Massilamany C,Gangaplara A,Steffen D,et al.Identification of novel mimicry epitopes for cardiac myosin heavy chain-α that induce autoimmune myocarditis in A/J mice[J].Cell Immunol,2011, 271(2):438-449.
[2]Bevan AL,Zhang H,Li Y,et al.Nitric oxide and Coxsackievirus B3 myocarditis:differential expression of inducible nitric oxide synthase in mouse heart after infection with virulent or attenuated virus [J].J Med Virol,2001,64(2):175-182.
[3]韩丽娜,李铁岭,丁国雷,等.人心肌C蛋白诱导实验性自身免疫性心肌炎模型的建立[J].中华心血管病杂志,2012,40(8): 690-696.
[4]Haasken S,Auger JL,Binstadt BA.Absence of β2integrins impairs regulatory T cells and exacerbates CD4+T cell-dependent autoimmune carditis[J].J Immunol,2011,187(5):2702-2710.
[5]Maffei A,Di Pardo A,Carangi R,et al.Nebivolol induces nitric oxide release in the heart through inducible nitric oxide synthase activation[J].Hypertension,2007,50(4):652-656.
[6]Zenebe WJ,Nazarewicz RR,Parihar MS,et al.Hypoxia/reoxygenation of isolated rat heart mitochondria causes cytochrome c release and oxidative stress;evidence for involvement of mitochondrial nitric oxide synthase[J].J Mol Cell Cardiol,2007,43(4):411-419.
[7]Brown GC,Borutaite V.Nitric oxide and mitochondrial respiration in the heart[J].Cardiovasc Res,2007,75(2):283-290.
[8]Hulsmans M,Van Dooren E,Holvoet P.Mitochondrial reactive oxygen species and risk of atherosclerosis[J].Curr Atheroscler Rep, 2012,14:264-276.
[9]Beckman JS,Beckman TW,Chen J,et a1.Apparent hydroxyl radical production by peroxynitrite:Implications for endothelial injury from nitric oxide and superoxide[J].Proc Natl Acad Sci USA. 1990,87(4):1620-1624.
[10]Matsumoto Y,Park IK,Kohyama K.Matrix metalloproteinase (MMP)-9,but not MMP-2,is involved in the development and progressi on of C protein-induced myocarditis and subsequent dilated cardiomyopathy[J].J Immunol,2009,183(7):4773-4781.
Protective effect of L-NAME on experimental autoimmune myocarditis.
PENG Jin1,LI Tie-ling2,HAN Li-na2, LIN Xiao-ming1,HE Shuang3.1.Department of Cardiology,the 187thHospital of Chinese PLA,Haikou 571100,Hainan, CHINA;2.Department of Physiotherapy for Cadres,the General Hospital of Chinese PLA,Beijing 100853,CHINA;3.First Department of Cardiovascular Internal Medicine,the General Hospital of Chinese PLA,Beijing 100853,CHINA
ObjectiveTo investigate the therapeutic effect of NG-nitro-L-arginine methyl ester(L-NAME) on experimental autoimmune myocarditis(EAM)in Lewis rats,and to explore the possible therapeutic mechanism.MethodsTwenty EAM Lewis rats were treated by injection of myocardial C protein emulsified in completed Freund adjuvant in double footpad and intraperitoneal injection of pertussis toxin.EAM Lewis rats were divided into the treatment group and control group(each with 10 cases).In the treatment group,the treatment protocol was intraperitoneal administration of L-NAME(5 mg·kg-1·d-1)after immunization for 20 days.While in control group the same dose of normal saline was intraperitoneally injected in the same period of time.After experiment at the designate time point,the rats were euthanatized,and their hearts were harvested and tested.Paraffin sections were used for hematoxylin and eosin(HE)stain to determine the inflammation score,for immunohistological stain to determine the infiltration of T lymphocytes,and for picrosirius stain to determine fibrosis score and collagen content.Nitrate reductase method was used to detect serum NO level and gelatin zymography assay to detect the activity of gelatinase.ResultsThe inflammation score in cardiac paraffin slides[(3.42±0.31)vs(2.51±0.22),P<0.01],infiltration of T lymphocytes[(28.2±4.6)vs(13.2±1.9),P<0.01],myocardial interstitial fibrosis score[(2.33±0.26)vs(1.14±0.17),P<0.01],serum NO level[(68.34±8.61)μmol/L vs (45.71±6.53)μmol/L,P<0.01]and activity of gelatinase[(254 526±4 729)vs(184 712±3 869),P<0.01]in treatment group were all significantly lower than in control group.ConclusionL-NAME plays an important role in the pathogenesis of autoimmune myocarditis,and its mechanism may be related to the decrease of serum NO level and gelatinase activity in decreasing myocardial inflammatory cells infiltration and delaying myocardial interstitial fibrosis.
Myocarditis;L-NAME;Nitric oxide;Matrix metalloproteinase
R542.2+1
A
1003—6350(2015)01—0011—05
10.3969/j.issn.1003-6350.2015.01.0004
2014-06-26)
中国人民解放军总医院临床科研扶持基金(编号:2012FC-TSYS-2024);海南省医学普通科研立项课题(编号:琼卫2012PT-66);三亚市医疗卫生科技创新项目(编号:YW1306)
李铁岭。E-mail:ltl301@2008.sina.com;韩丽娜。E-mail:hanlina3399111@sina.com
