平滑处理和扫描范围对多孔膜原子力显微镜分析的影响
2015-04-10王锐杨浩
王锐,杨浩*
武汉工程大学化工与制药学院,湖北 武汉 430074
平滑处理和扫描范围对多孔膜原子力显微镜分析的影响
王锐,杨浩*
武汉工程大学化工与制药学院,湖北 武汉 430074
原子力显微镜(AFM)能获得材料表面形貌、三维图、表面粗糙度等信息,是定量分析材料表面的主要工具之一.以自制的多孔膜为研究对象,通过对AFM图像的平滑处理以及改变扫描范围,系统研究了上述因素对多孔膜孔深和表面粗糙度参数测量的影响.结果表明,多孔膜的AFM图像经平滑处理后局部会发生扭曲,多孔部分与膜之间的界限变得模糊,使孔深测量偏差较大,不能完全反映膜的表面微观结构.当扫描范围较小时(≤2 μm×2 μm),孔深和表面粗糙度参数测量的相对误差较小,而不同扫描范围下得到的表面粗糙度参数的相对标准偏差有较大差异.最大高度和最大孔深的相对标准偏差达到了25%以上,平均粗糙度和均方根粗糙度相对标准偏差在15%左右,而平均最大孔深的相对标准偏差小于3.5%.
原子力显微镜;平滑处理;扫描范围;多孔膜;表面粗糙度
0 引言
原子力显微镜(AFM)是材料表面分析的强有力的工具.它的检测范围很广,可以分析生物细胞[1-2]、膜材料[3-4]和纳米颗粒[5].由于AFM分辨率极高,能达到原子级别,人们还可以利用AFM来观测多肽[6]、生物小分子[7]和氢键的形成[8].此外,由于AFM的工作原理不同于常见的电子显微镜,它不仅可以分析材料的表面形貌和粗糙度[9],还可以检测材料的力学性能[10],因此AFM在材料的分析和检测中起到越来越重要的作用.
近年来,人们已利用AFM来分析不同材料的表面形貌和粗糙度,例如,碳纤维[11]、人工晶体生物材料[12]、牙齿复合材料[13]、粪链球菌生物膜[14]和人体血红球膜[15].然而,AFM在测量的准确度上存在一些限制[16],并有研究发现扫描分辨率、扫描速率、反馈控制参数、探针材料及其半径对粗糙度测量具有一定的影响[17-20].同时,人们也发现采用不同的扫描范围得到的材料机械性能和粗糙度的数值会有所不同[21-22],需要通过数据处理来矫正这种扫描范围的依赖性[23],但这些结果都是在特定的系统中得到的,不具有普适性.因此,要准确测量材料的表面粗糙度需要针对特定的形貌,并了解和掌握不同参数对其测量结果的影响.
本研究以自制的壳聚糖多孔膜为模型,通过改变AFM扫描范围并对图像进行平滑处理,探讨以上因素对表面形貌、孔深和表面粗糙度参数测量的影响.研究随机选取了三个孔作为研究对象,通过AFM图像和截面分析(section analysis)来研究平滑处理和扫描范围对表面形貌和孔深测量精度的影响,然后通过AFM的粗糙度分析(roughness analysis)功能统计不同扫描范围下多孔膜粗糙度参数,并分析它们的相对偏差.有关AFM表面粗糙度参数见表1.

表1 AFM表面粗糙度的相关参数Table 1 The definitions of AFM surface roughness parameters
1 实验部分
1.1 壳聚糖多孔膜的制备
壳聚糖多孔膜的制备工艺:将1.5 g壳聚糖与1.5 g PEG溶解在100 mL质量分数2%的醋酸溶液中,在此溶液中加入0.3 mL的戊二醛并不断搅拌,静置脱泡后将铸模液倒入玻璃皿中,然后放入烘箱在40℃烘干12 h.将干燥后的膜放入质量分数2%的NaOH溶液中浸泡30 min中和多余的醋酸,之后再用去离子水冲洗除去OH-,再将膜放在90℃热水浴中抽取10 h.热水处理不仅可以溶解膜中的PEG,得到多孔结构,还可以改善膜的机械性能.将抽取后的膜固定在玻璃皿上,用滤纸吸干后自然晾干即可得到壳聚糖多孔膜.
1.2 原子力显微镜表征
采用美国Veeco公司生产的Multi-Mode型原子力显微镜对多孔膜进行测量.扫描采用RTESP型硅探针(Veeco),采用轻敲模式在空气中进行测量,扫描频率为1 Hz,分辨率为256×256,扫描范围分别为10 μm×10 μm、5 μm×5 μm、2 μm×2 μm和1 μm×1 μm.
图像数据的采集及分析用该仪器配置的软件(v5.31r1)进行处理.图像的平滑处理为3级平滑处理.样品表面的粗糙度参数是通过软件的粗糙度分析功能对整个AFM图像直接计算得到的.
2 结果与讨论
2.1 平滑处理对多孔膜孔深测量的影响
当光滑的表面偶尔出现较高的特征峰时,我们通常会采用平滑处理的方式以去除图像中出现的扫描线,得到清晰的AFM图像.但目前为止还没有研究报道AFM图像平滑处理对膜表面分析的影响.
图1是多孔膜的原始AFM图.从图中可知,样品表面存在着很多大小不一的多孔结构.当扫描范围≥5 μm×5 μm时,所得到的AFM图像高低不平,特别是当扫描范围达到10 μm×10 μm时出现了较大的起伏,如图a中间部分出现了明显的凹陷;而当扫描范围≤2 μm×2 μm时,可知膜的表面比较平整,没有明显的凸起,多孔部分与平整部分对比度明显,图像清晰(图c,d).
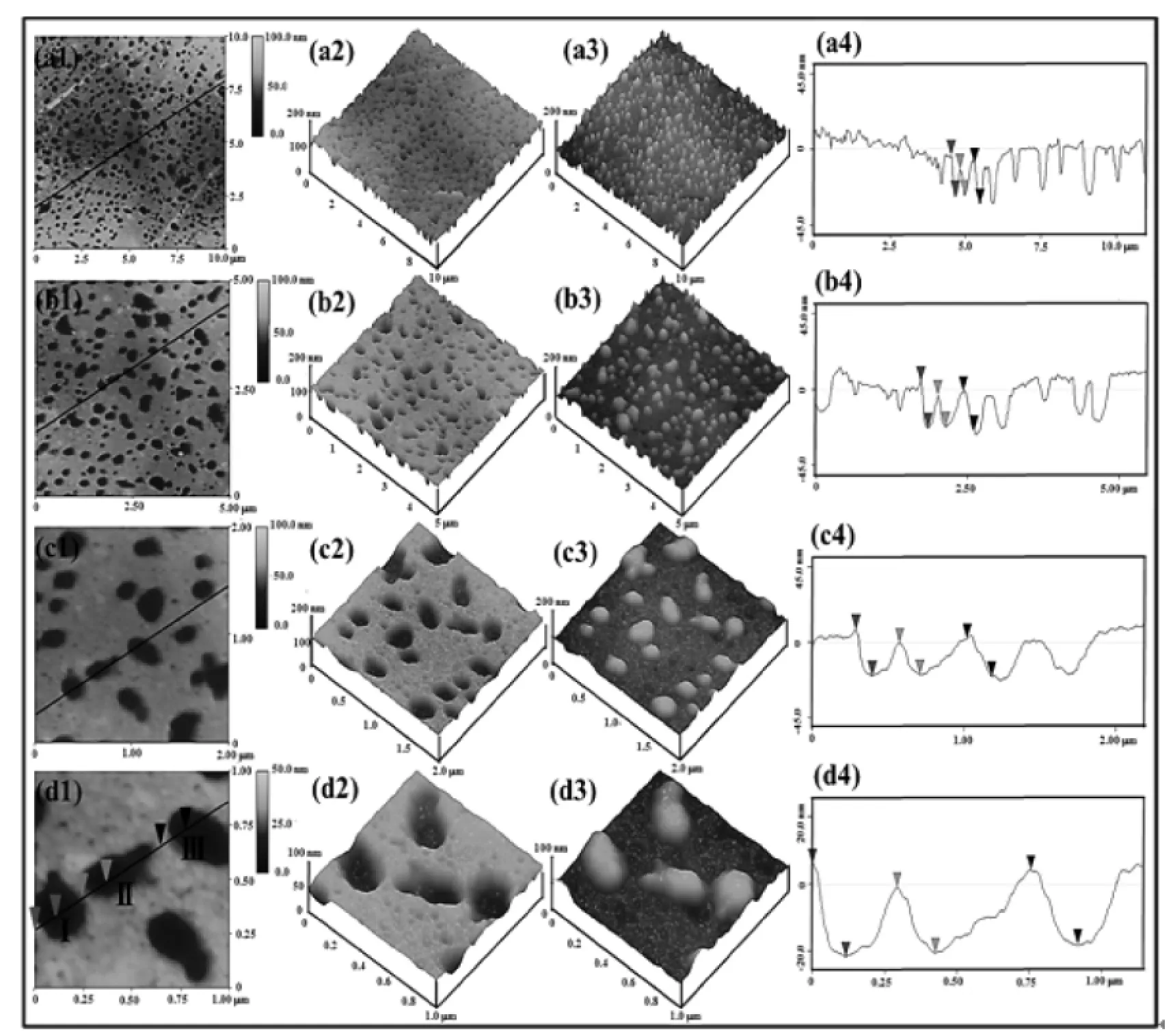
图1 扫描范围分别为10μm×10μm(a1-a4),5μm×5μm(b1-b4),2μm×2μm(c1-c4)和1μm×1μm(d1-d4)的多孔膜原始AFM图Fig.1 Pristine AFM images of porous film under different scan size:10 μm×10 μm(a1-a4),5 μm×5 μm(b1-b4),2 μm×2 μm(c1-c4)and 1μm×1 μm(d1-d4)
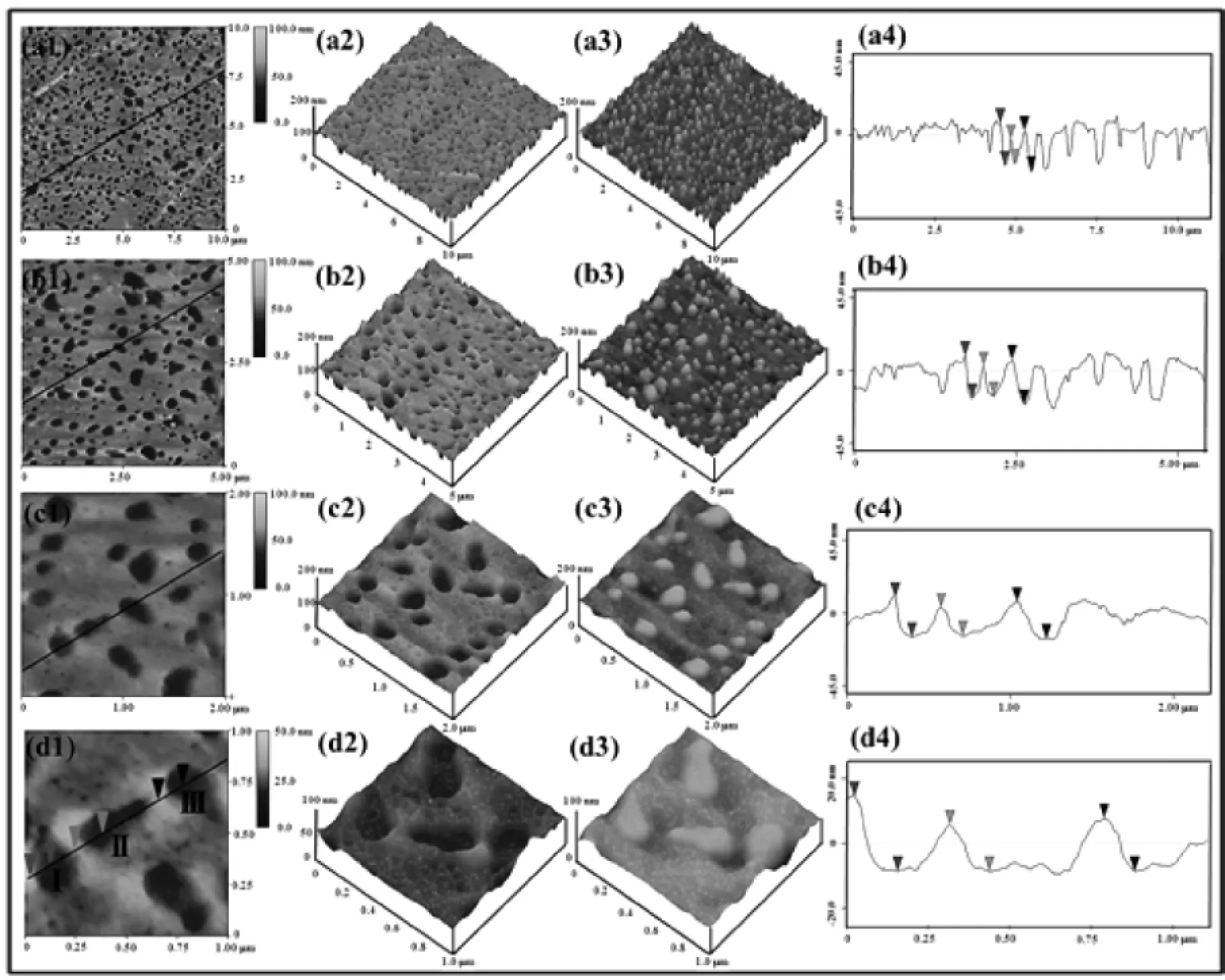
图2 平滑处理后扫描范围分别为10 μm×10 μm(a1-a4),5 μm×5 μm(b1-b4),2 m×2 m(c1-c4)和1μm×1μm(d1-d4)的多孔膜AFM图Fig.2 Flattening AFM images of porous film under different scan size:10 μm×10 μm(a1-a4),5 μm×5 μm(b1-b4),2 μm×2 μm(c1-c4)and 1μm×1 μm(d1-d4)
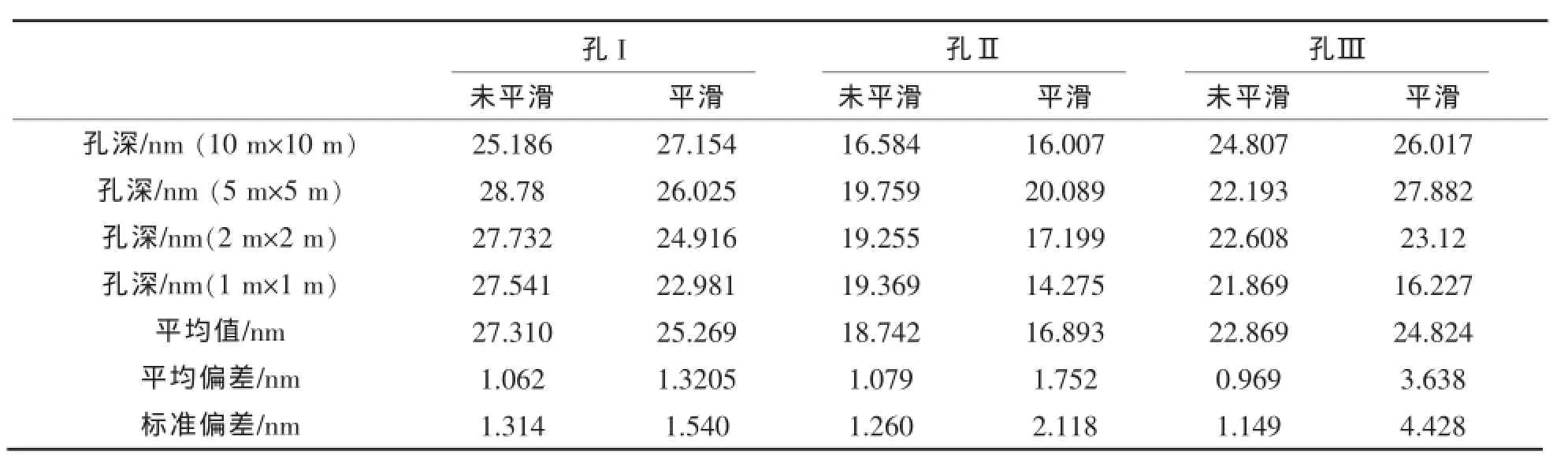
表2 孔Ⅰ、孔Ⅱ和孔Ⅲ的深度及偏差分析Table 2 The depths and deviation analyses of pore I,poreⅡand poreⅢ
从倒置的三维立体图可进一步知多孔结构在膜下面的分布情况,也可知不同扫描范围下多孔结构与膜之间过渡较平滑,没有出现明显的图像扭曲,即使在较大的扫描范围下,图像的起伏是整体的波动,局部上仍然是平整的.
图2是经过平滑处理后多孔膜的AFM图.通过与图1比较发现,经平滑处理后,当扫描范围≥5 μm×5 μm时,原来整体出现起伏的图像变得较平整,如图a,b.但当扫描范围≤2 μm×2 μm时,原来平整的表面出现了起伏,特别是当扫描范围只有1 μm×1 μm时,多孔结构之间的区域出现了明显的凸起,如图d所示.从三维图和倒置的三维图可知,平滑处理后多孔结构与膜之间的对比度降低,界限变得模糊(图d2,d3),且膜的局部出现了更多起伏,说明平滑处理对AFM图像产生了一定的扭曲.
为了进一步研究平滑处理对孔深测量的影响,采用截面分析(section analysis)在同一条线上选取了3个孔,分别记为孔Ⅰ、孔Ⅱ和孔Ⅲ(如图1(d1)和图2(d1)),并分别得到平滑处理前后不同扫描范围下三个孔的截面分析图(图1,2第四栏).从截面分析图中可以得到多孔膜在垂直方向上的波动曲线,从而测得不同孔的深度,其结果列于表2.
通过对表2数据进行偏差分析可得到平滑处理前后对孔深测量精确度的影响.从表2数据分析可知,孔Ⅰ、孔Ⅱ和孔Ⅲ经过平滑处理后的孔深平均偏差和标准偏差均要大于平滑处理前的,如孔Ⅲ平滑处理后孔深的标准偏差为处理前的3.85倍,说明平滑处理导致了孔深测量精确度的降低.这是因为对AFM图像进行平滑处理会将像素与周边像素做加权平均,使得数据产生一定的偏差.因此,为了减小测量误差,得到真实的多孔膜表面的粗糙度参数,本实验后期所讨论的粗糙度参数均是在原始的AFM图像中得到的.
2.2 扫描范围对多孔膜粗糙度参数测量的影响
在相同扫描频率下改变扫描范围会改变探针的移动速率,从而导致AFM图像的差异.我们对原始的AFM图像(图1)在不同扫描范围下得到的孔深的相对误差进行分析,得到表3.从表3可知,孔Ⅰ、孔Ⅱ和孔Ⅲ的深度的相对误差随着扫描范围的减小有明显的降低趋势,但相对误差并不完全随着扫描范围的减小而降低.当扫描范围降至2 μm×2 μm以下时,相对误差产生了不确定的变化趋势,有的变大(如孔Ⅱ和孔Ⅲ),有的变小(如孔Ⅰ),但总体上相对误差较小,在3%左右波动.因此,扫描范围在2 μm×2 μm及以下时所测的孔深相对误差较小.

表3 不同扫描范围下孔深的相对误差(原始AFM图)Table 3 The relative errors of pore depths under variant scan sizes(for pristine AFM images)
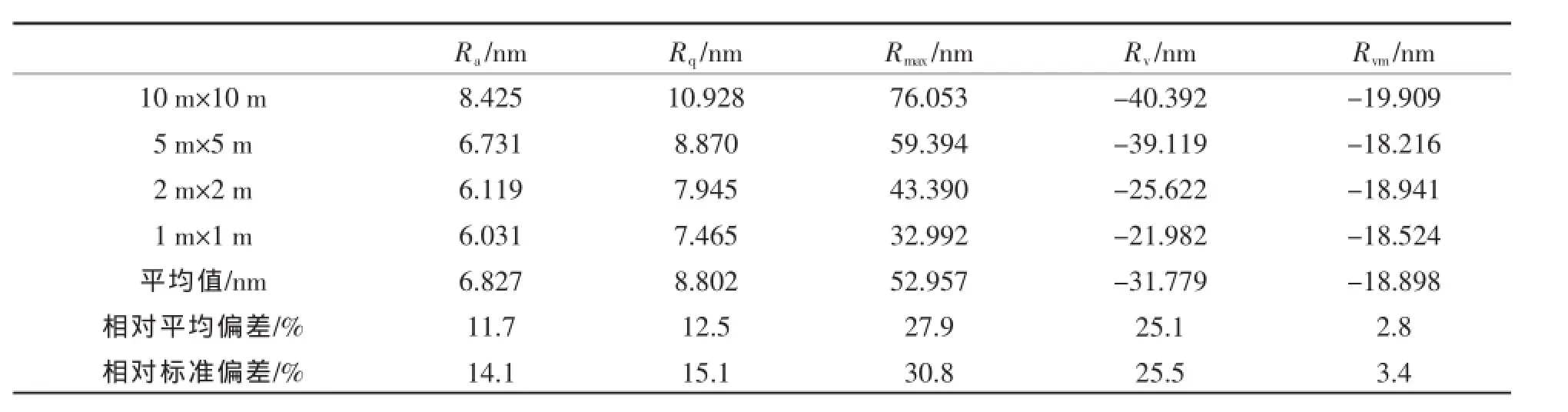
表4 不同扫描范围下表面粗糙度参数(原始AFM图)Table 4 Surface roughness parameters under variant scan sizes(for pristine AFM images)
以上分析只是针对个别孔洞进行的,不能代表多孔膜整体的粗糙度,因此我们对不同扫描范围下的AFM图像进行粗糙度分析(roughness analysis),得到统计学意义上的表面粗糙度参数,见表4.
由表4可知,扫描范围对不同表面粗糙度参数的影响不同.其中,最大高度和最大孔深影响最大,其相对标准偏差达到了25%以上,而平均粗糙度和均方根粗糙度影响居中,相对标准偏差在15%左右,影响最小的是平均最大孔深,相对标准偏差小于3.5%.这说明在测量多孔膜表面粗糙度时,要考虑各种粗糙度参数对扫描范围的依赖性,从实验结果可知,平均最大孔深的结果是不依赖扫描范围的,而平均粗糙度和最大高度等参数的测量最好是在同一扫描范围内进行.此外,从表4还可发现,当扫描范围较小时(≤2 μm×2 μm),各表面粗糙度参数在数值上较接近,因此,适当减小扫描范围有利于粗糙度参数测量精确度的提高.
3 结语
a.在较大的扫描范围下,AFM图像会发生整体的波动,但局部上仍然是平整的;
b.平滑处理后多孔结构与膜之间的对比度降低,界限变得模糊,且膜的局部出现了更多起伏,说明平滑处理对AFM图像产生了一定的扭曲;
c.孔深的相对误差随着扫描范围的减小有明显的降低趋势,且当扫描范围在2 μm×2 μm及以下时所测的孔深相对误差较小;
d.经过平滑处理后的孔深平均偏差和标准偏差均要大于平滑处理前的,说明平滑处理导致了孔深测量精确度的降低;
e.不同表面粗糙度参数对扫描范围的依赖性不同:最大高度和最大孔深依赖性最大,平均粗糙度和均方根粗糙度依赖性居中,而平均最大孔深几乎不存在依赖性.可通过适当减小扫描范围提高粗糙度参数测量的精确度.
致谢
感谢国家自然科学基金委员会,湖北省教育厅和武汉工程大学团委的资助.
[1]MULLER D J,DUFRENE Y F.Atomic force microscopy:a nanoscopic window on the cell surface[J].Trends Cell Biol,2011,21(8):461-469.
[2]杨浩,宋涛,赵慧平,等.大肠杆菌在原子力显微镜下的观测及其形貌[J].武汉工程大学学报,2012,34(12):8-12.
YANG Hao,SONG Tao,ZHAO Hui-ping,et al.I-maing and morphology of Escherichia coli using atomic force microscopy[J].J Wuhan Inst Tech,2012,34(12):8-12.(in Chinese)
[3]WONG P C Y,KWON Y N,CRIDDLE C S.Use of atomic force microscopy and fractal geometry to characterize the roughness of nano-,micro-,and ultrafiltration membranes[J].J Membr Sci,2009,340(1-2):117-132.
[4]江川,汪建华,熊礼威,等.基片温度对纳米金刚石薄膜制备的影响[J].武汉工程大学学报,2012,34(4):39-42.
JIANG Chun,WANG Jian-hua,XIONG Li-wei,et al.Influence of substrate temperature on preparation of nano-crystalline diamond films[J].J Wuhan Inst Tech,2012,34(4):39-42.(in Chinese)
[5]HOO C M,STAROSTIN N,WEST P,et al.A comparison of atomic force microscopy(AFM)and dynamic light scattering(DLS)methods tocharacterize nanoparticle size distributions[J].J Nanopart Res,2008(10):89-96.
[6]ZHANG S,ANDREASEN M,NIELSEN J T,et al.Coexistence of ribbon and helical fibrils originating from hIAPP(20-29)revealed by quantitative nanomechanical atomic force microscopy[J].Proc Natl Acad Sci U S A,2013,110(8):2798-2803.
[7]KATAN A J,DEKKER C.High-speed AFM reveals the dynamics of single biomolecules at the nanometer scale[J].Cell,2011,147(5):979-982.
[8]ZHANG J,CHEN P C,YUAN B K,et al.Real-space identification of intermolecular bonding with atomic force microscopy[J].Science,2013,342(6158):611-614.
[9]KAVEI G,ZARE Y,GHEIDARI A M.Evaluation of surface roughness and nanostructure of indium tin oxide(ITO)films by atomic force microscopy[J].Scanning,2008,30(3):232-239.
[10]ZHANG W,STACK A G,CHEN Y S.Interaction force measurement between E.coli cells and nanoparticles immobilized surfaces by using AFM[J].Colloids Surf B-Biointerfaces,2011,82(2):316-324.
[11]JAGER J,MOOSBURGER-WILL J,HORN S.Determination of nano-roughness of carbon fibers by atomic force microscopy[J].J Mater Sci,2013,48(19):6803-6810.
[12]MUKHERJEE R,CHAUDHURY K,DAS S,et al.Posterior capsular opacification and intraocular lens surface micro-roughness characteristics:An atomic force microscopy study[J].Micron,2012,43(9):937-947.
[13]DA SILVA M A B,FARDIN A B,de Vasconcellos R C C,et al.Analysis of roughness and surface hardness of a dental composite using atomic force microscopy and microhardness testing[J].Microsc Microanal,2011,17(3):446-451.
[14]SANTOS R P,ARRUDA T T P,CARVALHO C B M,et al.Correlation between Enterococcus faecalis biofilms development stage and quantitative surface roughness using atomic force microscopy[J].Microsc Microanal,2008,14(2):150-158.
[15]GIRASOLE M,POMPEO G,CRICENTI A,et al.The how,when,and why of the aging signals appearing on the human erythrocyte membrane:an atomic force microscopystudyofsurfaceroughness[J].Nanomedicine-Nanotechnology Biology and Medicine,2010,6(6):760-768.
[16]EVES B J,GREEN R G.Limitations on accurate shape determination using amplitude modulation atomic force microscopy[J].Ultramicroscopy,2012,115:14-20.
[17]HRISTU R,STANCIU S G,STANCIU G A,et al.Influence of atomic force microscopy acquisition parameters on thin film roughness analysis[J].MicroscRes Tech,2012,75(7):921-927.
[18]WANG C M,ITOH H.Evaluation of errors in the measurement of surface roughness at high spatial frequency by atomic force microscopy on a thin film[J].Jpn J Appl Phys,2012,51(8):08KB11-08KB11-5.
[19]李家文,陈宇航,黄文浩.AFM扫描参数对表面粗糙度测量的影响分析[J].电子显微学报,2007,26(1):32-35.
LI Jia-wen,CHEN Yu-hang,HUANG Wen-hao.Study on the scanning parameters affecting surface roughness measurements by AFM[J].J Chin Electr Microsc Soc,2007,26(1):32-35.(in Chinese)
[20]王子仪,张荣君,郑玉祥,等.AFM扫描参数对样品粗糙度测量的影响[J].实验室研究与探索,2013,32(2):5-7.
WANG Zi-yi,ZHANG Rong-jun,ZHENG Yu-xiang,et al.Influence of AFM scanning prarameters on surface roughness measurement[J].Res Explor Lab,2013,32(2):5-7.(in Chinese)
[21]LOPARIC M,WIRZ D,DANIELS A U,et al.Micro-and nanomechanical analysis of articular cartilage by indentation-type atomic force microscopy:Validation with a gel-microfiber composite[J].Biophys J,2010,98(11):2731-2740.
[22]MENDEZ-VILAS A,BRUQUE J M,GONZALEZMARTIN M L.Sensitivity of surface roughness parameters to changes in the density of scanning points in multi-scale AFM studies.Application to a biomaterial surface[J].Ultramicroscopy,2007,107(8):617-625.
[23]ANTONIO P D,LASALVIA M,PERNA G,et al.Scale-independent roughness value of cell membranes studied by means of AFM technique[J].Biochim Biophys Acta-Biomembr,2012,1818(12):3141-3148.
Influence of flattening and scan size on surface analysis of porous film using atomic force microscopy
WANG Rui,YANG Hao
School of Chemical Engineering and Pharmacy,Wuhan Institute of Technology,Wuhan 430074,China
Atomic force microscopy(AFM)is one of the powerful instruments which can acquire information about surface morphology,three-dimensional(3D)image and surface roughness of materials.Taking homemade chitosan porous film as the research object,the influences of scan size and flattening of the AFM image on the measurement of morphology,pore depth and surface roughness parameters were systematically studied.The results show that AFM images,which are locally smooth,fluctuate overall at larger scan size.Besides,AFM images distort partially after they have been flatten,and the boundaries between the pore and the film become blurry,which enlarges the deviation of the measured pore depth and obscures the real surface microstructures.The relative errors of the pore depth decrease dramatically with the reduction of the scan size,and they are smaller at minor scan sizes of≤2 μm×2 μm.Meanwhile,flattening the AFM images decreases the accuracy of the pore depth.With regard to various surface roughness parameters,their relative standard deviations show significant differences under variant scan sizes.The relative standard deviation of max high and max peak is over 25%,and that of mean roughness and root mean square roughness is about 15%.Nevertheless,the relative standard deviation of average max depth is less than 3.5%.
atomic force microscopy;flattening;scan size;porous film;surface roughness
O04-34;TH742.9
A
10.3969/j.issn.1674-2869.2015.07.008
1674-2869(2015)07-0034-06
本文编辑:张瑞
2015-05-05
国家自然科学基金项目(21201135);湖北省教育厅科学技术研究计划中青年人才项目(Q20121502);武汉工程大学第九期大学生校长基金(2014019)
王锐(1993-),男,湖北天门人,本科.研究方向:功能界面材料.*通信联系人
